4. Процеси на пренос
В система, намираща се в равновесие, температурата, концентрацията на различните вещества, налягането и други параметри имат еднакви стойности във всичките и части. При нарушаване на равновесното състояние, предизвикано от външни фактори, възникват потоци – на топлина, на вещество, на импулс, на ел. заряди и т.н. Тези явления носят общото име процеси на пренос. Към процесите на пренос, които се разглеждат в механиката, се отнасят дифузия – процес на пренос на вещество, топлопроводност - процес на пренос на кинетична енергия, и вътрешно триене - процес на пренос на импулс.
Процесите на пренос имат обща природа и могат да се обяснят чрез атомно-кинетичната теория, тъй като се реализират чрез поредица от микропроцеси. Тези процеси са свързани както с непосредствен пренос на вещество при дифузия, така и с пренос на енергия и импулс при топлопроводност и вътрешно триене. Възникват когато се формират градиенти на температурата, на концентрацията или на скоростта. Протичат в посока на намаляване на градиента, предизвикал процеса – т.е. на изравняване на концентрациите, на температурата или на скоростта на движение.
4.1. Дифузия
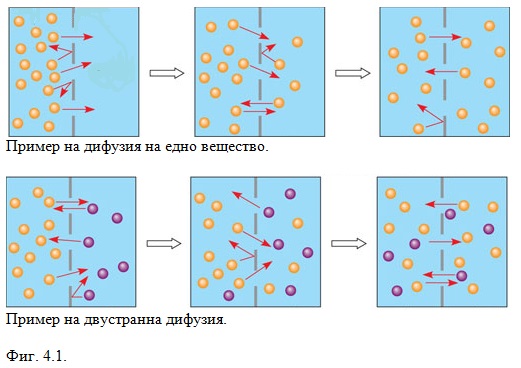
Дифузия е взаимното проникване на две вещества, които се намират в контакт едно с друго, чрез хаотичното топлинно движение на градивните им частици (Фиг. 4.1). Дифузия се наблюдава в газове, течности и твърди тела, като скоростта и е най-голяма в газовете и най-малка в твърдите тела, поради различната интензивност на хаотичното топлинно движение в различните агрегатни състояния.
Дифузия възниква при наличието в средата на градиент на концентрацията на дадено вещество. Освен в резултат на разлика в концентрациите дифузия може да възникне и в резултат на действието на някои външни полета. Например под действието на електрично поле възниква дифузия на заредени частици, която се нарича електродифузия. Силата на тежестта или градиент на налягането води до бародифузия, а в неравномерно нагрята среда възниква термодифузия.
Най-общо дифузията може да се опише по следния начин:
Фиг. 4.2.
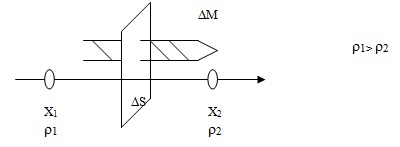
Нека в даден обем газ съществува нееднородност по отношение на плътността. Масата ΔM на пренесеното вещество през площ ΔS за време Δt ще бъде пропорционална на градиента на плътността 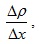 на площта и на интервала време. Освен от тези величини масата на пренесеното вещество ще зависи и от вида на газа (по-точно от молекулната му маса) и от температурата. Всичко това отразяваме като във формулата въвеждаме една величина, която се нарича коефициент на дифузия. Следователно
на площта и на интервала време. Освен от тези величини масата на пренесеното вещество ще зависи и от вида на газа (по-точно от молекулната му маса) и от температурата. Всичко това отразяваме като във формулата въвеждаме една величина, която се нарича коефициент на дифузия. Следователно
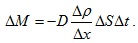
Тази формула представлява закона на Фик за дифузията. Можем да го изкажем по следния начин – Масата ΔМ на газа, пренесен чрез дифузия през повърхност с площ ΔS, перпендикулярна на посоката, в която намалява плътността, е пропорционална на площта ΔS, на интервала време Δt, и на градиента на плътността 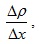 Знакът минус показва, че веществото се пренася в посока на намаление на плътността. D се нарича коефициент на дифузия. Физическият смисъл и единиците, с които се измерва коефициентът на дифузия можем да получим като го изразим от закона на Фик.
Знакът минус показва, че веществото се пренася в посока на намаление на плътността. D се нарича коефициент на дифузия. Физическият смисъл и единиците, с които се измерва коефициентът на дифузия можем да получим като го изразим от закона на Фик.
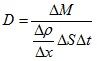
Следователно коефициентът на дифузия е равен на масата на пренесеното вещество при градиент на плътността единица, за единица време през единица площ.
Законът на Фик е всъщност закон за самодифузията. В случай на взаимна дифузия на две вещества, законът на Фик остава в сила, а коефициентът на взаимна дифузия се изразява чрез коефициентите на самодифузия на отделните газове. Например при два взаимно дифундиращи газа коефициентът на взаимна дифузия ще бъде
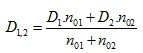
където D1 и D2 са коефициентите на самодифузия на двата газа, а n01 и n02 са концентрациите на първия и втория газ.
Дифузията на течности и твърди тела също се описва със закона на Фик. Понеже частиците на течностите не се движат свободно като газовите частици, коефициентът на дифузия при течностите има стойност хиляди пъти по-малка стойност отколкото при газовете. Той зависи освен от температурата и от вискозитета на средата и от формата и размерите на дифундиращите частици. 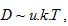 където u – подвижността на дифундиращите частици, k – константа на Болцман, T – термодинамичната температура. За сферични частици u=1/6π.η.r, където r е радиуса на частиците, а η – коефициента на вътрешно триене на средата.
където u – подвижността на дифундиращите частици, k – константа на Болцман, T – термодинамичната температура. За сферични частици u=1/6π.η.r, където r е радиуса на частиците, а η – коефициента на вътрешно триене на средата.
Дифузията при течностите зависи и от взаимната разтворимост на дифундиращите вещества. Например при вода и масло дифузия практически не настъпва. Други течности могат да се смесват помежду си във всяко съотношение, например вода и спирт.
Вещества в различни агрегатни състояния също могат да дифундират помежду си. Дифузия на твърди тела в течности се нарича разтваряне, на течности в газове – изпарение, на твърди тела в газове – сублимация, на газове в течности и твърди тела – абсорбция, на газове по повърхността на твърди тела – адсорбция.
Дифузия, която се осъществява когато дифундиращите вещества се допират непосредственно едно до друго се нарича свободна дифузия. Дифузия през пореста междинна среда (мембрана) се нарича несвободна. Дифузията през мембрана е особенно важна за биологията и медицината, тъй като чрез такива процеси се обменят газове при дишането и при други тъканни процеси, и се пренася вода през клетъчните мембрани. Около 98% от кислорода, необходим за организма, се поглъща в белите дробове в процеса на дифузия. Това става в алвеолите, които за възрастен човек имат обща площ около 70 m2. Алвеоларните стени са много тънки – около 0.5 μm, и са плътно оплетени от мрежа от капиляри, в които циркулира кръв с количество около 100 ml. Поради тази голяма площ и малка дебелина на мембраната, процесът на дифузия е много интензивен.
4.2. Осмоза.
Дифузия на вещества през полупропусклива мембрана, която разделя разтвор и чист разтворител или два разтвора с различна концентрация, но един и същи разтворител, и пропуска само молекулите на разтворителя, се нарича осмоза. Полупропускливата мембрана трябва да е такава, че да пропуска само молекулите на разтворителя, но не и молекулите на разтвореното вещество. Осмозата винаги се извършва от чистия разтворител към разтвора или от разредения разтвор към концентрирания разтвор (Фиг. 4.3). Физически това е едностранна дифузия на разтворителя.
За първи път осмоза е наблюдавана през 1748 г. от френския химик Нолле. Експериментално може да се наблюдава със следната опитна постановка.
Чистият разтворител преминава от лявата страна на съда през полупропуск-ливата мембрана към разтвора. В резултат на това нивото на течността в дясната страна на съда се повишава. Повишението продължава до някаква стойност и след това се преустановява. Следователно осмозата се прекратява когато върху мембраната действа допълнително налягане, в случая равно на хидростатичното налягане rgh, което упражнява повишеното ниво на разтвора. Това налягане се нарича осмотично. 1887 г. Вант-Хоф установява, че осмотичното налягане в разредени разтвори е числено равно на налягането, което би оказвало разтвореното вещество, ако то при дадената температура се е намирало в състояние на идеален газ и е заемало обем, равен на обема на разтвора.
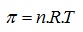
В тази формула π е осмотичното налятане, n – моларната концентрация, R – универсалната газова константа, T – термодинамичната температура на разтвора. Този закон се изпълнява точно за разтвори на вещества, които в разтвора не се дисоциират на йони. За разтвори на електролити или ако в разтвора става асоциация на разтворените частици във формулата се добавя множител, който отчита тези процеси.
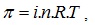
като i>1 при дисоциация на разтвореното вещество на йони, а при асоциация на частиците i<1. Следователно осмотичното налягане зависи от броя на “кинетичните елементи” – йони, молекули, асоциати или колоидни частици в разтвора. Осмотичното налягане може да достига до големи стойности – например 4% разтвор на захар при стайна температура има стойност около 0.3 МРа, а морската вода около 0.27 МРа.
Разтвори с еднакво осмотично налягане се наричат изотонични. Разтвор с осмотично налягане, по-високо от това на друг разтвор се нарича хипертоничен, а с по-малко осмотично налягане - хипотоничен.
Кръвта има осмотично налягани около 0.76 - 0.78 МРа. Такова осмотично налягане има и 0.86% разтвор на NaCl, който се нарича физиологичен. Основен дял за създаване на това налягане имат разтворените в кръвната плазма неорганични соли, тъй като поради малката им молекулна маса броят на молекулите им е голям. Белтъците, които са много повече като процент от сухото вещество на кръвната плазма, създават осмотично налягане само около 0.5 - 0.7 КРа. Ако клетки, например еритроцити се поставят в дестилирана вода (хипотоничен спрямо физиологичния разтвор), то в клетките навлиза вода, те набухват, порите на мембраната се увеличават и клетъчното съдържимо се излива навън (Фиг. 4.4). Ако клетка се постави в хипертоничен разтвор, то тогава вода излиза от клетката навън, клетката се свива и това води до гибел на клетката.
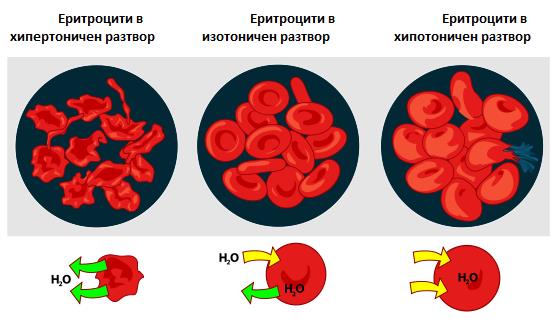
Фиг. 4.4.
Осмотичното налягане се измерва с помощта на осмометри. Те са два вида – статични и динамични. При статичните се измерва допълнителното хидростатично налягане по височината на стълба течност в тръбата на осмометъра след установяване на осмотично равновесие (Фиг. 4.5).
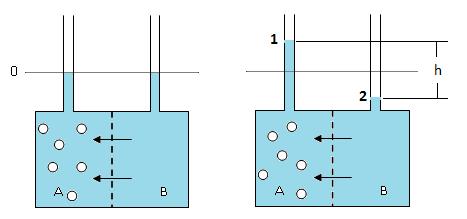
Фиг. 4.5.
A – камера с разтвор, В – камера с разтворител, 0 – начално ниво на течността в двете камери, 1 и 2 – височината на стълба течност в двете тръби на осмометъра след установяване на равновесие.
При динамичните осмометри се измерва скоростта на разреждане на разтвора. Осмометрията се използва за определяне на молекулната маса М на високомолекулни органични вещества (полимери, белтъци и др.), използвайки съотношението
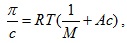
където с е концентрацията на полимера в разтвора, а А е коефициент, зависещ от строежа на макромолекулите.
4.3. Топлопроводност
Друг процес на пренос е топлопроводността – процес на пренос на кинетична енергия чрез хаотично топлинно движение на молекулите. Възниква когато в дадена среда има градиент на температурата (Фиг. 4.6). При температура T1>T2 възниква поток на топлина ΔQ.
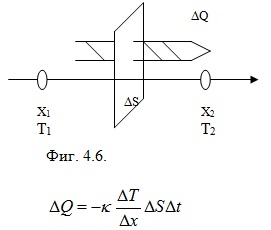
Тази формула представлява законът на Фурие за топлопроводността - т.е. количеството топлина ΔQ, пренесено през повърхност с площ ΔS, перпендикулярна на посоката, в която намалява температурата, е пропорционална на лицето ΔS, на интервала време Δt през който се извършва процесът, и на градиента на температурата ΔT/Δx. Във формулата κ се нарича коефициент на топлопроводност. Аналогично на коефициента на дифузия, коефициентът на топлопроводност е равен на количеството топлина, пренесено при градиент на температурата единица, за единица време през единица площ. Измерва се с J.K-1.m-1.s-1.
Различните вещества имат различен коефициент на топлопроводност. Металите имат голям коефициент на топлопроводност и са добри проводници на топлина. Газовете са лоши проводници на топлина (термос и Дюаров съд).
4.4. Вътрешно триене
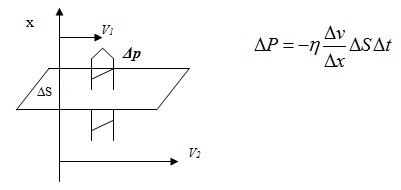
Вътрешното триене можем да разглеждаме като процес на пренос на импулс между два слоя флуид, движещи се с различни скорости (Фиг. 4.7). Тогава можем да напишем уравнение, подобно на тези, описващи дифузията и топлопроводността.
В тази формула η е коефициента на вътрешно триене.
Фиг. 4.7.
4.5. Общ вид на уравненията, описващи процесите на пренос
Вижда се, че всички процеси на пренос се описват с уравнения от един и същ тип.

Тези уравнения можем да преобразуваме, като разделим на ΔS.Δt. Тогава в лявата страна на уравнението ще имаме величина, представляваща потока на пренасяната величина – т.е. това, което се пренася през единица площ за единица време.
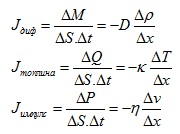
При всички случаи потокът на пренос зависи право пропорционално от градиента на величината, за която е нарушено равновесието и е предизвикала процеса, и от коефициент, който зависи от средата, в която се извършва процесът.




