5. Термодинамика. Основни понятия. Първи принцип на термодинамиката. Първи принцип на термодинамиката за биологични процеси. Закон на Хес. Трансформация на различни видове енергия в биологичните системи.
5.1 Основни понятия в термодинамиката
Термодинамиката е наука, изучаваща общите закономерности на превръщането на енергията при нейния пренос между телата под формата на топлина и работа, без отчитане на техния микроскопичен строеж.
Термодинамична система - съвкупност от макроскопични тела, които могат да взаимодействат помежду си или с други тела, като обменят енергия и/или вещество. Следователно за термодинамична система можем да считаме всяка система, която се състои от огромен брой структурни единици (атоми, молекули и т.н.).
Термодинамичните системи можем да разделим на две големи групи - отворени и затворени (изолирани). Затворените системи не обменят с околната среда нито енергия, нито вещество. Отворените системи могат да обменят или само енергия (тогава се наричат още закрити), или едновременно енергия и вещество (открити).В реалният свят няма абсолютно затворени системи. Изолирана система може да се разглежда като удобен модел на реалните системи.
Пълната енергия на една термодинамична система може да се представи като сума от кинетичната и потенциална енергия на телата, съставящи системата и вътрешната енергия U на градивните им частици.
Е = Екин +Епот + U
Вътрешната енергия е еднозначна функция на състоянието на термодинамичната система и не зависи от начина, по който системата е преминала в това състояние. Тя е сума от енергията на:
- хаотичното топлинно движение на атомите и молекулите, изграждащи телата, включени в системата;
- междумолекулните взаимодействия;
- междуатомните движения и взаимодействия в рамките на молекулите;
- вътреатомните движения и взаимодействия
Състоянието на една термодинамична система се описва с физични величини, наричани термодинамични параметри. Те характеризират макроскопичните свойства на системата. Такива са плътността, налягането, обемът, температурата.
Система, в която термодинамичните параметри се запазват постоянни с течение на времето и са еднакви в различните части на системата, e в равновесно състояние. Всяка затворена система след определен период от време преминава в равновесно състояние.
Преходът на една термодинамична система от едно състояние в друго се нарича термодинамичен процес. Термодинамичните процеси можем да класифицираме по няколко начина:
- Равновесни и неравновесни процеси.
- Обратими и необратими процеси
Равновесен е такъв процес, при който началното, крайното и всички междинни състояния са равновесни. Един процес е обратим, ако може да се извърши обратния процес през всички междинни състояния, така че при връщането на системата в изходното състояние да не са настъпили никакви изменения в околната среда. Можем да считаме, че равновесни процеси, които протичат безкрайно бавно, са обратими.
Равновесен процес и обратим процес са една физическа абстракция. Всички реални процеси са необратими дори само поради наличието на триене, при което част от енергията на системата се преобразува в топлина и се разсейва в околното пространство.
5.2.Първи принцип на термодинамиката
Първият принцип на термодинамиката представлява обобщение на закона за запазване на енергията при процеси, свързани с преобразуване на топлина.
В отворена система, която обменя с външната среда само енергия, но не и вещество, общото изменение на вътрешната енергия се определя от обмененото с обкръжаващите я тела количество топлина Q и от работата А, която извършват вътрешните сили.
DU = Q – A
Следователно изменението на вътрешната енергия на една термодинамична система може да се извърши по два начина - чрез топлообмен и чрез извършване на работа.
Първият принцип на термодинамиката е валиден и за живите организми. Първичният източник на енергия за всички живи организми на Земята е Слънцето неговото лъчение. Растенията поглъщат част от това лъчение и го използват като източник на енергия в процеса на фотосинтеза. В резултат на фотосинтезата се синтезират органични вещества.
6СО2 +6Н2О = С6Н12С6 + 6О2
Организмите, които не могат да фотосинтезират, получават необходимата им енергия чез окисление с атмосферен кислород на приетите растителни продукти. Следователно организмите не са независими източници на някаква нова енергия. Животните работят като химическа машина. Всички видове работа в организмите се извършват за сметка на еквивалентно количество енергия, отделено при окислението на хранителните вещества.
5.3 Закон на Хес
Топлинният ефект на сложни биохимични реакции в живите организми може да бъде изчислен, като се използва законът на Хес, който е следствие от първия принцип на термодинамиката. Той гласи, че топлинният ефект на химичен процес, протичащ в система при постоянен обем или постоянно налягане, осъществяван чрез редица междинни стадии, не зависи от начина на прехода, а само от началното и крайното състояние на системата (Фиг. 5.1).
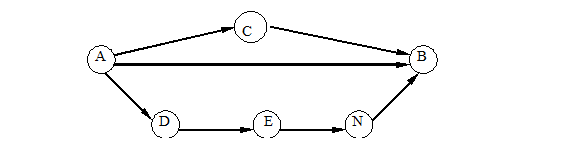
Фиг. 5.1.
QAB = QAC +QCB = QAD +QDE +QEN + QNB
Законът на Хес широко се използва в биологията за определяне на енергийната стойност на хранителни продукти, интензивността на обмяната на веществата и др. Продуктите (храни, фуражи) се изгарят в термостат и се определя количеството топлина, образувана при окислението на тези продукти от кислорода. В съответствие със закона на Хес, същото количество топлина се отделя при окислението на тези продукти вътре в организма. Една от основните реакции, протичащи в организма на животните, е реакцията на окисление на глюкозата. При взаимодействието на 1 mol глюкоза с 6 mol О2 (134.4 l) се отделят 6 mol СО2 и се отделя 2870 kJ топлина.
С6Н12О6 + 6 О2 = 6 СО2 + 6 Н2О + 2870 kJ
Следователно при използването на 1 l O2 или отделянето на 1 l СO2 от организма се отделя 21,35 kJ топлина.
В селското стопанство топлопродукцията се измерва по метода на пряката или непряката калориметрия. При непряката калориметрия на главата на животното се слага херметически затворена респирационна камера, позволяваща да се измери количеството на О2, използван от животното , или на отделеното количество СO2. По-точни резултати се получават при пряката колориметрия, при която човека или животното се поставя в голям калориметър, при което може да се регистрира всичката отделена топлина - от изпарението от кожата, топлината, отделена с продуктите на метаболизма, отделения СO2 и др.
5.4 Видове работа и топлина в живите системи
Енергията, образуваща се при окислението на хранителните продукти, условно се разделя на две групи - първична и вторична. Първичната енергия се отделя в процеса на окислението, независимо от това дали организма извършва работа или не. Тази топлина отива за загряване на организмът и се разсейва в обкръжаващото пространство. Останалата енергия се натрупва в химични съединения като аденозинтрифосфат (АТФ), които имат високоенергетични химични връзки, и при разпадането на тези връзки се отделя енергия. Тази енергия организмът използва за извършване на основните процеси в него. Енергията, получавана в биологичните системи при хидролизата на АТФ, дава възможност в тях да се извършва механична, химична, осмотична, електрична и работа за излъчване и светене при някои организми.
Механична работа е преместване на части или цялото тяло на живите организми. Химична работа е работата за разграждане на приетите хранителни продукти на нискомолекулни компоненти и за синтеза на различни високомолекулни съединения от нискомолекулни. Осмотична работа е работата за пренос на вещества от област с по-ниска към област с по-висока концентрация, осъществяван чрез механизмите на активен пренос. Електричната работа е пренос на заредени частици в електрично поле, при което се създават и поддържат електрични градиенти. Работата за светене е излъчване на видима светлина от някои организми и свръхслабо светене на тъканите на всички живи същества (биохемилуминесценция).
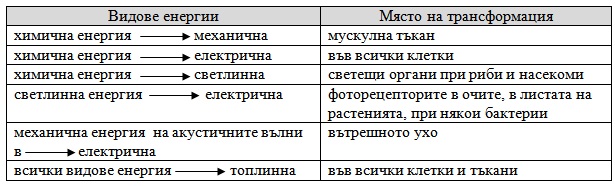
След извършване на съответната работа енергията отново се превръща в топлина. Топлината е крайния етап от трансформацията на енергията в живите организми. В таблицата по-долу за представени видовете енергии, които се трансформират в биологичните системи.
Превръщане на енергията в живите организми
6. Втори принцип на термодинамиката. Ентропия. Изменение на ентропията при различни термодинамични процеси. Изменение на ентропията в затворена и отворена термодинамична система.
Вторият принцип на термодинамиката дава посоката, в която стават термодинамичните процеси, независимо от тяхната конкретна природа. От опита е известно, че някои процеси в природата не се извършват, въпреки че не противоречат на първия принцип на термодинамиката. Например никога топлина не преминава самопроизволно от по-студено към по-топло тяло, или никога газ не се сгъстява самопроизволно в една част от съда, в който се намира.
Съществуват няколко формулировки на втория принцип на термодинамиката:
- Топлина не може самопроизволно да премине от по-студено към по-топло тяло.
- Не е възможен вечен двигател от втори род, т.е. такъв термодинамичен процес, при който единствения резултат да бъде превръщането на топлината изцяло в работа. Известна част от предаденото на системата количество топлина трябва да се отдаде на охладител.
Вторият принцип на термодинамиката може да се представи и аналитично, т.е. чрез формула. За това трябва да се въведе величината ентропия S. Ентропията е функция на състоянието на системата, мярка за молекулния безпорядък в системата.
Какъв е смисълът на величината ентропия? Състоянието на една термодинамична система освен с макропараметри като налягане, обем и температура може да се опише и чрез състоянието на всяка една от градивните частици (например молекули), които го изграждат. Дадено макросъстояние може да се осъществи чрез различни микросъстояния. Броят на различните микросъстояния, чрез които може да се осъществи дадено макросъстояние, се нарича термодинамична вероятност на макросъстоянието W.
Нека разгледаме начините, по които четири обекта могат да се разположат в 2 части на един съд. В началото четирите обекта се разполагат в лявата част на съда (фиг 6.1 - А). След това имаме три обекта в лявата част и един в дясната (фиг. 6.1 - В). Това може да се реализира чрез четири различни начина и следователно термодинамичната вероятност на състоянието е W=4. Ако имаме два обекта в едната част, и два обекта в другата част, то това може да се реализира чрез 6 различни неповтарящи се начина (фиг. 5.1 - С), и термодинамичната вероятност на състоянието е W=6.
Болцман свързва термодинамичната вероятност с ентропията чрез формулата
S = k.lnW,
където k = 1.38 10-23 J.K-1 се нарича Болцманова константа, W - термодинамичната вероятност на макросъстоянието, ln - натурален логаритъм.
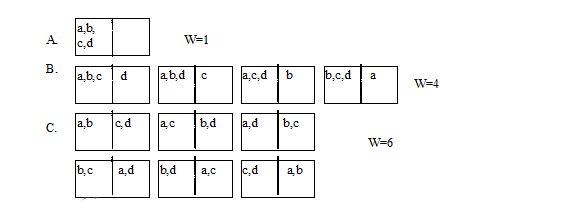
Фиг. 6.1.
Следователно на макросъстояние, за което W е по-голяма, съответствува по-голяма ентропия. Състояние, осъществено чрез малък брой начини, т.е. с малка W, се нарича подредено и то има малка стойност на ентропията. Състояние, което може да се осъществи чрез много различни микросъстояния, се нарича безпорядъчно или случайно. Такова състояние има голяма стойност на ентропията. Следователно ентропията е количествена мярка за степента на молекулен безпорядък в системата. Подредено състояние се характеризира с малка ентропия, а неподредено с голяма ентропия.
Ентропията на една закрита темодинамична система може да се променя при различни процеси – увеличаване на обема, промяна на температурата, протичането на химични реакции, фазови преходи и др. При някои от процесите ентропията се променя със скок, например при фазовите преходи, при които се променя структурата на веществото, като преминаването на кристално твърдо вещество в течност или течност в газ (фиг 6.2).
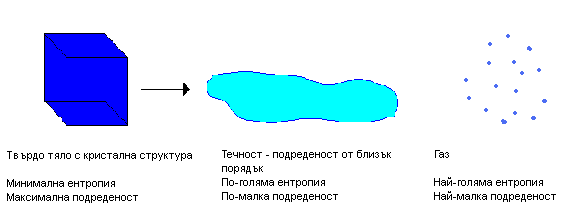
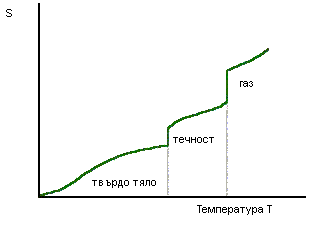
Фиг. 6.2.
При всички случаи нарастването на ентропията съответства на движение на системата към най-вероятното състояние.
При обратим процес ентропията остава постоянна, а при необратим процес се увеличава. Следователно може да се даде формулировка на втория принцип на термодинамиката чрез величината ентропия - ентропията на една затворена система не може да намалява при никакви процеси.
Следователно протичащите в изолирана система самопроизволни неравновесни процеси винаги предизвикват увеличение на ентропията до нейната максимална стойност в края на процесите при установяване на термодинамично равновесие.
ΔS ≥0
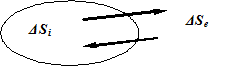
В отворена система, която взаимодейства и с външната среда, ентропията се променя за сметка на необратимите процеси, които протичат в системата, и за сметка на обмен на ентропия с външната среда (Фиг. 6.3).
ΔS = ΔSi + ΔSe,
където ΔS - общото изменение на ентропията, ΔSi - изменение на ентропията вътре в системата, ΔSe - изменение на ентропията, дължащо се на обмена с околната среда.
Фиг. 6.3.
Според вторият принцип на термодинамиката,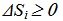
ΔSе може да бъде както по-голямо, така и по-малко от нула. Ако ΔSе < 0, и по абсолютна стойност е по-голямо от ΔSi , т.е. |ΔSе| >| ΔSi|, то общата ентропия на системата ще се намали.
ΔS < 0
Следователно в отворена система e възможно намаляване на общата ентропия на системата за сметка на взаимодействието и с околната среда.
По време на живота на един организъм едновременно протичат два противоположни процеса, свързани с изменение на ентропията. Единият е преобразуване на простите молекули от приетите хранителни вещества в сложни макромолекули, изграждащи тъканите и органите, при което ентропията намалява. Вторият е изхвърляне от организма чрез отделителната система на веществау състоящи се от прости молекули, което увеличава ентропията на околната среда.
Състоянието на една отворена система можем да опишем най-общо чрез скоростта на изменение на сумарната ентропия.
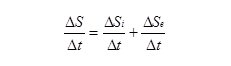
Това е математическа формулировка на втория принцип на термодинамиката за отворени системи. Следователно скоростта на изменение на ентропията е равна на сумата от скоростта на нарастване на ентропията вътре в системата при неравновесните процеси в нея и скоростта на обмен на ентропия с околната среда.
7. Топлопродукция на живите организми. Физически механизми за терморегулацията.
7.1 Топлопродукция на живите организми.
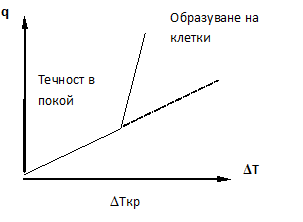
Топлопродукцията на животните зависи от тяхната маса М по следната формула: QT = kMn, където n = 0.75.
Следователно специфичната топлопродукция 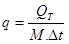 (количеството топлина, отделяна от единица маса за единица време) се намалява с увеличение на масата на животните (Фиг. 7.1). За компенсация на по-големите загуби на топлина при малките животни трябва по-интензивен метаболизъм и следователно потребление на повече храна. При студенокръвните животни топлопродукцията е около 25-30 пъти по-малка, отколкото при топлокръвните, тъй като поради по-малката разлика в температурата на тялото и околната среда топлообменът с външната среда е по-малък.
(количеството топлина, отделяна от единица маса за единица време) се намалява с увеличение на масата на животните (Фиг. 7.1). За компенсация на по-големите загуби на топлина при малките животни трябва по-интензивен метаболизъм и следователно потребление на повече храна. При студенокръвните животни топлопродукцията е около 25-30 пъти по-малка, отколкото при топлокръвните, тъй като поради по-малката разлика в температурата на тялото и околната среда топлообменът с външната среда е по-малък.
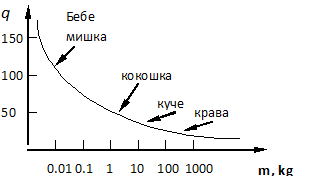
Фиг. 7.1.
7.2.Физически механизми на терморегулацията
Топлинното равновесие в живите организми се осъществява чрез четири основни механизма - топлопроводност, конвекция, топлинно излъчване и изпарение.
Топлопроводност може да става между твърди, течни или газообразни вещества при непосредствен контакт или чрез промеждутъчна среда, от места с по-висока към места с по-ниска температура. Количествено се описва със закона на Фурие
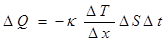
където 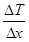 е градиента на температурата, κ е коефициента на топлопроводност, ΔS е контактната площ и Δt е времето. Тази формула може да се представи и чрез топлинния поток Jt
е градиента на температурата, κ е коефициента на топлопроводност, ΔS е контактната площ и Δt е времето. Тази формула може да се представи и чрез топлинния поток Jt
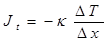
В живите организми тъканите имат различна топлопроводност. Значителна топлопроводност има мускулната тъкан. Това позволява бързо да се пренася топлина от вътрешните органи към външните, предотвратявайки прегряването на вътрешните органи. Мастната тъкан има по-малка топлопроводност. Подкожният слой мазнина възпрепятства бързото отделяне на топлина от организма при ниски външни температури. Затова животните, живеещи при студен климат имат дебел слой подкожна тлъстина.
Конвекция е предаване на топлина в течни и газообразни тела чрез размесване на студени и нагрети слоеве, т.е. свързана е с пренос на вещество (Фиг. 7.2).
Jk = a(Tп - Тс),
където Jk - конвекционния поток, Тп - температурата на нагрятата повърхност, Тс - температурата на средата. В живите организми конвекция се осъществява чрез кръвния поток.
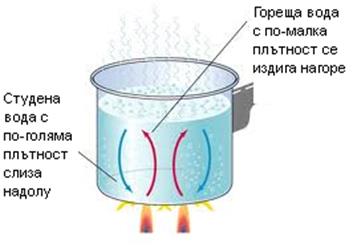
Фиг. 7.2.
Топлинно излъчване.
|
Фиг 7.3. |
Всички атоми и молекули излъчват електромагнитни вълни, отнасящи със себе си част от вътрешната енергия на телата. Топлинно излъчване имат всички тела, температурата на които е по-висока от температурата на абсолютната нула.
Максимумът на излъчване и разпределението на енергията на излъченото лъчение зависи от температурата на тялото (Фиг. 7.3). Интензивността на топлинното излъчване на абсолютно черно тяло Jизл, е пропорционална на четвърта степен на температурата. Jизл = σT4, където σ - константа на Стефан. За всички други тела се въвежда корекционен фактор ε.
Тъй като тялото излъчва и едновременно поглъща енергия от околната среда, то сумарния поток ще бъде
Jизл = εσ(T4кожа - T4въздух)
Тъй като потокът на излъчената енергия е пропорционален на Т4, 2 пъти увеличаване на температурата води до увеличаване на потока 16 пъти.
Топлоотдаването чрез излъчване за топлокръвните животни е до 50-60% от общото топлоотдаване. Максимумът на излъчването е в инфрачервения диапазон.
Изпарение
Изпарението води до охлаждане на тялото, тъй като първо се изпаряват молекулите с най-голяма енергия, и това води до намаляване на температурата на течността.
Изпарението зависи от температурата на външната среда и от влажността. При висока влажност процесът на изпарение се намалява и това води до прегряване на организма. При влажност под 40% пък се получава по-усилено изпарение и това може да доведе до обезводняване. При нормални условия загубата на топлина при потоотделяне и с издишания въздух е около 30% от топлопродукцията на човека.
При температури от 19 до 31оС, основният механизъм за топлоотдаване е излъчване и конвекция. При температури по-големи от 31оС се усилва ролята на изпарението. При температури по-малки от 19оС силно се свиват кръвоносните съдове, ролята на конвекцията намалява и намалението на температурата на тялото става основно чрез излъчване и топлопроводност.
8. Стационарно състояние на термодинамична система. Разлика между стационарно и равновесно състояние.
При отворени системи е възможно да съществува състояние, при което в различните части на системата стойностите на термодинамичните параметрите се различават, но в дадена точка на системата те не се изменят с течение на времето (Фиг. 8.1). Такова състояние на термодинамичната система се нарича стационарно.
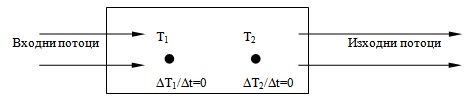
Фиг. 8.1.
В термодинамична система в стационарно състояние съществуват постоянни градиенти на някои параметри, с постоянна скорост протичат химични реакции и т.н. Това състояние се поддържа за сметка на потоци вещество и/или енергия, преминаващи през системата. В такова състояние ентропията остава постоянна с течение на времето, но не е максимална, и системата може да извършва работа.
В стационарно състояние
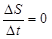
Следователно
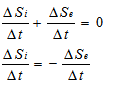
Съпоставка на термодинамична система в равновесно и стационарно състояние
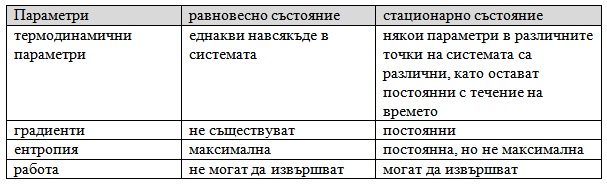
Съгласно принципа на Пригожин, критерий за устойчивост на стационарното състояние е скоростта на нарастването на ентропията вътре в системата вследствие на необратимите процеси да има положителна и минимална от всички възможни стойности. Следователно скоростта на изменение на ентропията на обкръжаващата среда да е минимална , т.е. системата да се стреми да работи в най-изгоден енергиен режим. При отклонение на системата от стационарно състояние в нея настъпват изменения в такава посока, че да я върнат в стационарното състояние.
Биологичните системи са отворени термодинамични системи, в които протичат неравновесни процеси. За да съществува една биологична система, тя трябва да бъде в стационарно състояние. Стационарното състояние в биологични системи се характеризира с постоянство на параметрите на системата във времето. Това в биологията се нарича хомеостаза. При това се съхраняват постоянни химичния състав на вътрешната среда, температурата, киселинността, осмотичното налягане и т.н. Но в организма могат да настъпят процеси, които нарушават стационарното състояние - повишаване на температурата при възпалителни процеси, повишаване концентрацията на кръвната захар при диабет и т.н. Ако тези изменения не превишават дадена граница, то стационарното състояние след определен период от време се възстановява. Следователно биологичните системи притежават свойството автостабилизация.
В процеса на растеж и стареене даден организъм може да има различни нива на стационарно състояние. Например с растежа се променя съдържанието на Са в костите, скоростта на метаболизма, големината на клетъчните потенциали и др.
9. Описание на процесите, протичащи в една отворена термодинамична система. Термодинамични сили и термодинамични потоци. Дисипативни структури.
9.1.Определяне на ентропията в отворена система. Термодинамични сили и термодинамични потоци. Феноменологични уравнения.
Как може да се изчисли изменението на ентропията в една отворена система? Необратимите процеси, увеличаващи ентропията, са химични реакции, топлообмен, дифузия, и т.н. За всяко от тези явления можем да въведем 2 вида величини - термодинамични сили и термодинамични потоци.
Термодинамичната сила X е градиент на съответното поле, което обуславя протичането на процеса. Термодинамичният поток J отразява скоростта на протичане на съответния процес. Например при дифузията термодинамичната сила е градиента на концентрацията 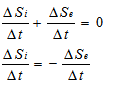 или градиента на плътността
или градиента на плътността 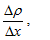 , а термодинамичния поток е масовия поток
, а термодинамичния поток е масовия поток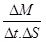 .
.
В сложни системи, каквито например са биологичните системи, много процеси са взаимносвързани. Например дифузията се определя не само от концентрационни градиенти, но и от температурни градиенти (термодифузия) и от електрични градиенти (електродифузия). Тогава дифузионният поток ще се определя от алгебричната сума от всички потоци
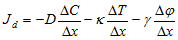
Общото изменението на ентропията можем да представим като сума от произведението на термодинамичните сили и термодинамичните потоци.
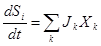
където Jk - скоростта на съответния процес, обусловена от съответната термодинамична сила Xk.
В случая на взаимодействие на различни процеси, Jk е сложна функция на термодинамичните сили. Всеки поток е свързан не само със своята сила, но и с всички действуващи в системата сили. Например градиента на концентрацията може да породи както дифузионен поток, така и поток от електрични заряди. При малки отклонения на системата от термодинамичното равновесие, възникващите потоци зависят линейно от термодинамичните сили и се описват от уравнения от вида:
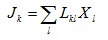
където Lkl са феноменологични коефициенти.
Тези уравнения се наричат феноменологични уравнения. При преките процеси феноменологичните коефициенти са пропорционални на коефициентите на топлопроводност, на дифузия и т.н. Установено е, че при състояния, близки до термодинамичното равновесие, Lkl = Llk .Това равенство се нарича съотношение на взаимност на Онзагер и означава, че всеки от потоците влияе на големината на другите взаимодействащи си потоци. Така можем да получим система от линейни уравнения. Ако имаме 3 взаимодействуващи си процеса, системата уравнения ще има вида:
J1 = L11X1 + L12X2 + L13X3
J2 = L21X1 + L22X2 + L23X3
J3 = L31X1 + L32X2 + L33X3
L12=L21
L13=L31
L23=L32
При решаване на тази система от уравнения можем да намерим термодинамичните сили и термодинамичните потоци и оттам приръста на ентропията.
Феноменологичните уравнения и съотношенията на Онзагер са валидни за системи, които се намират в състояние, близко до състоянието на равновесие. При процеси, които протичат далеч от равновесие тези уравнения и принципа на Пригожин не са в сила.
9.2. Дисипативни структури.
Живите системи се характеризират с висока степен на подреденост на структурните им елементи и на поведението им в пространството и времето.
В природата съществуват два типа подреденост - статична и динамична. Статична подреденост се наблюдава при кристалните твърди тела в резултат на понижение на температурата и фазов преход.
При отворени термодинамични системи може да се получи намаление на ентропията, т.е. по-високоорганизирано състояние, в резултат на обмяна на ентропия с околната среда и оттам формиране на нов тип динамични структури. Такива структури се наричат дисипативни структури. Най-общо под дисипативна структура се разбира пространствена, времева или пространствено-времева структура, която възниква в отворена термодинамична система в състояние, далече от равновесното състояние, когато параметрите на системата надхвърлят някаква критична стойност. Тогава се осъществява преход от рода на фазовите преходи и се получава динамично устойчиво състояние.
За възникване на дисипативни структури е необходимо да се изпълнят 4 условия:
- системата да е отворена
- динамичните уравнения, описващи поведението на системата да са нелинейни
- отклоненията на стойностите на параметрите от равновесните да превишават някаква критична стойност
- процесите в системата да стават кооперативно
Пример за такава структура са т.н. клетки на Бенар. Ако имаме тънък слой вискозна течност, поставен между две пластинки, който се подгрява от долната страна, то когато градиентът на температурата надвиши определена критична стойност, в течността се поражда конвекционни движения. Тези конвекционни движения образуват подредени кооперативни структури, изглеждащи като пчелна пита.
Ако се наблюдава горната повърхност, се наблюдава картина, подобна на пчелна пита (Фиг. 9.1).
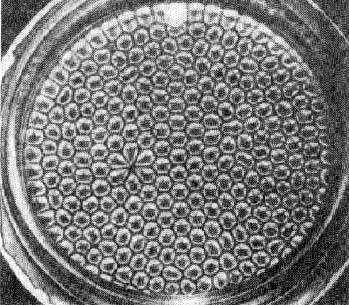
Фиг. 9.1.
В момента на образуване на клетките топлинният поток q рязко се повишава и си получава преход от типа на фазовите преходи.
Друг пример за дисипативна структура е реакцията на Белоусов-Жаботински. Това е циклична реакция, открита от съветския химик Белоусов през 50-години на миналия век. Белоусов изследвал окисляването на лимонената киселина от калиевия бромат. Реакцията протекла в кисела среда в присъствието на йони на церий Се3+ и Се4+, които играели двойна роля – катализатор и цветен индикатор. След приготвянето на хомогенен разтвор, течността в колбата започнала периодично да изменя цвета си от бледожълт в безцветен. Изучаването на тази реакция било продължено от Жаботински (1964), който доказал, че като катализатор вместо церий може да се използва манган и желязо, а вместо лимонена киселина – редица органични съединения, имащи метиленова група или образуващи я при окисляване – например малонова и бромалонова киселина (BМK). С тях реакцията изглежда много по-зрелищно. Тогава разтворът в колбата с часове точно като по часовник периодично изменя цвета си в целия видим диапазон от рубиненочервено до небесносиньо. Промяната на цвета е предизвикана от колебанията на концентрацията на Се4+. Освен това се получават пръстеновидни и спирални вълни (фиг. 9.2).

Фиг. 9.2.
Илюстрация може да се види и на:
http://www.youtube.com/watch?feature=player_embedded&v=IBa4kgXI4Cg
http://www.youtube.com/watch?feature=player_embedded&v=3JAqrRnKFHo
10. Ентропия и информация. Ценност и ефективност на информацията. Възникване и възприемане на информация.
10.1 Ентропия и информация
На всички нива на биологична организация се предава, възприема и преработва информация. Ако броят на микросъстоянията, които може да осъществи дадена система е W, а вероятността за всяко от тях е равна, т.е. p=1/W, то количеството информация I, съдържащо се в съобщението, че системата е заела едно от възможните състояние, ще бъде
I = log2p = - log2W
За единица количество информация се приема информацията, съдържаща се в достоверно съобщение, уточняващо едно от две възможни състояния (т.е. изходните възможни състояния са W=2). Единицата за информация се нарича бит.
I = log22 = 1 bit
Например информацията за това, кое от 64-те полета на шахматната дъска е заето, ще бъде
I = log264 = log226=6 bit
В общият случай, когато имаме N събития с различни вероятности p1, p2, …pN, количеството информация, съответствуваща на тази ситуация, е равно на
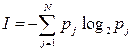
Тези формули са получени от Шенън за оценка на абсолютното количество информация при предаване на съобщение за събития, които могат да се осъществят с определена вероятност.
От съпоставянето на формулата за информация и формулата за ентропия се вижда, че количеството информация с точност до множител съответства на формулата за ентропия S = k.lnW
Следователно можем да получим връзка между ентропията и информацията
S (в ентропийни единици) = 2.3 10-24 I (bit)
1 bit = kln2=10-24 J/K
Това показва, че ентропията на системата и информацията на системата са взаимно свързани. Ентропията е мярка за безредието в системата и затова може да се разглежда като мярка за недостига на информация. Т.е. ентропията е това количество информация, което не достига за пълното описание на системата.
Връзката на информацията и термодинамичната ентропия показва, че получаването на информация е свързано с увеличаване на ентропията на околната среда. Всяко наблюдение, всяко получаване на информация, както и възникването на подредено състояние в даден обем е съпроводено с еквивалентно или по-голямо увеличаване на ентропията на околната среда.
10.2 Количество на биологичната информация
В тялото на човек се съдържат около 1013 клетки. Нека считаме, че всички те са уникални и не можем да ги местим без нарушение на структурата му. Следователно W=1013!
I = log2(1013!) = 1013log21013 = 4.1014bit
Изменението на ентропията при създаване на подреден организъм от система хаотично разположени 1013 клетки ще бъде
ΔS = 2,3.10-24.4.1014 = 10-9 ентропийни единици = 4.10-9J/K
Ако се отчете уникалното разположение на 20 вида аминокиселинни остатъци в белтъчните молекули (3.1025 остатъка в 7 килограма белтъчини), то общото количество информация, съответствуваща на това ще бъде I = 1.3 1026 bit, което е еквивалентно на ΔS = 300 ентропийни единици, приблизително 1200 J/K.
10.3 Ценност на информацията
Ценността на информацията е мярка за съдържателността на информацията, определяща степента на реализация на даден процес. Мярка за информационната ценност е величината
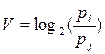
където pj и pi са вероятностите за осъществяване на определена цел преди и след получаване на информацията. Информационната ценност може да бъде положителна, нулева или отрицателна. Нулева информация има съобщения, които не се отнасят до конкретната цел, а отрицателна ценност има дезинформацията.
Информацията можем да разделим още на ценна и повторна (излишна) информация. Например кристалът като периодична система се характеризира с голяма повторяемост на информацията, докато при една сложна органична молекула имаме много по-голям обем на ценната (незаменима) информация. Затова може да се въведе и понятието ефективност на информацията
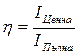
Биологичните системи се характеризират с по-голям обем на ценната информация в сравнение с неорганичните.
С понятието информационна ценност е свързано и понятието сложност. Сложността е системно свойство, отнася се до целия обект, до структурата и връзките в него. При биологичната еволюция сложността на обекта като цяло може да намалява за сметка на повишаване на информационната ценност на отделните му елементи. Понижаването на сложността чрез рационализиране на елементите на един механизъм е обща тенденция за всяко развитие - от научните теории, машиностроенето до биологията и социологията, и може да се разглежда като общ принцип за растяща ценност при еволюцията и самоорганизацията.
10.4 Възникване и възприемане на информацията
Биологичното развитие е свързано не само с увеличаване на ценната информация, съдържаща се в организма, но и с повишаване на способността му да прави подбор на ценната информация. Увеличаването на количеството информация може да става по два начина: отделяне на информацията от шумовия фон чрез съответните свойства на рецепторните системи да пропускат само “ценна” информация и да предотвратяват ненужни реакции на организма; и чрез създаване на нова информация при запомняне на случаен избор (например комбинация на нуклеотиди). Смята се, че създаването на осмислена подреденост чрез запомняне на случайна комбинация лежи в основата на биологичната подреденост, т.е. системите имат способност да създават нова информация, която пряко или косвено влияе на тяхното самовъзпроизвеждане.
Основно условие за възприемане на информацията е способността на рецепторните системи да преминават в едно от възможните устойчиви състояния вследствие на получената информация. Затова за възприемане, запомняне и съхранение на информацията е необходимо да се извърши определена работа, за да премине системата в едно от устойчивите си състояния, при което се изразходва енергия. В резултат на загубата на енергия се повишава ентропията на системата със стойност, превишаваща количеството на запомнената информация.