30. Електричен ток в електролити. Електролитна дисоциация. Електролиза. Електрод. Електроден процес. Електродни потенциали. Уравнение на Нернст за електродния потенциал.
30.1. Електричен ток.
Електричен ток се нарича всяко насочено движение на електрични заряди. В зависимост от вида на зарядите това могат да бъдат електрони или йони. В металните проводници движещите се заряди са електрони, в електролитите положителни и отрицателни йони, в полупроводниците електрони и дупки, а в газовете - положителни и отрицателни йони и електрони. За посока на тока условно се приема посоката на движение на положителните заряди.
За да протича електричен ток, трябва да са изпълнени две условия. Първо, трябва да има в съответната среда свободни заредени частици, и второ, наличие на електрично поле, чиято енергия се изразходва за преместване на електричните заряди.
За да се характеризира електричния ток, се въвеждат величините големина на тока I и плътност на тока j.
Големината на тока е скаларна величина, която се дефинира като отношение на заряда Δq, пренесен през дадена повърхност за единица време Δt.
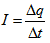
Единицата за големина на тока се нарича ампер, бележи се с А и е една от основните величини от системата SI. Един ампер е големината на такъв ток, при който през напречното сечение на проводника се пренася заряд 1 кулон за време 1 секунда.
Плътност на тока се нарича векторната величина 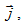 , която по посока съвпада с посоката на движение на положително заредените частици, и по големина е равна на отношението на големината на тока ΔI, преминаващ през елемент с площ ΔS, перпендикулярен на посоката на движение на заредените частици.
, която по посока съвпада с посоката на движение на положително заредените частици, и по големина е равна на отношението на големината на тока ΔI, преминаващ през елемент с площ ΔS, перпендикулярен на посоката на движение на заредените частици.
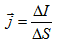
Плътността на тока се измерва в единици A/m2. Имайки предвид дефиницията за големина на тока, 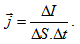 .
.
Електричен ток, който не променя големината и посоката си с течение на времето, се нарича постоянен. В противен случай е променлив. Постоянен ток възниква под действие на постоянно напрежение и може да съществува само в затворена верига.
30.2. Електричен ток в електролити.
Електролити са вещества, чиито разтвори във вода или полярни разтворители провеждат електричен ток. Електролити са киселини, основи, соли, стопилки на соли, които в твърдо състояние са йонни кристали.
При разтваряне на електролитите те взаимодействат с полярните молекули на разтворителя, в резултат на което силата на взаимодействието между йоните намалява толкова пъти, колкото е относителната диелектрична проницаемост на разтворителя. Например за водата тази стойност е εr=81, следователно електричната сила на взаимодействие ще намалее 81 пъти. Това води до разпадане на молекулите на електролита на положителни и отрицателни йони (Фиг. 30.1).
Този процес се нарича електролитна дисоциация. Винаги в разтвора ще протича и обратния процес на рекомбинация – при удар между два йона може да се получи неутрална молекула. Този процес се възпрепятства от образуването на хидратна (солватна) обвивка около йоните. След известен период от време се установява динамично равновесие между двата процеса.

Фиг. 30.1. Електролитна дисоциация на NaCl.
Степента на електролитна дисоциация се характеризира с величината коефициент на дисоциация, който се дефинира като отношение на броя на дисоциираните молекули n към общия брой на разтворените молекули n0 в единица обем 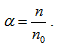 . Коефициентът на дисоциация зависи от природата на електролита и разтворителя, температурата, налягането, концентрацията на разтвореното вещество и др. За един и същ разтворител и електролит степента на дисоциация е по-голяма при слаби разтвори, и намалява с увеличаване на концентрацията на електролита. В зависимост от коефициента на дисоциация електролитите се делят условно на слаби и силни (α ≈ 1). Силни електролити са солите, киселини, основи и някои органични киселини и основи.
. Коефициентът на дисоциация зависи от природата на електролита и разтворителя, температурата, налягането, концентрацията на разтвореното вещество и др. За един и същ разтворител и електролит степента на дисоциация е по-голяма при слаби разтвори, и намалява с увеличаване на концентрацията на електролита. В зависимост от коефициента на дисоциация електролитите се делят условно на слаби и силни (α ≈ 1). Силни електролити са солите, киселини, основи и някои органични киселини и основи.
Във външно електрично поле йоните ще започнат да се движат насочено. Следователно проводимостта в електролитите е йонна проводимост. Скоростта на йоните зависи от температурата, природата на електролита и интензитета на електричното поле Е - 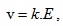 , където k е подвижността на йоните.
, където k е подвижността на йоните. 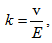 , т.е. подвижността се дефинира като скоростта на йоните в електрично поле с интензитет 1V/m.
, т.е. подвижността се дефинира като скоростта на йоните в електрично поле с интензитет 1V/m.
Тъй като при протичането на ток в електролити участват както положително заредени, така и отрицателно заредени йони, то големината на тока ще бъде 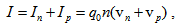 , където q0 е заряда на йоните, n е концентрацията на йоните, vn и vp са скоростите на отрицателните и положителните йони. При повишаване на температурата се повишава подвижността на йоните главно поради намаляване на вискозитета на разтвора на електролита и по-лесното движение на йоните и следователно се увеличава електропроводимостта на електролита.
, където q0 е заряда на йоните, n е концентрацията на йоните, vn и vp са скоростите на отрицателните и положителните йони. При повишаване на температурата се повишава подвижността на йоните главно поради намаляване на вискозитета на разтвора на електролита и по-лесното движение на йоните и следователно се увеличава електропроводимостта на електролита.
30.3. Електролиза.
Протичането на електричен ток през електролити е придружено с пренос на вещество и отделянето му върху електродите. Съвкупността от електрохимичните процеси, настъпващи върху електроди, потопени в електролит, при протичане на електричен ток, се нарича електролиза (Фиг.30.2).
Протичането на електричен ток през електролити е придружено от постепенно намаляване на концентрацията на йоните. Докато средната концентрация на йоните е постоянна, големината на тока I е пропорционална на приложеното напрежение U (I = G.U), или е в сила закона на Ом. Съпротивлението на електролита 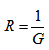 можем да изразим чрез специфичното електрично съпротивление ρ, което характеризира природата на електролита, и една нова величина, наречена електропроводен капацитет на електролизната клетка k – R = ρ.k. Електропроводният капацитет на електролизната клетка зависи от формата и размерите и, подобно на съпротивлението на метален проводник, което зависи от дължината и сечението му. Измерва се в m-1.
можем да изразим чрез специфичното електрично съпротивление ρ, което характеризира природата на електролита, и една нова величина, наречена електропроводен капацитет на електролизната клетка k – R = ρ.k. Електропроводният капацитет на електролизната клетка зависи от формата и размерите и, подобно на съпротивлението на метален проводник, което зависи от дължината и сечението му. Измерва се в m-1.
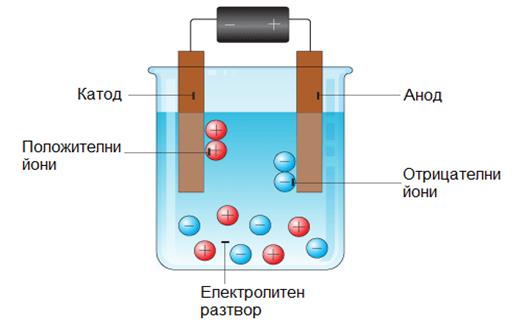
Фиг. 30.2. Схема на електролиза.
На електродите могат както да се отделят съставните части от разтвореното вещество, така и да протичат вторични химични реакции. При електролиза на един и същи електролит могат да се отделят върху електродите различни вещества или да протичат различни вторични реакции в зависимост от вида и полярността на електродите.
Нека в съд имаме разтвор на меден сулфат. В резултат на електролитната дисоциация в разтвора ще има медни и сулфатни йони.
CuSO4 ↔ Cu2+ + SO42–
В разтвора поставяме два електрода – въгленов и меден, като въгленовия свързваме с отрицателния, а медния с положителния полюс на източник на ток. При включване на източника между електродите се създава електрично поле и йоните от електролита започват да се движат насочено към съответния противоположно зареден електрод. Към катода се насочват положителните медни йони, там те присъединяват два електрона и се превръщат в медни атоми, които се отлагат върху електрода.
Cu2+ + 2e– = Cu
Към анода се насочват отрицателните сулфатни йони, там те отдават два електрона и встъпват в химична реакция с медния електрод, като се образува отново CuSO4.
SO42– +Cu = CuSO4 + 2e–
Поради това концентрацията на CuSO4 остава постоянна, а анодът постепенно изтънява. Така се получава чиста електролитна мед. По подобен начин се получава и чист алуминий.
Чрез електролиза се нанасят различни метални покрития. По този начин с помощта на електролиза се извършва посребряване, позлатяване, никелиране, хромиране
30.4. Електрод. Електроден процес.
В хетерогенна система на границата на две различни фази, които се намират в контакт, възниква тясна област със специфични свойства, наречен междуфазов или граничен слой. В този слой става преразпределение на електрични заряди.
Съществуват няколко механизма, по които може да стане преразпределение на електричните заряди:
- Пренос на заряди през граничната повърхност;
- Нееквивалентна адсорбция на положителни и отрицателни йони;
- Адсорбция на диполни молекули;
- Поляризация на атоми и молекули в нехомогенното електрично поле на граничния слой.
В резултат на тези процеси всяка от фазите придобива електричен заряд и на границата между фазите възниква двоен електричен слой.
Ако една от фазите е метал, а другата електролит, системата се нарича електрод или галваничен полуелемент. Процесите, които протичат между фазите на електрода, при което електричен заряд преминава от едната фаза в другата, се наричат електродни процеси. Преразпределението на електричните заряди в този случай става основно чрез пренос на заряди през граничната повърхност и нееквивалентна адсорбция на положителни и отрицателни йони.
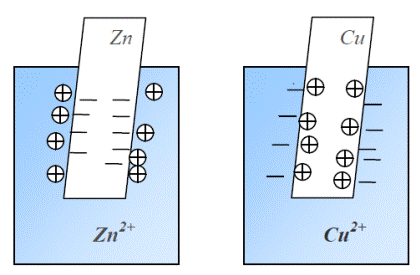
Фиг. 30.3. Схема на електродни процеси при различни метали.
Нека имаме метал, потопен в разтвор на техни соли. Възможни са следните случаи в зависимост от природата на метала (Фиг. 30.3):
- Активни метали, като Zn, Fe, Pb придобиват отрицателен заряд по отношение на разтвора. В този случай се наблюдава разтваряне на положителни йони от метала в електролита. В резултат на това метала се зарежда отрицателно, а електролита в близост до метала положително. На границата на метала и електролита се формира потенциална разлика, наречена потенциал на електрода. Полето на двойния електричен е в такава посока, че препятства по-нататъшното отделяне на йони от метала. Поради това се установява динамично електрохимично равновесие и постоянна стойност на потенциалната разлика между метала и електролита. Тази стойност зависи от температурата, налягането и концентрацията на разтвора.
- Други метали, като Cu, Ag, Hg адсорбират метални катиони от разтвора и придобиват положителен заряд по отношение на разтвора. При определена стойност на полето на образувания двоен електричен слой отлагането на йони спира и се установява динамично равновесие.
- Благородни метали, като Pt и Au, обикновено не обменят собствени йони с разтвора, т.е. не вземат участие в електродната реакция, а се използват само за трансфер на електрони. Такива електроди се наричат инертни. Широко разпространен инертен електрод е и графита.
30.5. Електроден потенциал.
Потенциалната разлика между метала и електролита не може да бъде измерена, защото като се присъедини измервателен уред, например волтметър, се създават още два гранични прехода и се измерва сумата от няколко потенциални разлики. По тази причина се въвежда условна скала на относителни величини, които могат да бъдат измерени. Тези величини се наричат електродни потенциали. Те се измерват спрямо определен стандартен електрод. Като стандартен електрод за сравнение се използва т.н. обратим водороден електрод. Това е газов електрод, при който се осъществява равновесна реакция Н2 ↔ 2Н++2е– върху платина, покрита с черна платина (т.н. черна платинирана платина), която има голяма повърхност. Пластинката от платинирана платина е потопена в нормален разтвор, съдържащ водородни йони (например разтвор на сярна киселина) и наситен с газообразен водород при определено налягане. Счита се, че потенциалът на водородния електрод може да се поддържа постоянен, ако активността на Н+ йони в разтвора и налягането на Н2 са постоянни. При активност на Н+ йоните равна на единица и налягане на Н2 равно на една атмосфера, електродът се нарича нормален водороден електрод и потенциалът му се приема условно за нула.
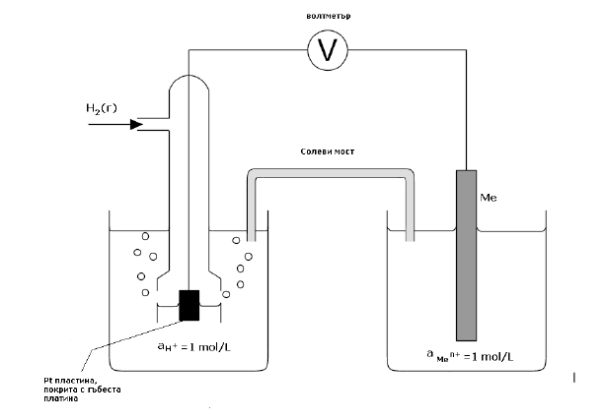
Фиг. 30.4. Електрохимична клетка за измерване на електродни потенциали.
Потенциалът на даден електрод относно нормалния водороден електрод се нарича електроден потенциал. Според дефиницията за електроден потенциал той се определя чрез електродвижещото напрежение на електрохимична клетка, в която левият електрод е нормален водороден електрод, а десният – изследвания електрод (Фиг. 30.4.). Означава се обикновено със символа Е0.
За полуелемент, когато върху електрода се отделят z валентни електрони, е валидна зависимостта 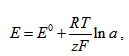 , където R е универсалната газова константа, T е абсолютната температура, F – Фарадеевото число и a – активността на йоните. Това уравнение се нарича уравнение на Нернст.
, където R е универсалната газова константа, T е абсолютната температура, F – Фарадеевото число и a – активността на йоните. Това уравнение се нарича уравнение на Нернст.
Ако поставим в контакт два електрода от различен тип, например от Cu и Zn, на двете граници метал-електролит възникват потенциални разлики, които се различават помежду си. Ако двата метала се съединят с проводник, през него ще протече електричен ток. Такава система се нарича галваничен елемент (Фиг. 30.5). В такава система електричните сили могат да извършват работа за сметка на вътрешната енергия при изменение на химичния състав или концентрацията на електролита. Разликата в потенциалите на двата електрода се нарича електродвижеща сила. Тя е равна на разликата в електродните потенциали между електродите.
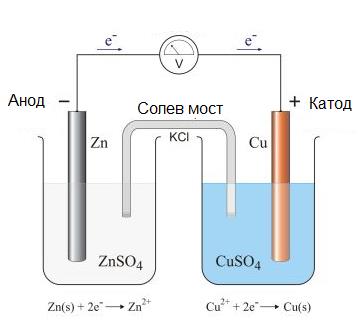
Фиг. 30.5. Схема на галваничен елемент.
При протичане на електричен ток през галваничен елемент често настъпват вторични реакции, при които отделените вещества взаимодействат с веществото на електродите или на разтвора. В резултат на това протичат процеси, които променят химичния състав или състоянието на повърхността на електродите, или предизвикват поява на градиенти на концентрацията в електролита. Това води до появата на допълнително електродвижещо напрежение с посока, противоположна на ЕДН на самия галваничен елемент. Подобни процеси настъпват и при електролиза, в резултат на което през електролита протича електричен ток в посока, противоположна на първоначалния ток при електролизата.
Тези явления се наричат електролитна поляризация. Измененията на електродите се нарича електродна поляризация, а възникващото електродвижещо напрежение – поляризационно ЕДН. Вследствие на поляризационните явления токът в една верига, съдържаща разтвор на електролит, а такива са всички биологични течности и тъкани, с течение на времето намалява, и то толкова по-бързо, колкото по-интензивно става поляризацията. В този случай законът на Ом ще има вида:
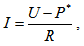 , където I е протичащия ток, U е приложеното напрежение, P* е поляризационното електродвижещо напрежение и R е съпротивлението.
, където I е протичащия ток, U е приложеното напрежение, P* е поляризационното електродвижещо напрежение и R е съпротивлението.




