51. Неполяризуеми електроди от първи и втори род. Йонноселективни електроди.Eнзимни електроди - биодатчици.
За да се избегне електролитната поляризация, се използват т.н. неполяризуеми електроди. При работа с такива електроди не настъпват вторични реакции и не се променя химичния състав на електродите.
Неполяризуемите електроди се разделят на видове в зависимост от материала, от който са направени и вида на химичното равенство, отразяващо електродната реакция.
51.1. Електроди от първи род.
Електродите от първи род се състоят от метал, потопен в разтвор на електролит, съдържащ едноименен с метала на електрода йон. Между метала и разтвора се създава потенциална разлика, която зависи от активността на съответния метален йон. Електродната реакция може да се представи така:
М+ + е → М
Към електродите от първи род се отнасят и т.н. окислително-редукционни електроди или редокс електроди. Състоят се от електрод от инертен материал (обикновено благороден метал - злато, платина), потопен в разтвор, който не съдържа негови йони, а реагира на окислително-редукционния процес в дадена редокс система. В резултат на склонността на окислената форма да приема електрони (да се възстановява), а възстановената форма да отдава на метала електрони (да се окислява), възниква разлика в потенциалите, определена от отношението на активностите на двете форми.
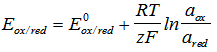
Водородният електрод е типичен редокс електрод. При него възстановената форма е газообразния водород, а окислената - йона на водорода.
2Н+ + 2е → Н2
51.2. Електроди от втори род.
Електродите от втори род се състоят от метален проводник, покрит с тънък слой от трудно разтворимо съединение на същия метал, и потопен в разтвор на електролит, който има общ анион с тази трудно разтворима сол. Потенциалната разлика между електрода и разтвора зависи от съответния анион в разтвора. Реакцията на полуклетката може да се изрази така:
Малко разтворима сол + е → метал + анион
Такива електроди са например сребърно-сребърнохлоридния електрод , каломеловия електрод и талиевоамалгамния-талиевохлориден електрод (таламид).
Сребърно-сребърнохлоридния електрод представлява сребърен тел, покрит със слой от сребърен хлорид и потопен в разтвор на калиев хлорид. Потенциалът му зависи от активността на хроридните йони в разтвора по уравнението:
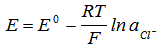
При постоянна концентрация на Cl- полуклетката с електрода маже да се използва за съставяне на електрохимическа клетка без пренос на заряд и за измерване на електродвижещата и сила заедно с определен индикаторен електрод. Полуклетката на сребърнохлоридния електрод за сравнение в система с пренос на заряд може да се запише така: Ag|AgCl||KCl(0.1-3M)||…
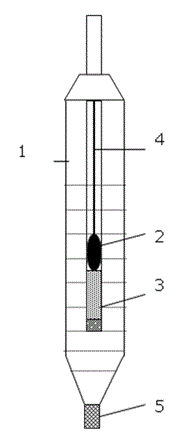
Фиг. 51.1. Схема на каломелов електрод.
В практиката широко използван като сравнителен електрод е каломеловият (меркулохлоридния). Той може да бъде представен схематично като (Pt)Hg|Hg2Cl2||KCl(3M)||…
Каломеловият електрод (Фиг. 51.1) се състои от стъклена тръбичка (1), в която има капчица живак (2) и паста каломел (3). В тръбичката има платинен тел (4), който в единия си край е потопен в капчицата живак. Тръбичката е потопена в разтвор на KCl. Връзката на електрода с изследвания разтвор става чрез йонен мост (5) от порьозен керамичен материал, азбест, графит и др. Отводът на електрода е към измерителния уред е меден проводник, запоен към платиновия тел. Разтворът на KCl трябва да бъде наситен.
Таламидният електрод е аналогичен по принцип на работа на сребърнохлоридния електрод с тази разлика, че нестабилният във водни разтвори метален Талий се използва под формата на амалгама. Схематично може да се запише като (Pt) (Hg, Tl)|TlCl||KCl(3M)||…
51.3. Електроди от трети род.
Представляват метален тел със слой от малкоразтворима сол на метала и втори слой от също така малкоразтворима сол на друг метал с аниона на първата. Необходимо условие е солта от първия слой да има по-малка разтворимост. Потенциалната разлика електрод/разтвор зависи от активността на втория катион в разтвора.
51.4. Мембранни и йонно-селективни електроди.
Мембранните електроди представляват метален проводник, отделен от разтвора на електролита с мембрана с особени свойства и свързан с прибор на измерване на ЕДН. В резултат на пренос през мембраната възниква потенциална разлика на граничната повърхност мембрана/разтвор, която се нарича мембранен потенциал.
Йоноселективните електроди са мембранни електроди, чийто потенциал зависи от активността на определен вид катиони или аниони в разтвора. Важно свойство на тези електроди е свойството им да реагират на активността на един вид йони в присъствие на йони от други видове, т.е. проявяват селективност и затова се наричат и йонноселективни.
За изработването на йонноселективни електроди се използват различни типове мембрани - монокристали, стъкло, пресувани утайки, твърди и течни йоннообменни материали и др.
51.4.1. Йонноселективни електроди с твърда мембрана
Най-често използваният йонноселективен електрод е т.н. стъклен електрод. Появата на електростатичен потенциал на границата между стъклено балонче и воден разтвор на киселини, обратим по отношение на водородните йони, е установен в началото на века. Най-съществената част от стъкления електрод балончето от стъкло със специален състав. То съдържа Na, Li и K оксиди. Стъклото с наименование Корнинг 015 се използва за промишлено производство на стъклени електроди и се състои от 72 тегловни % SiO2, 6% - CaO 22% Na2O. Дебелината на стените на балончето зависи от електричното съпротивление на стъклото и може да варира от 54 до 130 µm. Балончето е запоено към тръбичка от Тюрингско стъкло, което има отнасяне на изолатор. В тръбичката се монтира електрод за сравнение, потопен във вътрешен разтвор.
Стъклените електроди се различават по формата и размерите на стъклената мембрана. Тя може да бъде сферична, конусообразна, плоска и др. Произвеждат се и микроелектроди.
Новият стъклен електрод се оставя да престои известно време потопен в дестилирана вода или разреден разтвор на киселина, според съответната инструкция на производителя. При това водните молекули проникват в повърхностния слой на стъклото и предизвикват набъбването му. Количеството на абсорбираната от единица повърхност вода зависи от вида на стъклото и в зависимост от това дебелината на хидратирания слой може да бъде от 0.5 до 10μm. В хидратираният слой подвижността на катионите е около 1000 пъти по-голяма в сравнение с тази в компактното стъкло. При потапяне на подготвения електрод в съответния разтвор повърхността му губи или приема водородни йони в зависимостта от активността им в разтвора, при което възниква потенциална разлика между вътрешната и външната повърхност на стъкленото балонче.
Съществуват различни видове стъклени електроди, които се различават по формата на балончето (сферична, конусообразна), големината и размерите, вида на вътрешния сравнителен електрод (Фиг. 51.3).
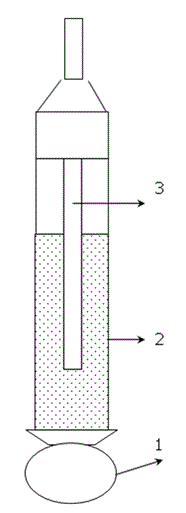
Фиг. 51.2. Схема на стъклен електрод. (1 - балонче от стъкло със специален състав; 2 -тръбичка от Тюрингско стъкло, което има отнасяне на изолатор; 3 - електрод за сравнение, потопен във вътрешен разтвор.)
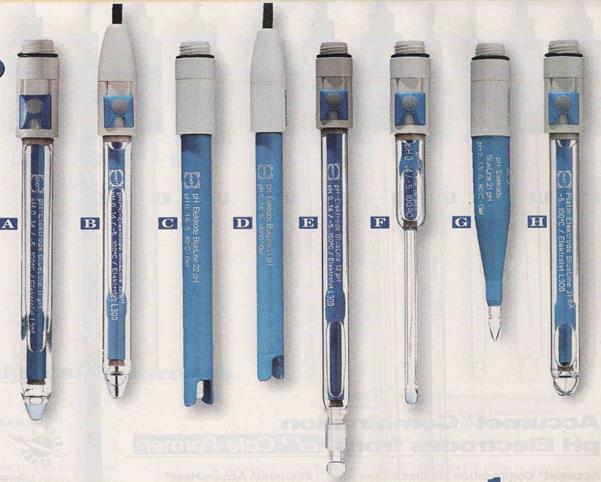
Фигура 51.3. Различни видове стъклени електроди.
Други йонноселективни електроди с твърда мембрана са селективни за флуоридни, хлоридни, бромидни, йодидни, сулфидни, сребърни, медни и др. йони.
51.4.2. Йонноселективни електроди с течна мембрана.
По принцип течната мембрана представлява разтвор на подходящ йоннообменител (катионит или анионит) в органичен разтворител или разтвор на неутрален хелат, който не се разтваря в разтвора с пробата. Органичната фаза е отделена от водната с неутрален материал. На границата мембрана/разтвор се осъществява бърз обмен между свободните йони в течната фаза и йони, свързани с органични функционални групи в мембранната фаза. Тези електроди могат да бъдат следните видове:
- йонноселективни електроди на базата на течни катионити. Съществуват селективни електроди за Ca2+, Zn2+, Cu2+, Pb2+
- йонноселективни електроди на базата на течни анионити. Съществуват селективни електроди за
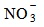 (нитрати),
(нитрати), 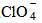 (перхлорни йони),
(перхлорни йони), 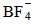 (тетрафлуорборатни йони),
(тетрафлуорборатни йони), 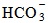 (карбонатни йони) и др.
(карбонатни йони) и др. - Йонноселективни електроди на базата на неутрални носители - селективни за
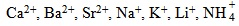
Тези електроди намират широко приложение при анализ на селскостопански продукти, продукти на хранително-вкусовата промишленост, в клиничните лаборатории. Например селективни за Ca2+ електроди се използват за определяне на Ca в бира, мляко, фуражи, почви, води, вина и др. Йонноселективни електроди се използват за определяне на нитрати в растителни проби, детски храни, вода; за определяне на калий в урина; за определяне твърдостта на водата и др.
51.4.3. Газочувствителни мембранни електроди.
Състоят се обикновено от стъклен рН електрод, който регистрира изменението на рН в разтвора причинено от действието на съответния газ. Най-широко се използват газови електроди, селективни към амоняк, СО2, азотни окиси и SO2.
51.5. Ензимни електроди - биодатчици.
Могат да се разглеждат като комбинация от определен тип електрохимичен електрод и тънък слой от ензим, който служи за измерване на концентрацията на даден субстрат.
По принцип всички биодатчици имат няколко основни елемента:
- потенциометричен сензор - обикновено различни йонноселективни електроди
- слой от имобилизиран ензим
- диализна или газопроницаема мембрана
- поддържащ елемент
Например ензимен електрод, реагиращ селективно на количеството на урея в разтвор се състои от амонячен електрод, на който се нанася полиакрилатен гел, съдържащ уреаза. Уреята от изследвания разтвор прониква в гела и се разлага под действието на уреазата
CO(NH2)2 + H2O = CO2 + 2 NH3
Амониевият йон се регистрира от йонноселективния електрод.
52. Потенциометрия. Потенциометрично определяне на рН.
52.1. Потенциометрия.
Потенциометрията е метод, чрез който се измерват различни физикохимични величини и се провежда количествен анализ чрез измерване на електродвижещото напрежение на галваничен елемент (измервателна клетка). Измервателната клетка се състои от индикаторен (измерителен) и сравнителен електрод. Като индикаторен се използва стъклен или друг йонноселективен електрод, в зависимост от определяния параметър. Като сравнителен се използва най-често каломелов, сребърно/сребърнохлориден или таламиден електрод. Потенциометрично могат да бъдат измервани коефициенти на активност, рН, количеството на различни йони, константи на дисоциация и др.
52.2. Потенциометрично определяне на рН
Потенциометричното измерване на рН най-често се извършва в измервателна клетка, състояща се от стъклен електрод като индикаторен и каломелов (или друг неполяризуем електрод) за сравнителен електрод.
Стъклен електрод||разтвор с Н3О+||солев мост||каломелов електрод
Каломеловият електрод контактува с разтвора чрез полупропусклива диафрагма, където възниква потенциал на течната връзка. Възникващото ЕДН между двата електрода зависи от концентрацията на водородните йони.
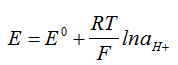
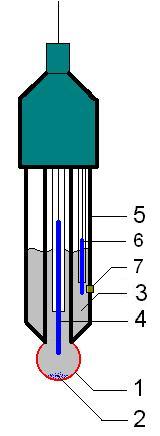
В съвременните пехаметри обикновено се използват комбинирани електроди, при които в едно тяло се намира както стъкления, така и сравнителния електрод. Схема на комбиниран електрод е представен на фиг. 52.1.
 |
|
Фиг. 52.1. Схема на комбиниран електрод
Измервателният уред, чрез който се измерва ЕДН между двата електрода или частите на комбинирания електрод, се нарича рН-метър. По същество той представлява един много чувствителен миливолтметър с голямо вътрешно съпротивление. Тъй като възникващото ЕДН между двата електрода зависи от концентрацията на водородните йони, то от там може да се направи и скала директно в единици рН, и всеки рН-метър има две скали – едната в рН и второто в mV. Константата Ео се намира чрез калибриране на уреда по един или два буферни разтвори с известно рН.
Всеки пехаметър може да се използва и като йон-метър, ако стъкленият електрод се замени с друг йонноселективен електрод. Измервайки потенциалната разлика между йонноселективния и сравнителния електрод по скалата за mV за разтвори на съответния йон с известна концентрация, може да се калибрира уреда и след това да се използва за измервания на концентрацията му в неизвестни разтвори.




