53. Електрични явления на границата между твърдо тяло и електролит. Електрокинетичен потенциал. Електрокинетични явления. Видове. Приложение на електрофорезата в биомедицинските изследвания.
53.1. Електрични явления на границата между твърдо тяло и течност.
В хетерогенна система (система, изградена от две или повече фази) при определени условия на границата на различните фази възниква двоен електричен слой. Това може да стане в резултат на 2 процеса. Единият процес е дисоциация на йоногенни групи, когато дисперсните частици съдържат такива. Възникването на повърхностен електричен заряд по този механизъм може да се осъществи при белтъчни молекули. В зависимост от рН на средата йоногенните групи се дисоциират по различен начин. В кисели разтвори белтъците играят роля на катион, а в основни – на анион. Йоните, които остават фиксирани на повърхността се наричат потенциалообразуващи. Свободните йони, отделени при дисоциацията, преминават в дисперсната среда. Те се наричат противойони. По този начин на повърхността на дисперсната частица се формира двоен електричен слой.
Другият процес е адсорбцията на йони от дисперсната среда върху повърхността на дисперсната фаза. Например върху всяка твърда повърхност, която се намира в електролитен разтвор, се адсорбират йони от разтвора. При биологични системи адсорбция на йони може да се извършва върху повърхността на полизахариди, липиди, холестерин, белтъци и др. Тя е свързана с наличието на полярни недисоцииращи се групи като хидроксилни, карбонилни, пептидни и др. Могат да се адсорбират както катиони, така и аниони. Йоните, които се адсорбират на повърхността на дисперсните частици са потенциалообразуващите и те определят заряда на частиците.
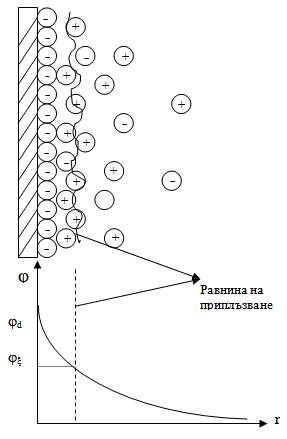 |
Структурата на двойния електричен слой не зависи от механизма на образуването му. Едната част е плътно свързана с дисперсната частица и включва потенциалообразуващите йони и малка част от противойоните (Фиг. 53.1). Тези йони се придвижват заедно с частиците от дисперсната фаза. Този слой се нарича адсорбционен. Останалата част от противойоните остава в дисперсната среда и образува дифузионния слой. В зависимост от условията дебелината на този слой е от няколко нанометра до няколко микрометра. Дефинира се с разтоянието от твърдия слой до мястото, където потенциала намалява е-пъти. Разпределението на йоните се определя от два фактора – електростатичните сили на взаимодействие и хаотичното топлинно движение. В равновесие плътността на йоните намалява с увеличаване на разтоянието от повърхността. |
Фиг. 53.1.
Потенциалната разлика между дисперсната фаза и дисперсната среда се нарича пълен (електрохимичен) потенциал. Той зависи главно от активността на потенциало-образуващите йони. При относително движение на фазите на хетерогенна система адсорбционната част остава свързана с твърдата фаза. Приплъзването между фазите става в дифузионната част. Потенциалният пад в дифузионната част на двойния електричен слой се нарича електрокинетичен или дзета (ξ) потенциал.
53.2. Електрокинетични явления.
Електрокинетичните явления обхващат движението на фазите на хетерогенна система под действието на електрично поле, както и възникване на потенциални разлики в системата при механично движение на фазите под действие на сили с не-електричен произход. Основните видове електрокинетични явления са електрофореза, електроосмоза, седиментационен потенциал и потенциал на течение.
53.2.1. Електрофореза и електроосмоза.
Частиците на дисперсната фаза, обкръжени от двойния електричен слой, при липса на външно електрично поле са електронеутрални. Ако в хетерогенна система се създаде постоянно електрично поле, двойният електричен слой се разкъсва. Електрична сила, която действа на частиците от дисперсната фаза ще се стреми да ги придвижи към противоположно заредения електрод. Аналогично на противойоните от дифузионния слой също ще действа електрична сила, но насочена към другия противоположно зареден електрод. Движението на частиците на дисперсната фаза в електрично поле се нарича електрофореза, а движението на дисперсната среда – електроосмоза (Фиг. 53.2). Тези явления са били наблюдавани за пръв път от руския учен Ф. Рейс през 1807 г.
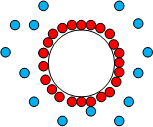
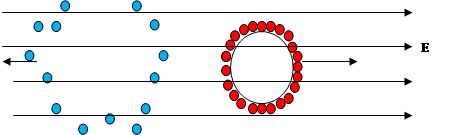
Фиг. 53.2.
Посоката на движение на частиците от дисперсната фаза дава информация за знака на заряда на повърхността и, а скоростта на движение – за стойността на потенциала, тъй като тя зависи от него. Според уравнението на Смолуховски 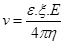 , където ε е диелектричната проницаемост на средата, ξ - ξ потенциала, Е – интензитета на електричното поле, η – вискозитета на дисперсната среда. Това уравнение е приложимо в случаите, когато размера на частиците значително превишава дебелината на двойния електричен слой. Може да се прилага и за еритроцити, левкоцити, микроорганизми и други клетки. За белтъчни молекули и колоидни частици, чийто размери са сравними с размера на двойния им електричен слой, електрофоретичната подвижност зависи и от формата и размерите им.
, където ε е диелектричната проницаемост на средата, ξ - ξ потенциала, Е – интензитета на електричното поле, η – вискозитета на дисперсната среда. Това уравнение е приложимо в случаите, когато размера на частиците значително превишава дебелината на двойния електричен слой. Може да се прилага и за еритроцити, левкоцити, микроорганизми и други клетки. За белтъчни молекули и колоидни частици, чийто размери са сравними с размера на двойния им електричен слой, електрофоретичната подвижност зависи и от формата и размерите им.
Електрофорезата се използва широко в биологичните изследвания. Електрофореза на йони и полийони се нарича електрофореза с движеща се граница. Тя се използва за разделяне на макромолекули по размери, форма и повърхностен заряд. Например по този начин могат да се разделят белтъци, нуклеинови киселини и др. биологични макромолекули. При даден интензитет на електричното поле, молекулите с различен заряд, форма или маса ще имат различна електрофоретична подвижност. Практически този вид електрофореза се извършва като в единия край на покрито със специален желатинов или друг гел предметно стъкло или електрофоретична вана се капва от разтвор, съдържащ фракции на веществата, които искаме да разделим, например кръвна плазма. Чрез електроди на двата края на предметното стъкло се създава постоянна потенциална разлика. Под действие на електричното поле белтъчните молекули се преместват към съответния полюс с различна скорост. След известно време те се разделят на ивици, всяка една от които съдържа макромолекули с еднаква електрофоретична подвижност. Ивиците се оцветяват и колориметрично се определя интензивността на оцветяването, което е пропорционално на концентрацията на съответната фракция.
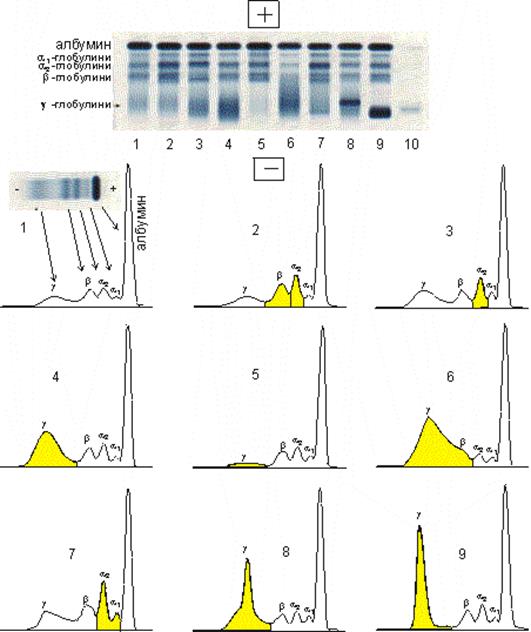
Фиг. 53.3. Електрофоретични профили на серумни белтъци.
На фиг.53.3 са представени електрофоретични профили на серумни белтъци. Профил 1 се получава при здрав човек. При профил 2 са увеличени α2 и β-глобулините, а при профил 3 са увеличени α1-глобулините, което е характерно за остро протичащи възпаления. При профил 4 са силно увеличени γ-глобулините (поликлонална гамапатия). Тези имуноглобулини се увеличават неспецифично при голям брой различни инфекции и автоимунни болести. Увеличението се дължи на увеличена синтеза в различни клетъчни линии, затова имунният отговор се нарича поликлонален.
При профил 5 обратно, те са силно понижени (хипогамаглобулинемия), характерно за имунодефицитни състояния (намален хуморален имунитет), вкл. и СПИН. При профил 6 се наблюдава β - γ -сливане, характерно за чернодробна цироза. При профил 7 се наблюдава повишение на α1- и α2-глобулините, характерно за възпалителни процеси и злокачествени остро протичащи болести. При профили 8 и 9, обратно на профил 4, се вижда моноклонална гамапатия (парапротеин). Парапротеини се откриват при миелома с характерни костни метастази.
Електрофорезата на клетки се нарича още клетъчна електрофореза или микроелектрофореза. Известно е, че всички клетки имат повърхностен електричен заряд, като големината на заряда зависи от типа на клетката и нейното физиологично състояние. Затова по електрофоретичната подвижност може да се съди за състоянието на клетката и влиянието на различни външни фактори като лекарствени вещества, йонизираща радиация и др. върху тях. Чрез клетъчна електрофореза могат да се изучават кръвни клетки, ракови клетки, спори, сперматозоиди, микроорганизми и др.
Йоногенни групи от даден вид, намиращи се на повърхността на клетъчните мембрани, могат да се неутрализират чрез специфични за всеки вид химични реагенти. Това ще предизвика съответна промяна в повърхностния заряд, която може да се определи като се измери ξ потенциала. Така може да се установи състава на йоногенните групи по клетъчната повърхност – т.е. да се направи химична топология на клетъчната повърхност. При клетки от един вид, промяна на повърхностния електричен заряд говори за патологични състояния или ракова трансформация.
53.2.2. Потенциал на течение.
Потенциал на течение възниква когато течност, съдържаща разтвор на електролит, се движи през капиляри или пори. Стените им играят роля на твърда фаза и на тази повърхност се натрупват потенциалнообразуващите йони, а част от противойоните се увличат от течението. Така единият край на тръбичката се обогатява с потенциалообразуващите йони, а другия с противойоните и по дължината на тръбичката се формира потенциална разлика, която е пропорционална на скоростта на течение. На този принцип са построени разходомери, чрез които се определя скоростта на движение и потока на флуид
Подобен потенциал се формира и при преминаване на разтвор на електролит през капиляри или пори, които са електрически заредени. През тях преминават частиците, имащи заряд, противоположен на заряда на порите, а едноименно заредените частици остават в разтвора. В резултат на това възниква потенциална разлика в течността от двете страни на пората, която затруднява по-нататъшното движение на частиците. Това явление е обратно на електроосмозата, т.е. движението на дисперсната среда води до поява на потенциална разлика.
53.2.3. Седиментационен потенциал.
Седиментационен потенциал възниква между горните и долните слоеве на хетерогенна система при утаяване на частиците на дисперсната фаза под действие на силата на тежестта. При механичното движение се разкъсва двойния електричен слой около частиците. Вследствие на утаяване на частиците в слоевете, близо до дъното се натрупват заряди от единия знак (на потенциалообразуващите йони), а в дисперсната среда остават противойоните от дифузионната част (Фиг. 53.4). Възникналото електрично поле се нарича седиментационен потенциал и е с такава посока, че да затруднява утаяването на частиците. Явлението е обратно на електрофорезата – движението на частиците води до възникване на електричен потенциал. На този принцип са построени уреди за бързо определяне на скоростта на утаяване на еритроцитите.
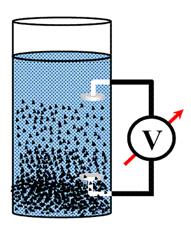
Фиг. 53.4.




