54. Приложения на спектралния анализ в биологията.
Спектрален анализ е разделът от физиката, в който се изследват спектрите на излъченото или погълнатото от веществото лъчение, като се измерва положението, интензивността и ширината на спектралните линии.
Причина за възникване на излъчване от веществото или за поглъщане на лъчение са преходи между енергетичните нива в атомите и молекулите. Преходи между нивата Е1 и Е2 могат да станат само когато системата поглъща или излъчва фотон с енергия, точно равна на разликата между енергетичните нива ΔE = Е2 - Е1.
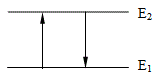 |
Погълнатата или излъчената енергия може да бъде енергия на електромагнитно лъчение и честотата на това лъчение ν се определя от съотношението ΔE = hν, където h е константа на Планк. |
За всеки химичен елемент разпределението на енергетичните нива на атомите е индивидуално и не се дублира с тази на друг химичен елемент. Това се отнася и за молекулите. Следователно спектрите носят информация за веществото, от което са излъчени или погълнати, или спектрите можем да наречем дактилоскопски отпечатъци на природата.
54.1. Класификация на спектралните методи
Различните спектрални методи може да се класифицират по различни начини - в зависимост от диапазона от спектъра на електромагнитните вълни, в които се проявяват спектралните линии, в зависимост от типа на спектралните линии и др.
В зависимост от това, дали се получават спектри на излъчване или спектри на поглъщане, говорим за емисионен и абсорбционен спектрален анализ.
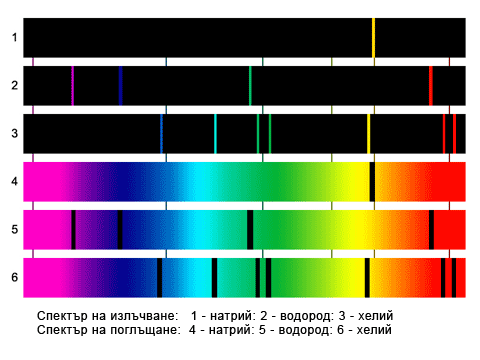
Фиг. 54.1. Атомни спектри на излъчване и поглъщане.
Според източника на спектрите говорим за атомни и молекулни спектри.
В зависимост от енергията (честотата) на фотона, излъчван или поглъщан от атомите или молекулите, говорим за следните видове спектрален анализ - радиоспектроскопия, инфрачервена спектроскопия, спектроскопия във видимия диапазон, ултравиолетова спектроскопия, ренггенова спектроскопия и γ - спектроскопия.
54.2. Задачи на спектралния анализ
Каква информация може да се получи от различните видове спектри?
Може да се определи вида на атомите и молекулите, които са обусловили даден спектър - т.е. да се направи качествен анализ.
По интензивността на спектралните линии може да се определи количеството на излъчващото или поглъщащо вещество - т.е. да се направи количествен анализ.
По спектрите може да се да се прави структурен анализ – т.е. да се определи наличието в една молекула на дадени атомни групи или химични връзки, тяхното пространствено разположение в молекулата, характера на химините връзки и др.
Ако изследваме зависимостта на спектрите от външни електрични или магнитни полета, може да се получи информация за взаимното разположение на частиците или за взаимодействието на съседни атоми или молекули.
Чрез спектрите е възможно да се направят изводи също така за температурата на телата, налягането, относителната скорост на движещи се тела и други параметри.
Качественият анализ се основава на голямата характерност на атомните и молекулните спектри. Използва се за анализ както на чисти вещества, така и на компоненти в смеси от вещества. Провежда се чрез сравняване на спектъра на лъчението на неизвестното вещество с тези на еталонни, чисти вещества, при прилагане на принципа на последователното появяване на спектралните линии или ивици. С увеличаване на концентрацията на дадено вещество в даден обем линиите или ивиците в спектъра се появяват по реда на интензивностите им - първо най-интензивната, след това следващата и т.н. Идентификацията на индивидуалните вещества в една проба се смята за завършена тогава, когато е получено еднозначно съответствие между честотите и интензивностите на линиите или ивиците в спектъра на изследваната проба и тези от еталонните спектри. Качественият анализ може да бъде пълен или частичен. Пълен е когато се определят всички вещества, намиращи се в пробата, а частичен когато се търсят само някои вещества, например наличието на тежки метали в почви и т.н.
В основата на количествения анализ стои пропорционалността между интензитета на спектралните линии или ивици и броя на атомите и молекулите, които ги обуславят.
При емисионните спектри тази зависимост има следния вид: I = a.C,
където I - интензитета на линията, С - концентрацията (броя) на излъчващите атоми или молекули, а - константа, характерна за дадена линия и зависеща от условията, при които е получена.
При абсорбционния спектрален анализ се използва закона за поглъщане на лъчението във веществото - закона на Буге-Ламберт. При перпендикулярно преминаване на успореден сноп лъчение с честота ν и интензивност I0 през слой вещество с дебелина d, ако веществото поглъща това лъчение, то интензивността на преминалото през този слой лъчение ще бъде 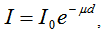 , където µ - специфичен коефициент на поглъщане на веществото.
, където µ - специфичен коефициент на поглъщане на веществото.
При достатъчно малък брой на атомите или молекулите в единица обем те поглъщат независимо. Тогава μ= ϰ.n, където ϰ - специфичен коефициент на поглъщане, наречен абсорбируемост. При поглъщане на лъчение с честота ν от вещество, разтворено в разтворител, който не поглъща на тази честота, то μ= ϰ.С, където С е концентрацията на разтвореното вещество. Тогава 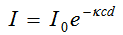
Тази формула е известна като закон на Буге-Ламберт-Беер. Можем да преработим този закон, като логаритмуваме 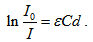 .
.
Вместо натурален, можем да преминем към десетичен логаритъм и тогава формулата добива вида 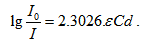 .
.
В тази формула 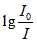 се нарича абсорбция А (Absorbance) (по-старо наименование оптична плътност D или екстинция Е).
се нарича абсорбция А (Absorbance) (по-старо наименование оптична плътност D или екстинция Е).
Следователно A=ε.C.d, т.е. абсорбцията зависи линейно от концентрацията. Този закон е валиден само при ниски концентрации, характерни за всяко едно вещество. При по-високи концентрации се наблюдава отклонение от него, като причина за това е самопоглъщането на лъчението от изследваните атоми или молекули. Обикновено количествен анализ се провежда в областта на спазване на тази зависимост.
При количествен анализ в спектъра на излъченото или погълнатото лъчение се избират една или няколко спектрални линии, по които се провежда анализа. Тези линии се наричат аналитични линии.
Структурният анализ се базира на опитно и теоретично получени спектри на вещества, чието интерпретиране е дало възможност произходът на отделните линии да бъде свързан с наличието на дадени атомни групи или химични връзки в молекулите. Когато тези връзки или групи влизат в състава на различни молекули, честотите на съответните им ивици имат близки стойности и интензитети.
54.3. Оптична спектроскопия
Оптична спектроскопия е спектроскопията в ултравиолетовия, видимия и инфрачервения диапазон от електромагнитния спектър. В зависимост от източника на спектрите различаваме атомни и молекулни спектри.
54.3.1. Оптични атомни спектри
- спектрите на излъчване или поглъщане, които възникват при квантови преходи между електронните нива на свободни или слабовзаимодействуващи си атоми. Възможните преходи се определят от подборни правила, които определят кои преходи са разрешени и кои не. Те са свързани със симетрията на квантовите системи и със законите за запазване. Оптичните атомни спектри са линейни спектри, в които можем да отделим групи линии, наричани спектрални серии. На преходи между електронни нива съответствува лъчение главно във видимата и ултравиолетовата област от спектъра на електромагнитните вълни.
Чрез атомните абсорбционни или емисионни спектри може да се прави количествен и качествен анализ. Качественият анализ се основава на индивидуалността и типичността на спектрите на химичните елементи. Тази индивидуалност се изразява както в различния брой линии, така и в местата на тези линии в спектъра. По принцип всяка спектрална линия на даден елемент, присъстваща в спектъра на пробата, може да послужи като доказателство за присъствието на този елемент в анализирания образец. На практика обаче присъствието на елемента се доказва по неговите най-интензивни линии. При понижаване на концентрацията на изследвания елемент тези линии изчезват последни от спектъра на пробата.
54.3.2. Оптични молекулни абсорбционни спектри
Молекулата представлява система от атоми, свързани помежду си чрез валентните си електрони в устойчиви структури. В молекулата могат да се извършват 3 вида вътрешни движения - електронно, вибрационно (колебателно) и ротационно. Електронното се определя главно от онези електрони, които осъществяват химичните връзки между съставящите молекулата атоми.
Вибрационно движение се определя от периодично изменение на взаимното разположение на атомните ядра при тяхното трептене около равновесното им положение. Трептения, при които се променя дължината на връзката се наричат валентни. Те могат да бъдат симетрични и асиметрични. Трептения, при които се променя ъгълът между отделните атоми се наричат деформационни (Фиг. 54.2).
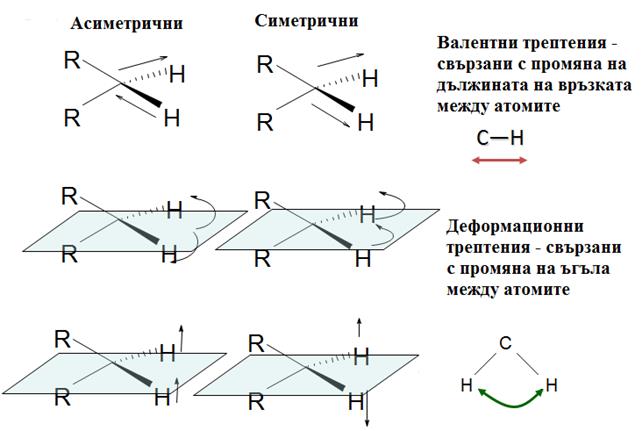
Фиг. 54.2.
 Ротационното движение е свързано с въртене на молекулата като цяло около ос, която преминава през центъра на тежестта и.
Ротационното движение е свързано с въртене на молекулата като цяло около ос, която преминава през центъра на тежестта и.
На всяко от тези 3 вида вътрешно движение на молекулата отговарят 3 вида вътрешна енергия - електронна Ee, вибрационна Ev и ротационна Er. Вибрационната енергия е:
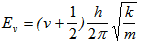
където v - вибрационно квантово число, k - ефективна еластична константа на връзката; а m - ефективната маса на молекулата. За двуатомна молекула с маса на отделните атоми М1 и М2 тя ще бъде 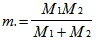
Ротационната енергия е:
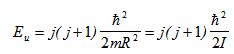
където j - ротационно квантово число, j=0,1,2, …; R - разстоянието между атомите, mR2=I - инерчния момент на молекулата
Енергията, съответствуваща на електронните, вибрационните или ротационните преходи има съществено различен порядък, като Ee >> Ev >> Er, а съотношението между тях е от порядъка Ee : Ev : Er = 1000 : 10 : 1.
Може да се приеме като приближение, че трита вида вътрешни движения са независими едни от други и че тези енергии се квантуват независимо една от друга.
Е = Ee + Ev + Er
Следователно на всяко едно електронно ниво отговаря набор от дискретни вибрационни (колебателни ) нива, а на свой ред на всяко вибрационно ниво отговаря набор от ротационни нива. В даден момент молекулата се намира в някое сложно електронно - вибрационно - ротационно движение (Фиг. 54.3).
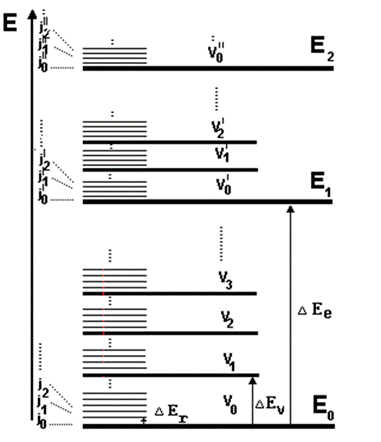
Фиг. 54.3. Схема на енергийните нива за двуатомна молекула. Е0 – основно електронно ниво, Е1, Е2 – възбудени електронни нива; v0, v1, v2 …- вибрационни нива; j0, j1, j2 …. – ротационни нива. ΔEr – чисто ротационен преход; ΔEv – чисто вибрационен преход; ΔEe – електронно-вибрационно-ротационен преход.
Честотите на спектралните линии могат да съответствуват на преходи межди електронни нива, които определят електронния спектър, на преходи между колебателни нива, които определят вибрационния спектър и на преходи между ротационни нива, които определят съответния ротационен спектър. Възможни са и електронно - колебателни и колебателно - ротационни спектри. На практика не е възможно да се осъществяват преходи между всички възможни нива. Комбинирането на нивата при преход се подчинява на съответните подборни правила.
Съвкупността от спектралните линии, които се наблюдават при дадени условия, образуват оптичния спектър на съответната молекула. Типичните молекулни спектри представляват съвкупност от по-тесни е по-широки ивици в ултравиолетовата, видимата и инфрачервената област от спектъра, като електронни спектри се наблюдават в ултравиолетовия и видимия диапазон, вибрационни - в инфрачервената област, а ротационни - в далечната инфрачервена и микровълновата област.
Електронните молекулни спектри се използват широко за количествено определяне както на неорганични, така и на органични вещества. Количественният анализ се основава на закона на Беер. Структурният анализ по електронните абсорбционни спектри се провежда като се използват абсорбционните ивици на хромофорните групи в молекулите. Така например метанът СН4 поглъща на 125 nm, етанът С2Н6 на 135 nm, етиленът С2Н4 на 180 nm, а ацетиленът С2Н2 на 240 nm. Бензолът има 3 абсорбционни ивици при 260, 200 и 180 nm. Важни хромофори са например нитрогрупата NO2 с абсорбция на 220nm и азогрупата -N=N- в интервала 340-380 nm.
Количественият анализ по инфрачервените спектри се базира на закона за поглъщане на лъчението във веществото – закон на Буге-Ламберт. От съществена значение при този метод е да се познава точно стойността на дебелината на поглъщащия слой на кюветата, с която се извършват спектралните ивмервания.
Трептенията на една сложна органична молекула можем да разделим на две групи - скелетни, които обхващат всички атоми в еднаква степен, и трептения на характеристичните групи, при които силни трептения се наблюдават само при част от молекулата. Скелетните трептения са уникални за молекулата като цяло, а честотата на трептения на характеристичните групи почти не зависят от строежа на цялата молекула. Следователно спектрите на характеристичните трептения са много характерни и могат да бъдат ползвани за качествен и структурен анализ както на чисти вещества, така и на вещества, влизащи в състава на смеси. Например за –СН3 групата са характерни линии на поглъщане, свързани с симетрично валентно трептение на връзката С-Н, които се намират в тясната област между 2850 и 2890 см-1 (от 3460 до 3509 nm), за антисиметричното трептение това е областта от 2940-2989 см-1 и т.н.
Характеристични честоти на трептения на някои молекулни групи.
|
Група |
Честота, см-1 |
Група |
Честота, см-1 |
|
–ОН |
3200-3600 |
>CH– |
2880-2900 |
|
–NH2 |
3380-3400 |
–CH3 |
2850-2815 |
|
>N-H |
3310-3360 |
>C=C< |
1620-1680 |
|
>CH2 |
2915-2935 |
–C≡C– |
2190-2260 |
Ротационните спектри характеризират молекулата като цяло. Затова и областта, в която се проявяват ротационните спектри се нарича още област на “дактилоскопския отпечатък” на молекулата. Чрез тях не не може да се определя наличието на специфични молекулни групи, но лесно се разграничават различните конформационни изомери, тъй като те имат различни инерчни моменти, а оттам и различни ротационни спектри.
54.3.3. Спектри на комбинационно разсейване.
Друг тип молекулни спектри са спектрите на комбинационно разсейване на светлината. Ако върху прозрачно вещество попада монохроматично лъчение, то в спектъра на разсеяното лъчение освен линии със същата честота се откриват и нови, честотата на които представлява сума или разлика от честотата на падащото лъчение и вибрационни или ротационни честоти - ν±νv.или ν±νr. Чрез спектрите на комбинационното разсейване можем да получаваме информация за колебателните и ротационните честоти на симетрични молекули, които нямат абсорбционни инфрачервени спектри. Рамановите спектри, подобно на инфрачервените спектри, можем да използваме за структурен, качествен и количествен анализ. Количествениат анализ на веществата по техните раманови спектри се базира на пропорционалността между интензитета на рамановите линии и концентрацията на вещестното. Структурният анализ чрез използване на раманови спектри се провежда по същия начин, както при използването на инфрачервени спектри, т.е. въз основа на познаване на характеристичните честоти на атомните групи и химичните връзки в молекулите. Качественият анализ се базира на специфичността на рамановите спектри на повечето съединения, като се прилагат обекновените методи за сравняване на спектъра на непознатото вещество със спектрите на познати съединения.
54.3.4. Луминесцентни спектри
Луминесценция - това е нетоплинно излъчване от газове, течности и твърди тела. Получава се при преход на атом или молекула от възбудено към основното им състояние. Възбуждането на атомите или молекулите може да става по различни начини, най-често при осветяване с видима и ултравиолетова светлина (фотолуминесценция).
В зависимост от времето, след което се появява светене, луминесценцията се разделя на флуоресценция (светенето се появява след време от 1.10-8 до 1.10-7s след възбуждането) и фосфоресценция (светене се появява след повече от 10-4 s).
Фотолуминесценцията започва с акт на поглъщане на фотон с енергия hυ от атом или молекула, която преминава във възбудено състояние. В най простия случай, когато веществото се състои от практически невзаимодействащи си атоми, възбуденият атом се връща в основното си състояние като излъчва фотон със същата енергия и честота. Това явление става за време от порядъка на 10-8s и се нарича резонансна флуоресценция (Фиг. 54.4).
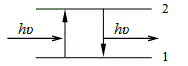
Фиг. 54.4.
На енергията на електроните в молекулите оказват влияние и колебателните и въртеливи движения на атомите в молекулата. При сложни молекули е възможен такъв процес - електронът от възбудено състояние 3 без излъчване преминава на ниво 2, а след това спонтанно с излъчване преминава в основно състояние (Фиг. 54.5).
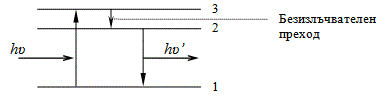
Фиг. 54.5.
Следователно излъченият фотон ще има по-малка енергия, а от там и по-малка честота и по-голяма дължина на вълната от възбуждащия фотон. Например ако възбуждането става с ултравиолетова светлина, след това веществото излъчва във видимия диапазон.
hυлум = hυпог - Етопл
υлум < υпог
λлум > λпог
Луминесцентен анализ се нарича метода за изследване на различни обекти под действие на ултравиолетово лъчение, което предизвиква луминесценция на тези обекти. Много биологични молекули, например белтъци, могат да флуоресцират. В последните години се използват и специални флуоресциращи молекули, които се добавят към биологичните мембрани. Те могат да играят роля на флуоресцентни сонди, при нековалентни връзки с мембраните, или флуоресцентни белези, при свързването им с химични връзки с мембраната.
Луминесцентен анализ се използва за контрол на хранителни продукти. Например цвета на месото при облъчване с ултравиолетово лъчение з зависимост от степента на разваляне се променя от червено-виолетов до зелено-сив., на рибите от сив до жълто-зелен, на млякото от зелено-жълт до син и др.
Проницаемостта на капилярите може да се определи като се вкара подкожно луминесциращи оцветяващи вещества.
В криминалистиката чрез ултравиолетово облъчване могат да се откриват невидими с просто око следи от кръв, като кръвта на човек може да се разграничи от кръвта на други животни. Различно луминесцират и истински и фалшиви банкноти, различни мастила и др.
В биологията се използват и луминесцентни микроскопи. При облъчване с ултравиолетово лъчение на различни препарати могат да се диагностицират различни инфекциозни заболявания, например гъбични инфекции, аномалии в пигментацията и др.
54.4. Рентгенови спектри
Рентгеновите спектри са свързани с преходи между вътрешните К, L, M електронни нива в атомите и молекулите. На такива преходи отговаря лъчение в рентгеновата област - с дължина на вълната от 10nm до 100pm. Характерна особеност на рентгеновите спектри е, че те не зависят дали излъчващият атом е свободен или е свързан с други атоми в молекула.
54.5. Ядрен парамагнитен резонанс (ЯМР)
При поставяне на ядра на някои атоми, които имат нечетен брой нуклони като 1H, 13C, 19F и др. в магнитно поле, се наблюдава разцепване на спинови ядрени нива (Фиг. 54.6).
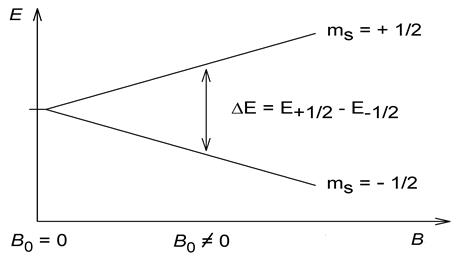
Фиг. 54.6. Разцепване на спинови нива в магнитно поле.
Разликата в двете енергии (двете нива) е пропорционална на магнитната индукция.
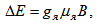 , където gя - ядрения фактор на Ланге; μя - ядрения магнетон, приблизително 2000 пъти по-малък от магнетона на Бор; В - магнитната индукция на магнитното полето.
, където gя - ядрения фактор на Ланге; μя - ядрения магнетон, приблизително 2000 пъти по-малък от магнетона на Бор; В - магнитната индукция на магнитното полето.
Условието за резонансно поглъщане е 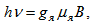 , където ν е резонансната честата, намираща се в радиодиапазона. Условието за резонанс може да се постигне или чрез постепенно изменение на честотата на високочестотното електромагнитно поле ν при определена фиксирана стойност на магнитната индукция В, или чрез промяна на В при фиксирана честота (Фиг. 54.7).
, където ν е резонансната честата, намираща се в радиодиапазона. Условието за резонанс може да се постигне или чрез постепенно изменение на честотата на високочестотното електромагнитно поле ν при определена фиксирана стойност на магнитната индукция В, или чрез промяна на В при фиксирана честота (Фиг. 54.7).
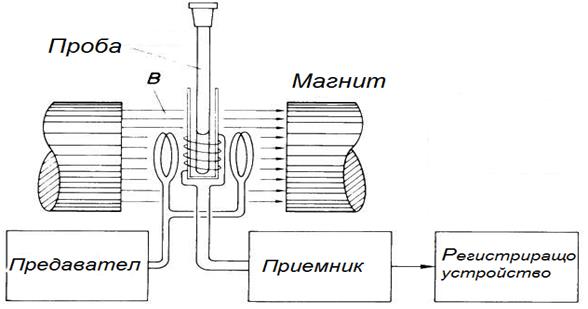
Фиг. 54.7.Схема на ЯМР спектрометър.
В действителност се наблюдава резонансно поглъщане на честота, малко по-различна от изчислената по това уравнение. Това се нарича химично отместване. Дължи се на екраниращото действие на собственото магнитно поле на електроните от електронната обвивка на атомите, влизащи в състава на изследваното вещество. Следователно за едно и също ядро, но поставено в различно обкръжение (свързано по различен начин в различни молекули), резонанс ще се наблюдава при различни честоти. Това прави ЯМР мощен метод за структурно-аналитични изследвания.
54.6. Електронен парамагнитен резонанс (ЕПР)
Когато парамагнитни вещества (вещества, които имат несдвоен електрон) се поставят в магнитно поле, енергията на несдвоения електрон може да има две стойности в зависимост от ориентацията на спина. Разликата в двете енергии (двете нива), подобно на ЯМР, е пропорционална на магнитната индукция.
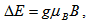 , където g - фактор на Лангe;
, където g - фактор на Лангe; 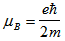 - магнетон на Бор; В - магнитната индукция на магнитното полето.
- магнетон на Бор; В - магнитната индукция на магнитното полето.
Ако освен в магнитно поле изследваното вещество се постави във високочестотно електромагнитно поле с честота ν, такава, че да е изпълнено условието 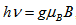 , то ще се наблюдава резонансно поглъщане на лъчението.
, то ще се наблюдава резонансно поглъщане на лъчението.
С ЕПР могат да се изучават парамагнитни вещества в газообразна форма, разтвори, праховидни проби, монокристали и замразени разтвори. Този метод се прилага широко в органичната химия, биохимията, биофизиката и т.н. Може да се използва за изучаване на свободните радикали, за изясняване на механизмите на окислително-възстановителните реакции, за определяне на свободна и свързана вода в биологични обекти и др. Голяма част от приложенията на ЕПР в биофизиката и биохимията се основават на изследвания с помощта на т.н. нитроксилни радикали (=NO*). Ако нитроксилният радикал се използва се използва за изследване на молекула като се присъединява ковалентно към различни нейни части, се нарича спин-маркер. В случай, когато той се използва несвързан, той дава информация за обкръжаващите го молекули и се нарича спин-сонда. Със спинови сонди например е изследвана флуидността на клетъчните мембрани и нейното изменение под действие на някои вещества, температура и т.н. Със спин-маркери е установена напречната дифузия на липидни молекули.




