3. ВЕЩЕСТВА В КЛЕТКАТА
Белтъци
Белтъчините са важни макромолекули, изградени посредством поликондензирането на различни аминокиселини. Те са основната градивна единица, както при клетъчните, така и при не клетъчните форми на живота. Характеризират се със сложна пространствена структура и притежават огромно разнообразие от биологични функции. В биохимичен смисъл, протеините са линейни полимери, съставени от последователното подреждане на до 20 различни α–аминокиселини - Лизин, Триптофан, Левцин, Треонин, Метионин, Валин, Фенилаланин, Изолевцин, Хистидин, Аланин, Аспартова киселина, Глутаминова киселина, Аргинин, Аспарагин, Цистеин, Глутамин, Глицин, Пролин, Тирозин и Серин. Аминокиселините са изградени от молекули въглерод, свързан с аминогрупа, карбоксилна група и странична верига, специфична за всяка аминокиселина. Изключение от тази обща спецификация прави единствено аминокиселината пролин, при която в N аминогрупата се съдържа пръстен. Триизмерната структура, химичната реактивност и биологичната функция на един белтък се определят от комбинацията на наличните странични вериги на аминокиселините, които го изграждат. Отделните аминокиселини се свързват последователно в полипептидни вериги, чрез изграждане на пептидни връзки по между си. При разглеждането на една полипептидна верига можем да установим два края на – карбоксилен край (СООН) и аминокрай (NH).
Аминокиселини
Аминокиселините откриващи се в живите клетки се означават като алфа (α) аминокиселини, тъй като при тях карбоксилната и аминогрупата са разделени от един въглероден атом. Ако двете групи са разделени от два или повече въглеродни атома, аминокиселините се означават като бета (β), гама (γ) и т.н.
С изключение на глицина, всички останали протеиногенни α-аминокиселини са хирални съединения и притежават два енантиомера - L и D форма. Биологична активност притежават само L формите на аминокиселините. В метаболитно отношение аминокиселините се разделят на три групи в зависимост от това дали се синтезират в организма или трябва да се доставят от вън – заменими, незаменими и условнозаменими аминокиселини. За разлика от микроорганизмите и растенията, които синтезират всички необходими аминокиселини, животиснките клетки синтезират само някои от тях, а останалите се набавят посредством храната. Условнозаменимите аминокиселини са незаменими за новородените, бременните, както и индивидите с отклонения в обмяната на веществата. При всички останали тези аминокиселини са заменими.
В зависимост от свойствата на остатъка който притежават, познатите ни 20 аминокиселини могат да бъдат разделени на четири групи:
Неутрални аминокиселини с неполярен остатък:
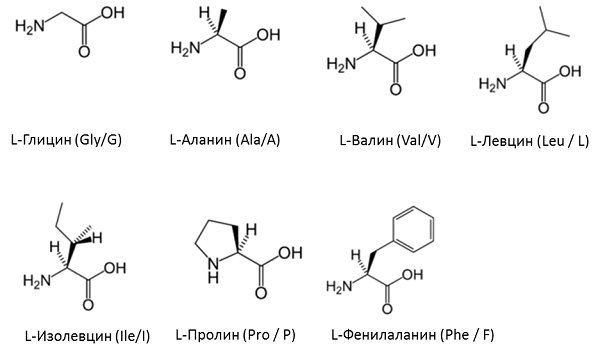
Неутрални аминокиселини със слабо полярен остатък:
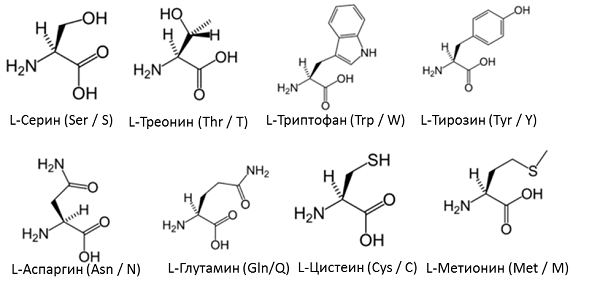
Аминокиселини с ациден остатък:

Аминокиселини с основен остатък:

Структура на белтъците
Както вече описахме, отделните аминокиселини се подреждат последователно в различни по дължина полипептидни вериги. Характерно за всяка белтъчина е нейната уникалност по отношение на вида и броя на аминокиселинните остатъци които я съставят. Функцията на белтъчини до голяма степен се предопределя от пространствената структура на полипептидните вериги. Структурата на белтъците се подразделя на следните четири нива:
- Първична структура на белтъците – определя се от последователността на свързване между отделните аминокиселини в полипептидната верига (ППВ). Правилното подреждане на аминокиселините в белтъчните молекули е закодирано в наследствената програма на всяка клетка. Основна роля в първичната структура на белтъците играят дисулфидните мостове между две тиолови групи на цистеинови остатъци. Дисулфидните мостове биват вътрешноверижни – свързват два цистеинови остатъка в една ППВ и междуверижни – свързват цистеинови остатъци принадлежащи към две вериги.
- Вторична структура на белтъците – определя се от локалните нагъвания на основния скелет на полипептидната верига. В зависимост от характерната форма която заема молекулата са описвани следните вторични структури: α-спирала, β-лист, β – завой и γ – завой.
- α-спирала – това е най-компактната форма на ППВ. Възниква при образуването на водородни връзки между една пептидната група и третата следваща след нея. Изградените връзки по продължение на цялата ППВ водят до нейното огъване на мястото на всеки a-въглероден атом. Така всеки един оборот на получената спирала включва 3,6 аминокиселинни остатъка. Повечето описани в природата α-спирали са завити на дясно. Макар и рядко се наблюдават и α-спирали при които водородните връзки възникват между една пептидна група и втората или четвъртата след нея.
- β-лист – това е най-опънатата форма на ППВ. Възниква при сравнително опънати ППВ, като между пептидните групи на две близкостоящи такива вериги се формират водородни връзки – водородни мостове. Гръбнакът на получената структура се извива зигзагообразно и наподобява разпънато ветрило. Описани са и случаи на формиране на β-листна структура в рамките на една ППВ.
- Третична структура на белтъците – формира се при пълното пространствено нагъване на ППВ, при което отделни участъци (отдалечени по местоположение в първичната структура) се разполагат един до друг и могат да си взаимодействат. Третичната структура на белтъците зависи от подреждането на аминокиселинните остатъци в ППВ и е генетично детерминирана. Третичната конформация на белтъците се поддържа от множество нековалентни връзки:
- Водородни връзки – формират се при привличането на водороден атом от два електроотрицателни атома. В следствие на това привличане водородният атом застава помежду им като мост. В белтъчните молекули съществуват водородни връзки между азотният атом на една пептидна група и кислородният от друга, между карбонилната група и пептидната и др. Характерно за водородните връзки е тяхната относителна слабост (в сравнение с ковалентните), но големият им брой в белтъчните молекули спомага за поддържането на пространствената конформация.
- Йонни връзки – формират се в следствие на електростатичните сили на привличане между различно натоварените атоми в молекулата. Поради факта, че рН играе основна роля за броя и вида на натоварените групи, то броят на тези връзки е строго зависим от колебанията на рН на средата.
- Взаимодействия с p-връзки – формират се при паралелното разполагане на ароматните пръстени на аминокиселините фенилаланин, триптофан и тирозин.
- Хидрофобни взаимодействия – формират се при доближаването на ненатоварени групи. Характерно за тях е, че силата на привличане зависи от разстоянието на атомите. Оптималното отстояние е между 0,32 и 0,37 nm, намаляването на това разстояние води до отблъскване. При нагъването на веригата се установява приближаване на множество неполярни групи, при което силите на привличане се засилват.
- Дипол-диполни взаимодействия – те нямат същетствно значение за поддържането на пространствената конформация на белтъците, но участват при взаимодействието на веригата с други молекули.
- Четвъртична структура на белтъците – представлява цялостна пространствена структура на белтъците при която са асоциирани белтъчни молекули посредством нековалентни връзки. Формирането на четвъртична структура предполага наличието на поне две ППВ (субединици), като полученият комплекс се означава като конгломерат. В тези участъци се формират активните центрове на белтъците, чрез които те взаимодействат различните вещества в клетката.
Денатурация на белтъците.
Белтъчните молекули са силно чувствителни към условията на средата в която се намират. При отклонение в температурата, рН, солевият състав и т.н. в белтъчните молекули настъпват промени касаещи тяхната вторична, третична и четвъртична структура. Процесът се означава като коагулация и е следствие от разкъсването на водородните връзки, поддържащи споменатите три равнищана пространствената конформация на белтъците. При кратковременно въздействие на вредният фактор, процесът е обратим (ренатурация), докато при продължително въздействие настъпват трайни увреждания в белтъчната молекула (коагулация). Описани са различни белтъчни молекули които предпазват останалите белтъчини в клетката от замръзване (antifreezing proteins), висока температура (heat shock proteins) и т.н.
В зависимост от наличието или отсъствието на неаминокиселинни компоненти в молекулата на белтъците, те се разделят на:
- Прости белтъчини – съдържат само аминокиселини в своите ППВ.
- Комплексни белтъчини – освен аминокиселинни остатъци, съдържат и небелтъчни компоненти (простетични групи). Според природата на непротеиновият компонент в молекулата на комплексните белтъчини, те се делят на:
- Гликопротеини – съдържат ковалентно свързани въглехидратни остатъци.
- Липопротеини – съдържат нековалентно свързани липиди.
- Нуклеопротеини – съдържат ковалентно свързани нуклеинови киселини – ДНК или РНК.
- Металпротеини – съдържат нехемово координативно свързани метални йони.
- Фосфопротеини – съдържат ковалентно свързани остатъци от фосфорна киселина.
- Хромопротеини – протеини с цветни групи от различен химичен характер.
Функция на белтъците
Белтъците в клетката изпълняват различни функции – транспортна (пренасящият кислород хемоглобин в червените кръвни клетки), съкратителна (белтъчините в мускулните влакна), те могат да са антитела-изпълнители на определени функции; ензими (например храносмилателни) или хормони (растежен хормон или инсулин), поради което тяхната пространствена структура е различна в зависимост от тяхното предназначение. Особено значение за клетката имат белтъците вземащи участие в процесите репликация и репарация на ДНК, транскрипция на РНК, транслация и др. Най-широко разпространените форми на белтъците са кълбовидната (глобуларните белтъци) и нишковидната (фибриларните белтъци). За разлика от други органични съединения, те съдържат в молекулата си азот, затова белтъците нямат хранителен заместител. Белтъчините участват както в изграждането на клетъчните структури, така и в регулацията на жизнените процеси на клетката, което ги прави незаменим компонент на живата материя.
Липиди
Липидите са голяма група органични съединения, включваща мазнините, восъците, стеролите, моноглицеридите, диглицеридите, фосфолипидите и други. Те са хидрофобни и амфифилни съединения, което обуславя тяхната неразтворимост във вода. Амфифилността на някои липиди им позволява да образуват структури като секреторни мехурчета, липозоми или мембрани във водна среда. Най-разпространените липиди са мазнините, като трябва да отбележим, че повечето животински мазнини оставени на стайна температура са полутечни или твърди, докато повечето растителни мазнини запазват течната си структура. Липидите влизат в състава на по-сложни органични съединения – фосфолипидите, холестеролът и липопротеидите. Основните биологични функции на липидите са съхраняването на енергия, участието в структурата на клетъчната мембрана и в клетъчната сигнализация.
Видове липиди:
- Мастни ацили – това са всички познати мастни киселини и техните съединения. Тези вещества се синтезират посредством удължаването на ацетил КоА с групи малонил КоА или метилмалонил КоА. Изградени са от въглехидратна верига, която завършва с група на карбоксилната киселина. Единият край на описаната структура е хидрофилен (полярен), а другият е хидрофобен (неполярен). В повечето случаи въглеродната верига съдържа между 4 и 24 атома, като може да бъде наситена или ненаситена. При сформирането на двойни връзки между отделни компоненти на мастните ацили, възникват различни молекулни конфигурации. Повечето мастни киселини са открити в цис-конфигурация, но при някои хидрогенирани масла е установена и транс-конфигурация.
- Сфинголипиди – изградени са на базата на аминоалкохола сфингозин и остатък от мастна киселина. Сфинголипидите придават здравина на клетъчната мембрана и спомагат за междуклетъчното разпознаване и сигнализация. При отклонения в нормалният метаболизъм на сфинголипидите при бозайниците се наблюдават различни заболявания, свързани предимно с нервните тъкани.
- Стеролови липиди – те са високомолекулни хидроароматни алкохоли. Представители на тази група липиди са холестеринът и ситостеринът.
- Глицеролипиди – те са естери на глицерина с мастните киселини, което обуславя и другото им име – триглицериди. Свойствата на глицеридите са силно зависими от мастните киселини влизащи в състава им – стеаринова, олеинова, линолова и др.
- Фосфолипиди – те са основната градивна единица на клетъчните мембрани. Те са сходни с описаните по-горе глицериди, но при тях една от хидроксилните групи е заместена с фосфорна киселина.
- Други видове липиди – полокетиди, захаролипиди, пренолови липиди и др.
Въглехидрати
Въглехидратите са органични съединения, отличаващи се с наличието на въглерод, водород и кислород в своите молекули. Повечето въглехидрати притежават следната обща формула - Cn(H2O)m, от която виждаме наличието на елемента въглерод и вода. Базирайки се на тази формула, учените решават да ги нарекат въглехидрати (Carbohydrates – хидрати на въглерода). Въпреки, че в последствие тази теория била отхвърлена, наименованието на тези вещества в клетката било запазено. Въглехидратите могат да се разделят на четири групи: монозахариди, дизахариди, олигозахариди (съдържащи от 3 до 10 монозахаридни остатъка) и полизахариди. Докато монозахаридите не могат да се хидролизират, то останалите представители на този химичен клас се хидролизират до по-прости захари и в края до монозахариди. Въглехидратите са основен компонент в хранителните вещества на животните. Те отговарят за много жизнено важни функции в живата природата. Глюкозата е основният енергиен източник за клетъчния метаболизъм, докато скорбялата и гликогена се използват от клетката като енергиен склад. Описани са и въглехидрати изпълняващи структурна роля - целулозата в растенията и хитина в членестоногите. Пентозата рибоза е важен компонент на коензимите АТФ, ФАД, НАД и НАДФ, а също така участва и в изграждането на фосфозахаридния гръбнак на РНК. Дезоксирибозата пък участва в изграждането на захарофосфатният склет на ДНК.
Поради сладкият вкус на някои представители на въглехидратите в ежедневният език те се наричат захари. В зависимост от броя на монозахаридните остатъци във формулата си, въглехидратите се разделят на четири основни групи:
- Монозахариди – те са получени от поливалентни алкохоли, посредством окисление на първичната или вторична хидроксилна група (алдехидна или кетонна). В зависимост от броя на въглеродните атоми в структурата им те се делят на триози, тетрози, пентози, хексози и т.н. Едни от най-известните монозахариди са – глюкозата и фруктозата откривани в сладките плодове.
- Дизахариди – бихме могли да ги разглеждаме като две свързани монозахаридни молекули. При химичното им свързване се отделя вода или между хидроксилните групи на двата монозахарида или между гликозидната хидроксилна група на единият монозахарид и една от алкохолните групи на вторият монозахарид. Най-известните представители на дизахаридите са захарозата, трехалозата, лактозата и др.
- Олигозахариди – изградени са от няколко (обикновено от 3 до 10) монозахаридни остатъка. При животинските клетки те са разположени по повърхността на плазмената мембрана и вземат участие в разпознаването между клетките. Този клас въглехидрати взема участие при формирането на описаните по-горе гликопротеини.
- Полизахариди – изградени са от голям брой монозахаридни остатъци. Характерно за тях е, че не притежават сладък вкус и са почти неразтворими във вода. Към тази група въглехидрати принадлежат целулозата, хитинът, гликогенът и др.
Нуклеинови киселини
В биологичен смисъл нуклеиновите киселини са най-важните органични съединения в клетката, защото именно те са носители и преносители на наследствената информация. Те биват два вида в зависимост от захарният остатък който притежават – Дезоксирибонуклеинова киселина (ДНК) съдържаща дезоксирибоза (C5O4H10) и Рибонуклеинова киселина (РНК) съдържаща рибоза (C5O5H10). Освен захарид те притежават азотни бази и фосфорна киселина. При повечето живи организми наследствената информация се съхранява в молекули ДНК, а РНК молекулите пренасят тази информация до рибозомите, които от своя страна произвеждат специфичните белтъчини за всяка отделна клетка. Изключение от това правило правят някои вируси при които наследствената информация се съхранява в РНК молекули и прионите, които са все още не добре проучени, но се предполага, че тяхната наследственост се кодира в белтъчни молекули. Строежът, структурата и функциите на нуклеиновите киселини ще бъдат разгледани подробно в следващите раздели.
Въпроси за самоподготовка!
Протеините са линейни полимери, съставени от последователното подреждане на до 20 различни:
- Нуклеутиди
- Нуклеобротеини
- Монозахариди
- Аминокиселини
Първична структура на белтъците се формира от:
- Пълното пространствено нагъване на ППВ
- Последователността на свързване между отделните аминокиселини в полипептидната верига
- Цялостна пространствена структура на белтъците при която са асоциирани белтъчни молекули посредством нековалентни връзки
- Локалните нагъвания на основния скелет на полипептидната верига
Вторична структура на белтъците се формира от:
- Пълното пространствено нагъване на ППВ
- Последователността на свързване между отделните аминокиселини в полипептидната верига
- Цялостна пространствена структура на белтъците при която са асоциирани белтъчни молекули посредством нековалентни връзки
- Локалните нагъвания на основния скелет на полипептидната верига
Третична структура на белтъците се формира от:
- Пълното пространствено нагъване на ППВ
- Последователността на свързване между отделните аминокиселини в полипептидната верига
- Цялостна пространствена структура на белтъците при която са асоциирани белтъчни молекули посредством нековалентни връзки
- Локалните нагъвания на основния скелет на полипептидната верига
Четвъртична структура на белтъците се формира от:
- Пълното пространствено нагъване на ППВ
- Последователността на свързване между отделните аминокиселини в полипептидната верига
- Цялостна пространствена структура на белтъците при която са асоциирани белтъчни молекули посредством нековалентни връзки
- Локалните нагъвания на основния скелет на полипептидната верига
Към групата на липидите принадлежат:
- Белтъците и нуклеиновите киселини
- Монозахаридите и алкохолите
- Восъците и глицеридите
- Дизахаридите и ППВ
В зависимост от броя на монозахаридните остатъци във формулата си, въглехидратите се разделят на:
- Монозахариди, Дизахариди, Олигозахариди и Полизахариди
- Хипозахариди и Хиперзахариди
- Монозахариди, Пентазахариди и Октазахариди




