Антимикробни вещества
|
Учебни цели С усвояването на материала в тази тема ще се получат знания относно: |
|
Темата включва:
- Основни принципи и термини, свързани с антимикробната терапия.
- Механизъм на антимикробна активност.
- Резистентност на микроорганизмите спрямо антибактериални средства.
- Основни правила на антимикробната терапия.
- Синтетични антибиотици.
- 5.1 Сулфонамиди.
- 5.2 Нитрофуранови производни.
- 5.3 Нитроимидазолови производни.
- 5.4 Нитротиазолови производни.
- 5.5 Хинолони.
- Бета-лактамни антибиотици.
- Аминогликозиди и аминоциклитоли.
- Тетрациклини.
- Фениколи.
- Макролиди.
- Линкозамиди.
- Анзамицини.
- Полимиксини.
- Нутритивни антибиотици.
1. Основни принципи и термини, свързани с антимикробната терапия
Антибиотик е всяка субстанция от природен, полусинтетичен или синтетичен произход, която убива микроорганизми или подтиска микробиален растеж и не влияе или слабо влияе върху макроорганизма. Антимикробният спектър на антибиотиците дава описание на общата активност на дадено антимикробно средство срещу микроорганизми. Тясноспектърни са субстанциите, влияещи върху ограничен брой бактерии. Широкоспектърните обикновено показват активност срещу широк кръг от бактерии, включително срещу микоплазми, рикетсии, хламидии. Понятието спектър е относително. То не показва гаранция за ефикасност срещу определен бактериен изолат. Понятието антимикробна активност (отразяващо фармакодинамията им) описва природата на ефекта на антимикробното средство. Тя в основата си е [1] бактериостатична и бактерицидна. Средствата с бактериостатична активност спират размножаването на микроорганизмите, но не ги убиват. Всички антимикробни средства са статични в определени концентрации. Някои са статични във всички концентрации (тетрациклини, сулфонамиди). Някои са способни на бактерициден ефект при достатъчно високи концентрации и достатъчно време за поддържането им. Бактерицидната активност е свързана с унищожаване на микроорганизмите, предизвикали инфекцията. Бактерицидната активност може да бъде зависима от концентрацията, зависима от концентрацията и времето, зависима от времето. Част от антибактериалните средства проявяват постантибиотичен ефект (ПАЕ) и ефект на началната експозиция.
2. Механизъм на антимикробна активност
В зависимост от характера на антибактериалния механизъм, антибиотиците се делят на следните групи: влияещи върху изграждането на бактериалната стена (пеницилини, цефалоспорини, бацитрацин, ванкомицин, флавомицин); влияещи върху протеиновата синтеза (фениколи, тетрациклини, аминогликозиди, макролиди, линкозамиди, плевромутилини); влияещи върху бактериалните мембрани (полимиксини, аминогликозиди, имидазоли); влияещи върху функциите на нуклеиновите киселини (хинолони, рифампицин); влияещи върху междинния метаболизъм (сулфонамиди, триметоприм).
Антимикробните средства се комбинират по различни причини. Една от тях е разширяване спектъра в случаи на неизвестен инфекциозен причинител. При комбинирането на два антибиотика са възможни следните типове на взаимодействие:
[2] Адитивен ефект – активността на комбинацията е равна на сумата от активностите на двете компоненти.
[3] Синергизъм между антибиотици – активността на комбинацията е значително по-висока от тази на двете компоненти, поради: последователно инхибиране на следващи стъпки в метаболизма (сулфонамиди – триметоприм), последователно инхибиране на синтезата на бактериалната стена (мецитицилин – ампицилин), улесняване проникването на единия антибиотик от страна на другия (бета-лактами – аминогликозиди), инхибиране на инактивиращи ензими (амоксицилин – клавуланова киселина), предпазване от развитие на резистентна микробна популация (еритромицин – рифамицин).
[4] Антагонизъм между антибиотици – активността на комбинацията е значително по-малка от активността на всеки един от компонентите и. Обикновено повече от бактериостатичните субстанции намаляват активността на бактерицидните. В други случаи бактериостатичните средства са достатъчни и приложението на бактерицидните не влияе върху тяхната активност.
Класификация на антимикробните средства
В зависимост от характера на химичната им структура, антимикробните средства се подразделят в следните групи:
Сулфонамиди
Хинолони
Нитропроизводни
Бета-лактами
Аминогликозиди
Тетрациклини
Фениколи
Макролиди
Линкозамиди
Стрептограмини
Полимиксини
Рифамицини и др.
Това разделение на антибиотиците отразява и други техни общи характеристики, като механизъм на действие. Основно значение за проявяване на фармакодинамиката на антимикробните средства има тяхната фармакокинетика поради факта, че за да се получи антибактериален ефект е необходим пряк контакт на молекулите антимикробно средство с микроорганизмите, провокиращи заболяването.
3. Резистентност на микроорганизмите спрямо антибактериални средства
Резистентността към антибиотиците съществува преди използването им като лечебни средства. Тази форма на резистентност обаче не е в основата на съществуващото в момента статукво на резистентност. Тя е резултат повече от генетични изменения, получени чрез мутация или трансфер на генетичен материал по време на живота на микроорганизмите и съответната селекция. Приложението на антибиотиците в хуманната медицина е основна причина за резистентността при човешката популация. Директният контакт с животните и консумацията на продукти от животински произход са в основата на трансфера на резистентност от животни към човек и обратно. Според мнения на някои автори, практически пренасяне на резистентност в посоката животни - човек не съществува.
Активност на различни антимикробни средства по групи*
|
Групи антибиотици |
Микроорганизми |
|||||
|
Бактерии |
Микоплазми |
Рикетсии |
Хламидии |
Протозои |
|
|
|
Сулфонамиди |
+ |
+ |
|
+ |
+ |
|
|
Триметоприм |
+ |
|
|
|
+ |
|
|
Хинолони |
+ |
+ |
+ |
+ |
|
|
|
Бета лактами |
+ |
+ |
|
|
|
|
|
Аминогликозиди |
+ |
|
|
|
|
|
|
Фениколи |
+ |
+ |
+ |
+ |
|
|
|
Тетрациклини |
+ |
+ |
+ |
+ |
|
|
|
Макролиди |
+ |
+ |
|
+ |
|
|
|
Линкозамиди |
+ |
+ |
|
|
+ |
|
|
Плевромутилини |
+ |
+ |
|
+ |
|
|
*Адаптирано от Prescott J.F and Baggot J.D. antimicr. Ther. Vet. Med. Second Edition
Антибактериален спектър на различни антимикробни средства
|
Аероби |
Анаероби |
Представители |
||
|
Gr+ |
Gr- |
Gr+ |
Gr- |
|
|
+ |
+ |
+ |
+ |
тетрациклини, фениколи, цефокситин |
|
+ |
+ |
+ |
± |
пеницилин, цефалоспорини / клавуланова киселина, |
|
+ |
± |
+ |
± |
ампицилин, амоксицилин |
|
|
+ |
|
|
полимиксини |
|
+ |
± |
+ |
± |
пеницилин G, пеницилин V |
|
+ |
+ |
|
|
аминогликозиди, сулфонамиди/триметоприм, енрофлоксацин |
|
+ |
|
+ |
+ |
линкозамиди, макролиди, плевромутилини |
|
+ |
|
+ |
|
бацитрацин |
± Непостоянно проявена активност
|
Група |
Спектър |
Механизъм на резистентност |
Проявена токсичност |
|
Сулфонамиди |
Gr+, Gr- Протозои |
Компетитивен метаболизъм Понижен афинитет |
Нефротоксичност, имунни реакции, хемолитична анемия, депресия |
|
Флуорохинолони |
Gr+, Gr- без анаероби микоплазми |
Изхвърляне Свързване с други структури |
Нарушения в хрущялната тъкан на новородени |
|
Пеницилини |
Gr+, Gr-
|
Инактивиране, понижен афинитет, изхвърляне |
Свръхчувствителност |
|
Цефалоспорини |
Gr+, Gr- - |
Инактивиране, понижен афинитет, изхвърляне |
Свръхчувствителност, имунни реакции, треска |
|
Аминогликозиди |
Gr+, Gr- Без анаероби |
Инактивиране, понижен афинитет, изхвърляне |
Нефротоксичост, мускулен блок, ототоксичност, вестибуларен апарат |
|
Тетрациклини |
Gr+, Gr-, Микоплазми,Рикетсии, Хламидии |
Изхвърляне |
Хепатотоксичност, нефротоксичност, фототоксичност |
|
Макролиди |
Gr+ Микоплазми |
Изхвърляне |
Миокардиална депресия, непоносимост от хр. канал |
Фармакодинамика на антимикробните средства
Gr+-Грам-положителни микроорганизми; Gr--Грам-отрицателни микроорганизми
Механизъм на действие на антибактериални средства по групи
|
Влияещи върху: |
Представители |
|
Синтез на клетъчната стена |
Пеницилини, цефалоспорини, бацитрацин, ванкомицин |
|
Протеинова синтеза |
Фениколи, тетрациклини, аминогликозиди, линкозамиди, |
|
Клетъчна мембрана |
Полимиксини, аминогликозиди, Амфотерицин, Полиетерни |
|
Нуклеинови киселини |
Хинолони, Рифамицини |
|
Междинен метаболизъм |
Сулфонамиди, диаминопиримидини |
4. Основни правила на антимикробната терапия
Като водещи при използване на антимикробни средства могат да служат следните принципи:
Установяване наличие на инфекциозен причинител на заболяването, което определя смисъла на антибиотична терапия за елиминиране на причинителя.
- Важен момент е точното идентифициране на причинителя, или поне какъв причинител може да се очаква.
- Подбор на лекарствено средство, към което причинителите са чувствителни.
- Подпомагане защитните сили на пациента в процеса на ликвидиране на заболяването.
- Прилагане на дози, дозови интервали и начин на тяхното въвеждане, които да осигурят в мястото на инфекция и в съседство с него на терапевтични концентрации от лекарственото вещество.
- Използването на повече от едно антимикробно средство се практикува в случаи на резистентност (необходимост от синергизъм) или смесена инфекция.
- Случаите на неуспешна терапия трябва да бъдат изследвани за откриване и анализиране на вероятните причини (липса на бактериална етиология, неефективни концентрации в мястото на инфекцията, антибиотичното средство не прониква в мястото на инфекцията, бактериална резистентност, повторна инфекция и др.).
- Диагностициране на страничните явления и тяхното анализиране.
- При наличието на критични ситуации и липса на достатъчно време за изчакване на резултати относно вида и чувствителността на микробиалните причинители се започва терапия въз основа на клиничните признаци, вида на животното, възрастта и др, както и предполагаемия микробиален причинител на заболяването.
Не всички обаче могат да бъдат спазвани в случаи на критична ситуация. Често пъти в такива ситуации не е известен микробния причинител, респективно неговата чувствителност към различните терапевтични средства. В такива случаи се налага и използването на нестандартни средства, които не са официално показани за съответната терапия.
5. Синтетични антибиотици
5.1. Сулфонамиди
Сулфонамидите са синтетични производни на сулфаниламида (подобен структурно на пара-аминобензоената киселина). Всички сулфонамиди могат да се разглеждат като производни на амида на пара-аминобензолсулфоновата киселина. Антибактериалното им действие се простира върху грам-положителни (Gr+) и грам-отрицателни (Gr_) микроорганизми – бактерии, нокардии, хламидии, трихомонаси, протозои. Много щамове менингококи, гонококи, стрептококи, стафилококи, псеудомонаси, шигели, протеус, трепонеми и др. са резистентни. Продължителното масово приложение на сулфонамидите е довело до развитие и на широко разпространена придобита резистентност. Поради това тяхното самостоятелно използване е ограничено.
Фармакодинамика Активността им се проявява поради това, че те играят роля на структурни аналози и конкуренти на пара-аминобензоената кисeлина. Действието им е на две нива: на първото ниво те намаляват значително количеството на дихидрофолиевата киселина в микробните клетки. Второто ниво е свързано с включването им като структурни аналози на пара-аминобензоената киселина в молекулата на дихидрофолиевата киселина и създаване на непълноценни структурни аналози. Те не повлияват макроорганизма, който ползва готова постъпила в кръвта дихидрофолиева киселина. В микроорганизмите фолиевата киселина действа като коензим F, необходим за синтезирането на пурини, метионин, пантотенова киселина. Като резултат от тяхното действие се нарушава продукцията на РНК, блокира се синтезата на ДНК и протеини, и в крайна сметка – по-нататъшните делителни процеси и размножаването на микробните клетки. Използването на готова фолиева киселина е един от най-често срещаните механизми за развитието на естествена и придобита резистентност на микроорганизми към сулфонамиди. Чувствителните микроорганизми използват първо наличната си фолиева киселина преди да започне проява на действието на въведените сулфонамиди, което обикновено става 4 до 6 часа след тяхното приложение. В ниски концентрации може да бъде наблюдаван стимулиращ ефект по отношение на микроорганизмите. Бактерициден ефект практически не се получава при самостоятелното им приложение. Като средни минимално подтискащи нива се приемат между 8 и 32 µg/ml. Стойности на MIC от 64–128 µg/ml се интерпретират като наличие на резистентност. По отноношение чувствителността си към сулфонамиди причинителите на инфекции на пикочните пътища се разделят на следните групи:
- високо чувствителни - Bacillus spp., Brucella spp., Erysipelothrix rhusiopathiae, Listeria monocytogenes, Streptococcus spp. (пиогенни), Actinomyces spp., Chlamidia spp., Pneumocyctis carinii, Cryptosporidium sp., кокцидии и др.
- средно чувствителни – Gr+ аероби като стафилококи, ентерококи, Gr_ аероби като Enterococcus spp., E. coli, Klebsiella spp., Proteus spp., Actinobacillus spp., Haemophylus spp., Pasteurella spp. и др.
- резистентни – Mycobacterium spp., Mycoplasma spp., Ricketsia spp., p. aeruginosa, спирохети и др.
Поради характера на своя антибактериален ефект са активни в началото на инфекцията, когато се наблюдава и логаритмичната фаза на развитието на микроорганизмите. Слабо ефективни са в хронифицирани случаи. Клетките на висшите видове животни не се повлияват. Сулфонамидите са неразтворими във вода, поради което се използват предимно натриевите им соли. Те обаче имат високо рН, поради което разтворите им притежават дразнещ ефект и не са пригодни за екстравазкуларно парентерално въвеждане преди да бъдат буферирани. Прилагат се за лечение на инфекции на централната нервна система, дихателните пътища, храносмилателния канал, меките тъкани и особено пикочно-половата система.
Резистентност Тъй като сулфонамидите се използват широко в продължение на 60 години, част от микроорганизмите са придобили резистентност спрямо тях, особено когато се прилагат самостоятелно. Тя се дължи на нарушено лекарствено проникване в микробните клетки, на повишена активност на ензимите, продуциращи пара-аминобензоена киселина и на плазмидна основа. По принцип изградената резистентност към един сулфонамид е в сила и за всички останали.
Фармакокинетика Докато фармакодинамиката на сулфонамидите е твърде близка помежду им, то тяхното поведение в организма е твърде различно, въпреки че имат и общи черти. Скоростта и степента на резорбцията им варира и зависи от структурата им. Повече от познатите сулфонамиди, приложени вътрешно се резорбират сравнително бързо и в повечето случаи относително пълно. Изключение правят няколко субстанции като сулфагванидин и фталилсулфатиазол, чието преминаване през здрава лигавица на храносмилателния канал е органичено. Всъщност всеки представител на тази група притежава своя специфична скорост и степен на резорбция от храносмилателния канал. Стойностите на максималните кръвни концентрации се получават между ½ и 4 часа след въвеждането и те варират в широки граници в зависимост от степента на резорбция. Попаднали в кръвния ток, сулфонамидите биват разпределяни в различни органи и меки тъкани, включително централната нервна система, стави и др. Най-високи тъканни нива се намират в бъбреците, черния дроб (респективно урина и жлъчка), бели дробове. Другите тъкани и секрети обикновено съдържат нива близки до и по-ниски от кръвните. Наблюдавани са известни видови различия, както и специфика, определяна от химичната група на всяка една субстанция. Свързването с протеините варира в зависимост от сулфонамида и вида на животните в широки граници – между 15 и 90%. Високият процент на свързване с протеините (предимно албумини) има за резултат удължен биологичен полуживот и понижаване на концентрациите активен сулфонамид, поради това, че активни са само несвързаните с протеини и нейонизирани фракции. Тъй като сулфонамидите са слаби киселини, тяхното рН не е благоприятно за преминаване в млякото, което ограничава възможността за лекуване на възпаления на млечната жлеза. Биотрансформацията на сулфонамидите преминава през две фази. В първата част хидрофобните молекули се преобразуват в по-добре разтворими във вода, чрез включване на полярни функционални групи. През втората фаза се осъществява предимно свързване на функционалните групи от молекулите им с водоразтворими комплекси като глюкуронова киселина, сулфатен, ацетилов радикали и др. Тези реакции са локализирани главно в черния дроб, но са намерени и в белите дробове, бъбреците и др. Основните процеси на метаболизма на сулфонамидите – ацетилиране и хидроксилиране са застъпени в нееднаква степен при различните видове. Хидроксилирането като процес е изучено по-слабо. Може да се каже, че този процес проявява значителна видова специфика – преживните например имат високо ниво на хидроксилиране, докато при свинете то практически отсъства. Ацетилирането е добре застъпено при човек, свиня, куче и др. Извършва се от N-ацетилаза и ацетилкоензим А. Налице са също междувидови и вътревидови генетично обусловени различия в активността на тези ензими, което е причина за разделянето на индивидите на бързи и бавни ацетилатори. Ацетилирането е част от двустранен процес ацетилиране-дезацетилиране, равновесието между които, също е видова особеност, зависеща и от структурата на отделните субстанции. Кучетата и близките до тях видове имат изключително високо ниво на дезацетилиране, така че привидно при тях ацетилирането не се осъществява. Гълъбите и овцете имат равни нива на ацетилиране и дезацетилиране. Скоростта на ацетилиране е в зависимост и от структурата на отделните сулфонамиди. Свързването с глюкуроновата киселина е установено предимно при висши животни и има специфична за вида характеристика. Казано обобщено, основните пътища на метаболизъм на сулфонамидите са ацетилиране, хидроксилиране, свързване с глюкуроновата киселина. Трите начина се наблюдават у всички домашни видове бозайници с изключение на кучета, които фиктивно не ацетилират. В количествен аспект най-добре е застъпено ацетилирането при говеда, овце и свине, но хидроксилирането на сулфадимидин също е във висок процент. Ацетилираните метаболити са по-малко разтворими във вода от техните предхождащи и увеличават риска от тубуларна преципитация и кристалообразуване. Глюкуронидите са водоразтворими и се излъчват бързо чрез урината. Освен споменатите метаболитни пътища са установени и окисление, дезаминиране, свързване със сярна киселина, разрушаване на цикличните пръстени и др. Независимо от начина на метаболизиране се получават по-слабо активни (хидроксиметаболити) или терапевтично неактивни (N4-ацетил метаболити). Резорбируемите сулфонамиди, осигуряващи терапевтични концeнтрации се излъчват чрез бъбреците като непроменени субстанции или като метаболити. Основни пътища на елиминиране са гломерулната филтрация, проксимална тубуларна екскреция, като се установява и обратна пасивна реабсорбция на нейонизирани молекули от урината в дисталните тубули. Други пътища с по-малко значение за степента на елиминиране са чрез сълзите, жлъчката, млякото, слюнката. Скоростта на екскреция на сулфонамидите зависи от рН на урината. Киселата среда активира реабсорбцията и намалява нивото на елиминация. Обратно алкалната урина съдейства за ускоряване на уринна екскреция на сулфонамидите. Повечето представители с дълъг биологичен полуживот претърпяват значима реабсорбция като допълнение на ентерохепаталния кръговрат, който обикновено също се наблюдава като елемент на поведението им. Трудно резорбируемите сулфонамиди се излъчват предимно чрез храносмилателния канал, а резорбираната малка част от тях както всички останали – чрез споменатите вече ренални пътища.
Класификация Използваните в клиничната практика сулфонамиди се разделят на няколко групи в зависимост от фармакокинетиката им:
- бързо резорбиращи се и бързо излъчващи се – сулфонамиди, осигуряващи след терапевтична доза, кръвни концентрации от 50 mg/ml за по-малко от 12 часа;
- сулфонамиди със средна продължителност на действие – осигуряващи кръвни нива от 50 mg/ml за време от 12 до 24 часа;
- сулфонамиди с удължено действие – осигуряващи необходимите концентрации за време по-дълго от 24 часа;
- трудно резорбируеми, проявяващи антибактериален ефект само в храносмилателния канал.
Токсичност
По-важните токсикози са:
Кристалурия. Кристалурията може да бъде съпътствана от хематурия, и ренална тубулна блокада. Те са резултат от кристализирането на сулфонамиди и техни метаболити в гломерулния филтрат на бъбреците. Дехидратирането на организма и киселата урина съдействат за повишената криста-лизация поради високата им концентрация и намалената разтворимост. Кристалурията може да бъде редуцирана или избягната при терапевтичното рехидратиране на организма, недопускането му, както и при допускане на животните да пият достатъчни количества вода. Препоръчват се и средства алкализиращи организма и урината като натриев хидрогенкарбонат.
Кератоконюнктивит. Етиологията на конюнктивита (наречен сух) при използването на сулфонамиди е недостатъчно изяснена. Боледуват предимно леките кучета.
Чернодробни некрози. Наблюдавани са при кучета. Механизмът на поява на патологията е непознат. Възможно обяснение е хиперсензитивна реакция. Възможна причина е и натрупването във високи концентрации на токсични при кучета метаболити, въпреки че кучетата са бавни ацетилатори.
Хипотромбинемия. Наблюдавана е също при кучета, третирани предимно със сулфаквиноксалин. Смята се, че негови метаболити като квиноксалин могат да инхибират активността на витамин К. Третирането с витамин К в продължение на 4-7 дни води до възстановяване без други отклонения. Други по-рядко срещани странични явления са апластична анемия, тромбоцитемия, както и реакции основани на идиосинкразия, подтискане на карбоанхидразата и др.
Класификация на избрани сулфонамиди в зависимост от продължителността на действие в организма
|
С кратко действие |
Със средна продължителност |
С удължено действие |
Трудно резорбируеми |
|
Сулфатиазол |
Сулфадиметоксин |
Сулфадиметоксин |
Сулфагванидин |
|
Сулфацетамид |
Сулфапиридин |
Сулфаметилфеназол |
Фталилсулфатиазол |
|
Сулфахлорпиридазин |
Сулфадимидин |
Сулфаметопиразин |
|
|
Сулфаметоксазол |
Сулфахлорпиразин |
Сулфален |
|
|
|
Сулфадиазин |
|
|
|
|
Сулфадоксин |
|
|
|
|
Сулфаквиноксалин |
|
|
Резорбируеми сулфонамиди
Сулфаниламид Използван е в миналото при системни и локални инфекции. В момента не намира приложение поради широко проявена резистентност.
Сулфатиазол Повлиява предимно Gr+ микроорганизми. Приложен вътрешно се резорбира бързо, но не винаги пълно от храносмилателния канал на животни с еднокамерен стомах. Излъчва се бързо и осигурява терапевтични нива не по-дълго от 6 часа. Проявява всички описани токсични ефекти, характерни за сулфонамидите. Разтворите на натриевите му соли силно дразнят. Ясно е проявено подтискащото му активността на карбоанхидразата действие, което при кокошки носачки води до снасяне на яйца без черупки. Невритите също са срещано явление.
Сулфадимидин Влияе върху Gr+ и някои Gr- микроорганизми, както и върху кокцидии. При вътрешно въвеждане се резорбира във висока степен и на 2-ия час осигурява максимални кръвни концентрации. Разпределя се добре в организма като най-високи нива се установяват в бъбреците, черния дроб, белите дробове. Търпи видово и полово детерминиран метаболизъм предимно до ацетилирани и хидроксилирани продукти. Свързването с глюкуронова киселина е проявено в ниска степен предимно при бозайниците.
Сулфадиазин Близък е по структура и антимикробна активност до сулфадимидин. В сравнение с него се резорбира в по-малка степен и се излъчва за приблизително същото време. Разпределението му в организма е малко по-слабо от сулфадимидин. Метаболизира предимно чрез ацетилиране. Дразни слабо. Намира приложение предимно в комбинация с триметоприм за лечение на бактериални инфекции и кокцидиоза при пилета и зайци.
Сулфамеразин Притежава качества близки до тези на сулфадиазин. Резорбира се обаче по-бързо и по-пълно. Частично преминава през възпалените мозъчни обвивки. Излъчва се по-бавно. Токсичността му е ниска. Може да повлияе и заболявания предизвикани от колибактерии.
Сулфацетамид Като антибактериално средство не се отличава с особени качества. В организма не прониква в тъканите. Излъчва се за не повече от 6-8 часа след венозно приложение. Неговите разтвори имат рН близко до неутралното, което позволява конюнктивалното му приложение и в сравнително високи концентрации. Намира приложение в очната практика.
Сулфахлорпиразин натрий монохидрат Резорбира се сравнително бързо и пълно при вътрешно въвеждане на птици. Максимални нива се достигат в рамките на два часа след третирането. Задържа се в рамките на 24 часа. Проникващата му способност в тъканите е сравнително слаба. Метаболизира слабо. Има данни за ацетилиране. Проявява мощен антикокцидиен ефект. Прилага се предимно като антикокцидийно средство при птици и зайци.
Сулфахлорпиридазин Той има най-високa активност спрямо Gr_ микроорганизми. Резорбира се бързо и се излъчва бързо, като осигурява терапевтични нива не повече от 6 часа. Има сравнително слабо проникване в тъканите. Прилага се предимно като антибактериално средство самостоятелно и в комбинация с триметоприм.
Сулфадоксин Широкоспектърен сулфонамид, осигуряващ в комбинация с триметоприм до 24 часа терапевтични нива. Резорбира се сравнително бързо след мускулно въвеждане и се разпределя в терапевтични концентрации в тъканите. Намира приложение в комбинация с триметоприм.
Сулфаквиноксалин Представлява мощно средство с антикокцидийно действие спрямо eймерии, причиняващи кокцидиоза при пилета и пуйки. Резорбира се във висок процент след вътрешно приложение при домашни птици и осигурява минимум 24 часа терапевтични нива в организма им. По отношение неговият метаболизъм съществуват противоречия. Претърпява ацетилиране и в известна степен дезацетилиране. При пилета се излъчва дълго време– повече от 4 дни.
Сулфаметоксазол Резорбира се и се излъчва сравнително бързо, както при вътрешно така и при мускулно въвеждане. При мускулно въвеждане натриевата му сол не дразни. Разпределя се сравнително равномерно. Метаболизира предимно до ацетилирани продукти. Намира приложение в комбинация с триметоприм.
Сулфонамиди с удължено действие
Сулфадиметоксин Влияе върху значителен брой Gr+ и Gr_ микpоорганизми (коки, колибактерии, салмонели, листерии), както и върху кокцидии. Въведен вътрешно се задържа в терапевтични концентрации в продължение на 24 часа.
Сулфаметоксидиазин Притежава подобен на предходния антибактериален спектър. В организма се задържа по-дълго от 24 часа. Проявил е относително висока токсичност.
Сулфапиразол Слабо токсичен. Активен е срещу широк спектър микроорганизми, включително листерии, пастьорели, салмонели, както и върху кокцидии. Резорбира се бързо и се задържа в рамките на 48 часа. Характерно е високото му ниво в жлъчката.
Сулфаметопиразин, сулфален Притежава антимикробен ефект подобен на предходните. Резорбира се бързо и се задържа в организма по-дълго от 48 часа. Има ниска токсичност
Трудно резорбируеми сулфонамиди
Сулфагванидин Влияе върху колибактерии, възбудители на дизентерия, салмонели и кокцидии. При вътрешно въвеждане се резорбира в незначителни количества при здрави животни, но при възпаление на храносмилателния канал, дехидратация и др. може да бъде резорбиран и да създаде ниски концентрации в кръвта. Резорбираният сулфагванидин бива частично ацетилиран. В бъбреците лесно създава кристалурия. Проявява странични действия като хиповитаминоза В и К.
Фталилсулфатиазол Има по-ниска резорбция от сулфагванидин. Намира приложение за лечение на заболявания на храносмилателния канал, причинени от чувствителни микроорганизми и за постоперативно третиране при операции на червата.
Потенцирани сулфонамиди
Комбинирането на сулфонамидите с представители от групата пиримидинови производни, предимно триметоприм, реално направи тяхното приложение във ветеринарномедицинската практика актуално. Комбинациите на различни сулфонамиди с триметоприм, орметоприм, адитоприм и др. носят наименованието потенцирани сулфонамиди. Те имат качеството да повлияват микроорганизми в значително по-ниски (до няколко пъти)от минималните подтискащи концентрации спрямо редица микроорганизми, при проявен разширен антибактериален спектър. Това позволява значително понижаване дозите, които оказват терапевтичен ефект в сравнение със самостоятелното прилагане. Най-често използваното количествено съотношение сулфонамид/триметоприм в комбинациите е 5/1, но са използвани и комбинации в съотношение 2,5/1. Тези съотношения осигуряват в организма концентрации в съотношение 20/1 - 40/1, които гарантират максимална антибактериална активност.
Механизъм на антимикробна активност Триметопримът и неговите диаминопиримидинови аналози блокират синтеза на тетрахидрофолиева киселнна от дихидрофолиевата, като инхибират ензима дихидрофолредуктаза. По този начин, в сравнение със сулфонамидите, се осъществява спиране на синтезата на протени в следващо звено, от нормалния микробиален метаболизъм. Действието на комбинацията със сулфонамидите се явява качествено ново и различно от действието на двете и компоненти поотделно. Първо триметоприм и неговите аналози повлияват предимно Gr_ микроорганизми. Това означава, че със сулфонамидите те взаимно допълват антибактериалния си спектър. Получава се комбинация с общ широк спектър. Тя проявява не бактериостатична активност, а бактерицидна. Диаминопиримидините инхибират преференциално бактериалната дихидрофолат-редуктаза без да повлияват значително този ензим на висши животни.
Фармакокинетика От диаминопиримидините най-често прилаган е триметоприм. Той е липоразтворима слаба основа, която се разпределя в много тъкани на организма, като по-високи концентрации могат да се наблюдават в тъкани с по-ясно изразен ацидитет от плазмата. Всъщност неговата резорбция и цялостно поведение в храносмилателния канал са базирани на тази разлика. Задържа се във високи концентрации в търбуха на преживните животни. Разпределението му в тъканите е във висока степен. Метаболизира се чрез окисление и конюгация предимно в черния дроб, както и в предстомашията на преживни. Както субстанцията триметоприм така и метаболита му се излъчват чрез бъбреците, където се установяват във високи концентрации. Задържането му в организма на преживни животни е краткотрайно. При животни с еднокамерен стомах и особено месоядни задържането на триметоприм е значително по-дълго, което позволява да бъде прилаган съвместно със сулфонамиди със средна продължителност и да осигурява необходимото съотношение в кръвта за оптимален антимикробен ефект. Адитоприм е показал някои качества във фармакокинетичен аспект, които го правят перспективен, като високият обем на разпределение, дългият биологичен полуживот при преживни и по-доброто проникване в тъканите. В практиката диаминопиримидините са използвани кратко и без особен успех самостоятелно поради ограниченият им спектър на действие и бързото развитие на резистентност. Ето защо те намират приложение преди всичко като съставки на комбинации с вече споменатите сулфонамиди.
5.2. Нитрофуранови производни
Нитрофурановите производни (нитрофуразон, нитрофурантоин и фуразолидон) имат широк антибактериален спектър. Те са високо токсични, което ограничава възможностите на тяхното приложение до лечение на локални инфекции, инфекции на храносмилателния канал и уроинфекции. Те притежават силно проявен мутагенен, геннотоксичен и карциногенен ефект. Наличието на тези потенциални странични въздействия са довели до забраната на приложението на нитрофураните при животни, чиито продукти се използват за храна в страните на Европа и САЩ.
5.3. Нитроимидазолови производни (диметридазол, метронидазол, ронидазол, тинидазол, ипронидазол). Намират приложение във ветеринарната медицина преди всичко поради тяхната активност срещу анаероби. По спектър на действие са подобни на нитрофураните, но не влияят върху аеробни бактерии. Освен това метронидазол е използван при лечението на Trichomonas foetus. Поради потенциалния им канцерогенен ефект, нитроимидизолите не се използват върху животни, продуциращи хранителни продукти в много страни включително и България.
5.4. Нитротиазолови производни (аминонитротиазол, аминитразол, нитиазид) проявяват предимно антипротозоен ефект срещу причинителя на черноглавка Histomonas meleagridis при пуйки.
5.5. Хинолони
Хинолоните по подобие на сулфонамидите и нитрофураните са синтетични съединения. Те са и най-новата група антимикробни средства, приложени в клиниката преди 30 години. Представляват съединения, производни на налидиксовата киселина и могат да бъдат класифицирани в следните групи (поколения), разрешени за приложение във ветеринарната медицина:

Флуорираните хинолони се проявяват като субстанции с антимикробна активност, имащи редица предимства пред останалите използвани антибактериални средства. Те се изразяват в бързия им бактерициден ефект срещу голям брой важни за клиниката микроорганизми, добрата поносимост от страна на животните и това, че могат да бъдат прилагани по различни начини (включително с храната и водата за пиене). От големия брой флуорохинолони, разрешени за приложение във ветеринарната медицина са енрофлоксацин, дифлоксацин, орбифлоксацин, (за кучета и котки), енрофлоксацин, данофлоксацин, сарафлоксацин, марбофлоксацин при селскостопански животни. Основната структура на всички флуорохинолони е еднаква. Различията между тях са в страничните им вериги, които определят особеностите в техните физикохимични характеристики и фармакокинетика. По-слабо влияят върху антибактериалния им спектър.
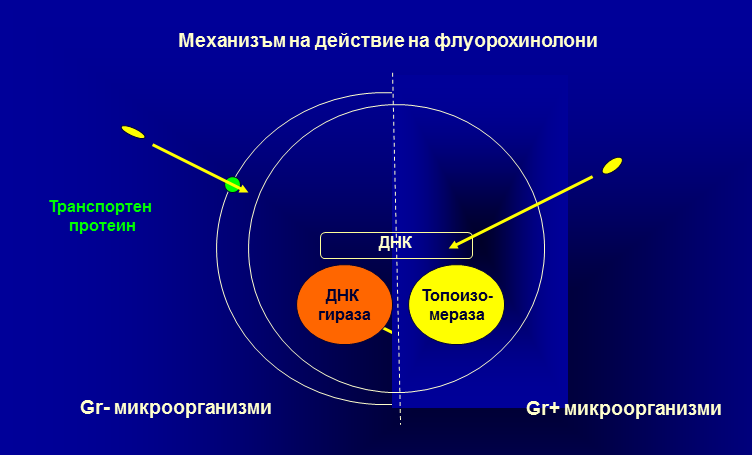
Механизъм на антибактериално действие Проявяват бактерициден ефект поради потискане репликацията и транскрибцията на ДНК на микроорганизмите. В клетките на микроорганизмите съществува ензим, наречен ДНК-гираза (наричана още топоизомераза имаща две субединици А и В или І и ІІ), който осъществява двойната спирализация на ДНК. Флуорохинолоните блокират активността на топоизомераза А и по този начин нарушават двойната спирализация на ДНК на микроорганизмите. В клетките на бозайниците съществува топоизомераза II, която се повлиява от хинолони в концентрации 100-1000 μg/ml. Поради това те са значително по-устойчиви в сравнение с микробиалните. За чувствителни се смятат микроорганизми, повлиявани от концентрации ≤ 0,1-10 μg/ml. Част от флуорохинолоните повлияват и топоизомераза ІV, която има високо значение за някои Gr+ микроорганизми като стафилококи и стрептококи. Някои от най-новите флуорохинолони повлияват както топоизомераза ІІ така и ІV, което е в основата на разширения им антибактериален спектър.
Антибактериалната активност на хинолоните е насочена спрямо повечето Gr_ микроорганизми – Enterobacteriacea, E. coli, Klebsiella spp., Proteus, Salmonella spp. По-ниска чувствителност са показали някои представители на Pseudomonas aeruginosa, но чувствителните имат по-високи минимални инхибиращи концентрации (MIC) от останалите чувствителни микроорганизми. Чувствителността на Gr+ организми е различна. Чувствителни са стафилококи, но за тях MIC са обикновено по-високи в сравнение с тези спрямо Gr_. Предимствата пред други антибактериални средства спрямо стрептококи са под въпрос. Резистентността се получава по три основни пътища – намален пермеабилитет от страна на бактериалната стена, увеличен ефлукс от страна на транспортните гликопротеини, мутации в ДНК-гиразата. Обикновено резистентността се получава бавно, но е относително трайна. Кръстосана резистентност между отделните субстанции също се наблюдава.
Фармакокинетиката на флуорохинолоните при бозайници и птици не е твърде разнообразна и е характерна с близки стойности на параметрите на различните представители. Общото при тях е и това, че и при енрофлоксацин (с най-къс биологичен полуживот) и при марбофлоксацин (с най-дълъг) се препоръчва еднократно дозиране на 24 часа, но в различни дози. Най-общо казано флуорохинолоните осигуряват в тъканите концентрации, равни на кръвните с изключение на централната нервна система и очните тъкани и течности. Флуорохинолоните се резорбират в дуоденума и йеюнума. Степента на резорбцията им варира в тесни граници в зависимост от вида и възрастта на животните, както и от спецификата на химичната структура. След вътрешно приложение бионаличността варира между 56-57% и 90-91%. Времето за достигане на максимални концентрации в кръвта варира между 15 минути и 5 часа. Това означава че флуорохинолоните имат сравнително бърза и висока степен на резорбция от храносмилателния канал. Тя не се повлиява значително от степента на нахраненост. След приложение в храната може да покажат по-ниска или удължена резорбция, но повлияването на степента и е слабо. Поради това те се прилагат по различни способи и лекарствени форми вътрешно. Оралната резорбция при свине, кучета, котки доближава 100%. При тревопасни тя е по-слаба. Характерно е варирането и при коне. При преживни също са публикувани твърде различни стойности – от 10% при телета до 61% при овце. При различни видове птици също е установена висока степен на резорбция - между 60 и 90%. Като бактерицидни антибактериални средства флуорохинолоните са зависими от стойностите на Cmax/MIC > 10-12 или от AUC/MIC > 125. Превишаването на дозата може да доведе до редуциране процента на резорбция. След мускулно и подкожно въвеждане хинолоните практически се резорбират пълно. Известно забавяне на резорбцията може да се получи след подкожно въвеждане, в зависимост от мястото на въвеждане и от характера на лекарствената форма. Забавената резорбция от мястото на инжектирането може да бъде резултат от забавено освобождаване, причинено от свързване с тъканите или тъканни нарушения. Разпределят се във висока степен в тъканите включително и вътреклетъчно. Смята се, че флуорохинолоните са достатъчно разтворими в липиди или са подчинени на активен транспорт, за да проникват в клетките. Концентрациите им в макрофаги и неутрофили са 4-10 пъти по-високи от плазмените, а в кучешки макрофаги – 10 пъти. Ефлуксът им от тези клетки е бавен. Метаболизмът на различните субстанции е специфичен. Най-добре е изучено метаболизирането на енрофлоксацин. Основният резултат от неговата трансформация в организма е метаболита му ципрофлоксацин, който е с висока антибактериална активност. При бозайници процентът на метаболизирания до ципрофлоксацин на енрофлоксацин е 10-30% (кучета, котки, говеда, свине). При птици (кокошки и пуйки) е по-малък от 10%. При рептилии - около 2%. Различните представители на тази група имат свои основни специфични метаболити. Пефлоксацин се метаболизира до норфлоксацин, енрофлоксацин – до ципрофлоксацин, дифлоксацин – до сарафлоксацин, марбофлоксацин – до N-дезметил-марбофлоксацин. Флуорохинолоните са екскретирани предимно от бъбреците чрез гломерулна филтрация и тубуларна екскреция. Малка част се отделя чрез чревното съдържание – около 5%. Концентрациите в урината обикновено са няколко пъти по-високи от плазмените (от порядъка на 40-85 µg/ml) Изключение прави дифлоксацин, който се излъчва до 80% с чревното съдържание и по-малко от 5% с урината.
Разрешени за употреба във ветеринарната медицина хинолони
|
Наименование |
Говеда |
Свине |
Пилета |
Пуйки |
Кучета |
|
Енрофлоксацин |
Х |
Х |
Х |
Х |
Х |
|
Данофлохасин |
Х |
Х |
Х |
|
|
|
Норфлоксацин |
|
|
Х |
Х |
|
|
Офлоксацин |
|
|
Х |
Х |
|
|
Ципрофлоксацин |
|
Х |
Х |
|
|
|
Сарафлоксацин |
|
|
Х |
Х |
|
|
Орбифлоксацин |
Х |
Х |
|
|
Х |
|
Марбофлоксацин |
Х |
Х |
|
|
Х |
|
Дифлоксацин |
|
Х |
Х |
Х |
Х |
|
Флумеквин |
Х |
Х |
Х |
|
|
|
Оксолинова киселина |
|
Х |
Х |
Х |
Х |
6. Бета-лактамни антибиотици
Механизъм на действие Голямата група на бета-лактамните антибиотици включва естествените и полусинтетични пеницилини и цефалоспорини, синтетичните карбапенеми и монобактами, които имат един механизъм на антимикробно действие. Те са бактерицидни антибиотици, проявяващи своя ефект чрез блокиране изграждането на стената на бактериалните тела. Те се свързват с т.н. пеницилин-свързващи се протеини на микроорганизмите, които се включват в крайния стадий на изграждането на клетъчната стена. Основна роля играе бета-лактамният пръстен в тяхната молекула, който е структурен аналог на крайния пептиден мост, който свързва пептидогликанните вериги, изграждащи стената на бактериалните клетки. Така блокирайки този процес на свързване бета-лактамите пречат за изграждането на бактериалната клетъчна стена. Различните микроорганизми притежават различни пеницилин-свързващи протеини, което определя афинитета към различните представители на групата и от там различният им антимикробен спектър. Свързването на бета-лактамите с пеницилин-свързващи протеини води до формиране на дефекти в стената, които са осмотично нестабилни и правят бактериите лесно уязвими. Унищожаването на бактериалните клетки е резултат обикновено от бактериална автолиза. Бета-лактамните антибиотици проявяват постантибиотичен ефект спрямо Gr+ микроорганизми, но не и спрямо Gr_.
Резистентност Най-общо бактериалната чувствителност към бета-лактамните антибиотици се определя от три основни фактора: пермеабилитета на бактериалните клетки, афинитета на пеницилин-свързващите протеини и от друга страна продукцията на бета-лактамаза. Възможността за продукция на бета-лактамаза е основният фактор на резистентност от страна на микроорганизмите. Продуцираната от микроорганизмите бета-лактамаза е от различен вид. Част от бета-лактамазите са активни спрямо пеницилини (пеницилинази), друга част спрямо цефалоспорини (цефалоспоринази), а трета част и към двете групи антибиотици. Налице са два механизма за бета-лактамазна продукция – на хромозомна и плазмидна основа. Хромозомно основаните бета-лактамази са видово и родово специфични и се индуцират от присъствие на съответните антибиотични субстанции. Плазмидните се пренасят между бактериите и могат да увеличат резистентността към антибиотиците. Част от новите антибиотици притежават увеличена устойчивост спрямо бета-лактамазите, което им осигурява висока активност спрямо продуциращите ги микроорганизми. Gr_ микроорганизми притежават стена, която е значително по-устойчива спрямо антибиотиците и те са по-слабо активни спрямо тях.
Основни групи бета-лактамни антибиотици
Пеницилини
Общи фармакологични данни Първият пеницилин, който е в основата на почти всички останали е бензилпеницилин или пеницилин g. Молекулата му е изградена от беталактамен и тиазолидинов пръстени, образуващи т.н. 6-аминопенициланова киселина и свързаните с нея странични радикали. Важна роля играе ациловият радикал, който определя различните свойства на формираните структури. Основен път за разрушаване структурата на пеницилин и някои негови производни е хидролизирането, което е особено значимо в храносмилателния канал, поради това, че прави тези антибиотици неефективни при вътрешно въвеждане. Пеницилин се явява несъвместим със сулфонамиди, йони на тежки метални, окисляващи агенти и алкохол. Налице са различни класификации на пеницилините. Една от тях има следната структура:

Основни групи и представители на пеницилините
*Инхибиторите на бета-лактамазата са разгледани при “Други бета-лактамни антибиотици”
Чувствителност на микроорганизмите към пеницилини Представителите на трите групи пеницилини имат различен спектър на антимикробна активност. Естествените пеницилини са активни спрямо повечето стрептококи и непродуциращи пеницилиназа стафилококи. Проявяват активност спрямо Gr_ бацили, Corynebacterium, Listeria monocytogenes, Pasteurella multocida, Haemophilus influenzae. Активни са и срещу голям брой Gr+ и Gr_ анаеробни бактерии, както и срещу повечето спирохети, включително лептоспири и борелии. Резистентните щамове принадлежат на Pseudomonas spp, Enterobacteriacea и продуциращи пеницилиназа стафилококи. Антибиотиците, проявяващи резистентност спрямо пеницилиназа, повлияват по-силно продуциращите пеницилиназа стафилококи в сравнение с естествените пеницилини. По принцип обаче те са по-слабо активни спрямо останалите микроорганизми в сравнение с другите пеницилини. Аминопеницилините са активни освен спрямо чувствителните на естествените пеницилини микроорганизми и спрямо щамове E. coli, Proteus mirabilis, Salmonella spp. Не са активни спрямо пеницилиназа-продуциращи стафилококи и псеудомонаси. Пеницилините с разширен спектър са най-активни от всички пеницилини предимно върху Gr_ анаероби и аероби, много щамове на ентеробактериацеа и псевдомонаси. В същото време те са по-слабо активни от останалите пеницилини спрямо традиционно чувствителните към тях микроорганизми.
Фармакокинетика Калиевите и натриеви соли на пеницилин се резорбират сравнително бързо след тяхното подкожно или мускулно въвеждане като водни суспензии и разтвори. Максимални нива се установяват 15-30 минути след инжектирането и се задържат не повече от 6 часа. Опитите за удължаване на престоя им в организма чрез включване в маслени емулсии или суспензии в повечето случаи не са успешни. Приложението на прокаин пеницилин като буферирана водна суспензия (не се разтваря във вода) осигурява удължена резорбция и задържане в продължение на 24 часа, а на бензатин-пеницилин – в продължение на 6-7 дни, но в много ниски концентрации. Трите вида соли се прилагат съвместно и осигуряват бърз и продължителен терапевтичен ефект след еднократно третиране. Прокаиновата сол не се прилага венозно (уврежда сърдечната дейност) особено при коне преди състезание. Вътрешното въвеждане на пеницилин G не води до терапевтични нива поради неговото разграждане в киселата среда на стомашното съдържание. Интрамамарното му въвеждане има за резултат ниски кръвни нива. За разлика от него феноксиметилпеницилин проявява киселиноустойчивост и след вътрешно въвеждане се резорбира в рамките на 30-40% и осигурява терапевтични нива в рамките на 6 часа в зависимост от дозата. Максимални нива се установяват при моногастрични в рамките на 30 минути до 1 час. Резорбцията му при вътрешно въвеждане на пилета се влияе от възрастта, като по-възрастните птици излъчват по-бързо антибиотика. Разпределението на естествените пеницилини е бързо и продължава докато концентрацията на несвързаната с протеини плазмена фракция превишава тъканната и на тъканните течности. Високи концентрации се достигат в бъбреците, черния дроб и белите дробове. Преминават през плацентата, но слабо през невъзпалената кръвномозъчна бариера. Нивата на феноксиметилпеницилин в слюнката са ниски. Естествените пеницилини, както и полусинтетичните производни метаболизират слабо в организма и техните метаболити са неактивни. Пеницилините и техните метаболити се излъчват предимно чрез тубулна екскреция в бъбреците. Феноксиметилпеницилин се излъчва в рамките на 37-43% през първите 10 часа след въвеждането му. Високи нива се измерват и в жлъчката, което говори и за значимостта на този път на елиминиране, който е предпоставка за ентерохепатален кръговрат. При лактиращи животни елиминацията с млякото също има значение. Предвид алергизацията на хора наличието на остатъчни вещества в храни от животински продукти (месо, мляко и яйца) може да се окаже фатално за консуматора. Полусинтетичните пеницилиназо-резистентни пеницилини, с изключение на метицилин, който се разрушава от киселата среда на стомаха, имат сравнително по-висока степен на резорбция от пеницилин G. Те не осигуряват високи терапевтични нива за достатъчно дълго време, поради което е предпочитан парентерален път на въвеждането им. Във ветеринарната медицина има значение предимно тяхното интрамамарно въвеждане (особено на оксацилин и клоксацилин).
Аминопеницилините имат предимството да се резорбират от храносмилателния канал на животни с еднокамерен стомах и при млади преживни, с недостатъчно развити предстомашия. Този процент варира от 30% за ампицилин до 55-60% за амоксицилин. Амоксицилин притежава до два пъти по-висока резорбция в храносмилателния канал от ампицилин, което го прави предпочитан. Висока резорбция на амоксицилин се наблюдава и при руминантни (отбити) телета и агнета след суспензиране в мляко или вода и прилагане с бутилка. Разпределението на полусинтетичните аминопеницилини е подобно на това на пеницилин G, но те се излъчват по-дълго време, поради което се допускат до 12-часови интервали при тяхното приложение, характерно най-вече за амоксицилин.
Пеницилините с разширен спектър имат някои предимства пред останалите предвид повлияването им върху микрооганизми, като Pseudomonas и Proteus и други Gr_ микроорганизми, показали традиционна резистентност спрямо редица антибиотици.
Съществува известно противоречие относно киселинната устойчивост на карбеницилин, но по-вярно е твърдението, че той не се резорбира, но и не се разрушава в храносмилателния канал, където по подобие на аминогликозидите проявява антибактериален ефект и се излъчва с чревното съдържание. Парентералното му въвеждане осигурява системен ефект, тъй като се резорбира бързо от мястото на приложение, има слаба разпределителна способност и се излъчва почти непроменен чрез бъбреците. Подобна е фармакокинетиката на тикарцилин и мезлоцилин, които се прилагат почти само парентерално.
Токсичност Пеницилините са нискотоксични субстанции. Тяхното приложение обикновено е свързано с появата на малко странични въздействия. Най-ясно изразената реакция е на базата на остра алергия при хора. Анафилаксия, колапс, повръщане, треска, еозинофилия, неутропения, агранулоцитоза, левкопения, тромбоцитопения, анемия може да бъдат наблюдавани при чувствителни животни. Зайци и морски свинчета са чувствителни спрямо пеницилини поради нарушения в състава на микрофлората на храносмилателния канал. Зайци, морски свинчета, птици, змии са чувствителни към прокаин пеницилин.
Цефалоспорини
Общи фармакологични данни Цефалоспорините са полусинтетични антибиотици, деривати на цефалоспорин С, който се продуцира от гъбичките Cefalosporum acremonium. Всички истински цефалоспорини съдържат ядро на 7-аминоцефалоспорановата киселина, съдържаща 6-членен дихидротиазинов пръстен, свързан с 4-членен β-лактамен пръстен. Този пръстен е съществен за антибактериалната активност на цялата група антибиотици. Той е характерен и за други класове антибиотици (пеницилини, карбапенеми, моно-бактами). Заместването на радикалите на R7 и R3 места с различни атомни групи води до синтезата на голям брой съединения. Наличието на различни странични радикали формира производни с различна антибактериална активност, стабилност към бета-лактамазата, токсичност, фармакокинетика (най-често резорбция от храносмилателния канал и метаболизъм). Цефалоспорините притежават бактерициден тип на активност, подобна на другите β-лактами. Те нарушават синтезата на бактериалната стена, свързват се с пеницилин-свързващи протеини, локализирани във вътрешната част на бактериалната стена. Те са ензими, включвани в различни етапи от синтезата и. Цефалоспорините са активни срещу голям брой Gr+ аеробни бактерии, някои Gr_ аеробни, както и някои анаеробни бактерии. В това отношение в зависимост от структурата си, всеки антибиотик има уникален антибактериален спектър. Спрямо вируси и гъбички цефалоспорините са неактивни.
Класификация на цефалоспорините Въз основа на спектъра на активност, степента на резорбция и други качества, цефалоспорините са разделени на четири групи (поколения): първо, второ, трето и четвърто. От гледна точка на клиничното им приложение, цефалоспорините се класифицират в 4 групи, имащи тесен, “среден”, широк и разширен спектър. Цефалоспорините от първо поколение са активни спрямо Gr+ патогенни коки, включително продуциращи пеницилиназа стафилококи, бета-хемолитични стрептококи и ограничена активност спрямо Gr_ бактерии E. coli, Proteus mirabilis и Klebsiella spp. По спектър на активност те са близки до аминопеницилините. Цефалоспорините от второ поколение са активни спрямо микроорганизми, чувствителни към тези от първо поколение. Те обаче са по-активни спрямо Gr_. Проявяват активност спрямо щамове на Enterobacter, E. coli, Haemophilus influenzae, клебсиели, протеус и др. От тази група цефуроксим има известна стабилност спрямо бета-лактамазата. Представителите на трето поколение имат повишена активност спрямо Gr_ микроорганизми, обикновено резистентни към антибиотици от първо и второ поколение, при запазена активност спрямо Gr+ бактерии. Притежават освен това по-висока хидролитична стабилност към повече от β-лактамазите, които разграждат представителите на предходните групи. В обсега на активността им се включват щамове на Enterobacter, E. coli, Klebsiella, Proteus, Seratia. Повечето от тях са активни и спрямо Pseudomonas spp. Четвърто поколение цефалоспорини имат по-широк антибактериален спектър в сравнение с трето поколение, особено спрямо Gr_ микроорганизми. Имат по-добра проникваща способност. Обикновено метицилин-резистентни стафилококи и ентерококи са резистентни спрямо цефалоспорини.
Фармакокинетика След венозно приложение цефалоспорините показват дву-пространствен модел. Мускулното и подкожно инжектиране има за резултат бързата им резорбция. Нейната степен зависи от вида на антибиотика и животните. Резорбцията след вътрешно въвеждане е в значителна степен вариабилна и освен от характеристиката на цефалоспорините и третираните животни, зависи и от възрастта, напълването на стомаха и др. Разпределението им в организма осигурява високи концентрации освен в кръвта, в телесните течности (плеврална, перитонеална, синовиална), костен мозък, както и в урина и жлъчка. Въпреки, че повечето от представителите не преминават кръвно-мозъчната бариера, при менингит част от тях (цефотаксим, цефотриаксон и др.) осигуряват високи нива в цереброспиналната течност. Различните представители имат различен процент на свързване с протеините, което дава отражение върху елиминацията им. Основен път за елиминиране е чрез бъбреците, в повечето случаи непроменени. Изключение правят само малка част от тях (например цефалотин, цефотаксим, цефаприм), които биват ацетилирани. Цефоперазон и цефотриаксон се излъчват предимно с жлъчката. По отношение токсичността им, цефалоспорините имат превъзходства в сравнение с другите антибиотици. След мускулното им въвеждане е наблюдавана болка, стерилни абсцеси, а след венозно – тромбофлебит, ламинит при коне и др. Оралното им приложение може да е последвано от повръщане и диария. Чувствителните към пеницилини хора обикновено са алергични и към цефалоспорините. При домашни животни наличие на алергичност не е познато. Приложението на цефалоспорини във ветеринарната медицина в България е ограничено. Следващата таблица представя някои от цефалоспорините, използвани в хуманната и ветеринарна медицина.
Класификация на цефалоспорините

*Предназначени за ветеринарномедицинска употреба,** вкл. продуктивни животни.
Други бета-лактамни антибиотици
Клавуланова киселина подобно на пеницилини и цефалоспорини притежава, бета-лактамен пръстен и може да се включи в структурата на бета-лактамазите. По този начин тя има способността да елиминира активността на ензимите и да прекрати и предпази от разрушаване на съвместно приложени пеницилини. В същото време тя има минимална антибактериална активност, без реално терапевтично значение. Разпространена е лекарствена комбинация между амоксицилин и клавуланова киселина в съотношение 4:1, предназначена за вътрешно приложение. Тази комбинация се резорбира бързо и пълно от храносмилателния канал. Двете съставки се разпределят добре в тъканите, тъканните течности и кожата, и проявяват разширен спектър на антимикробно действие. Подобна е комбинацията между тикарцилин и клавуланова киселина, но поради това, че тикарцилин не се резорбира от храносмилателния канал, тя се прилага венозно.
Сулбактам е сулфон на пеницилановата киселина и като клавулановата киселина има слаба антимикробна активност. Тази субстанция е стабилна химически и инхибира активността на бета-лактамазите, което я прави повишаваща активността на бета-лактамни антибиотици срещу продуциращи съответните ензими микроорганизми. Позната е комбинацията от ампицилин и сулбактам, която притежава разширен спектър на активност по отношение на иначе резистентните към пеницилин щамове на пастьорели, хемофилус, и стафилококи.
Карбапенеми и монобактами са сравнително нови, синтетични съединения с близка до пеницилините характеристика, въпреки че като структура са различни. Представител на първата група е имипенем, на втората – азтреонам. Не са достатъчно изследвани при животни.
7. Аминогликозиди и аминоциклитоли
Аминогликозидите се използват предимно за лечение и профилактика на инфекции, предизвикани от чувствителни аеробни Gr_ бактерии. Това ги прави важна група в избора на лекарствено средство от страна на ветеринарния лекар. Техен недостатък е малката им терапевтична ширина, поради което в терапевтични дози могат да предизвикат увреждания на бъбреците, кохлеата и вестибуларния апарат.
Химична структура и основни химични отнасяния
Представляват водоразтворими основи с характер на поликатийони в условията на телесното рН. Имат сходна структура помежду си. Състоят се от една или две бази, към които са свързани две или три аминозахари. Те са свързани с гликозидна връзка, откъдето идва и тяхното име. Базата на стрептомицин е стрептидин, а на останалите – 2-deoxystreptamine. Повечето от членовете на групата се различават по броя и характера на аминозахарите, свързани с нея.
Класификация на аминогликозидите и аминоциклитолите
Разделението на подгрупи не е така ясно както при пеницилините, но все пак в литературата е налице следното групиране: стрептомицинова подгрупа (стрептомицин и дихидрострептомицин); подгрупа на канамицин (канамицин, амикацин и тобрамицин); подгрупа на гентамицин (гентамицин и нетилмицин); неомицинова подгрупа (неомицин). Апрамицин принадлежи към група, определена като аминоциклитоли. Спектиномицин има своя специфична структура и значителни различия от другите аминогликозиди.
Механизъм на действие Аминогликозидите притежават бърза дозозависима бактерицидна активност спрямо чувствителните микроорганизми. За постигането на този ефект е необходимо антибиотиците да проникнат в бактериалните тела посредством оксидативен активен транспорт и пасивна дифузия. В анаеробни условия активният транспорт не се осъществява. Проникването на аминогликозидите се увеличава значително в присъствието на бета-лактами, които увреждат бактериалната стена. След попадането им в бактериалните тела аминогликозидите се свързват с рецепторите на 30S субединици на рибозомите, където предизвикват неправилно разчитане на генетичния код на транспортната РНК. Това означава неправилно подреждане на аминокиселините в пептидите и нарушаване синтеза на протеини в рибозомите. Лекарствените средства са най-активни спрямо размножаващи се микроорганизми. Степента и типа на “грешното разчитане” варират между отделните представители на групата, поради това че те взаимодействат с различни протеини. Друг механизъм на антибактериална активност е свързан с нарушаване на клетъчната транспортна система, което нарушава метаболизма на ДНК и клетъчните мембрани. Бактерицидният ефект се дължи и на изграждане на ненормални канали на клетъчните мембрани от “грешните” протеини.
Спектър на действие Антибактериалната активност на аминогликозидите е насочена предимно към аеробни Gr_ бактерии. Спрямо много Gr+ микроорганизми проявяват ограничена активност. Анаероби са резистентни. Все пак голям брой коагулазо-позитивни стафилококи са чувствителни към амикацин и гентамицин. Чувствителни се явяват някои микобактерии и микоплазми. По отношение на антибактериална потенция, спектър на активност и стабилност към ензими, включени в механизма на плазмидно медиираната резистентност, аминогликозидите могат да бъдат подредени в следния ред: амикацин>тобрамицин>гентамицин>канамицин=неомицин>стрептомицин. Микроорганизми, резистентни към даден антибиотик, са резистентни и към стоящите по-назад в реда. Съществува изключение, свързано с факта, че гентамицин е по-активен от амикацин спрямо представители actinobacillus spp , и Pasteurella spp. Докато амикацин има по-широк спектър на действие спрямо ентеробактерии, то микроорганизмите от същите видове, чувствителни към гентамицин имат от 2 до 4 пъти по-ниски MIC, така че гентамицин се явява по-мощен спрямо тях. Стрептомицин е най-активен спрямо микобактерии и най-слабо активен спрямо други микроорганизми в сравнение с останалите от групата. Бактерицидната активност на аминогликозидите върху аеробните Gr+ микроорганизми се повлиява от рН на средата, като те са по-активни в алкална среда. Понижението на рн на средата, породено от различни фактори, може да намали в значителна степен тяхната активност. Друг фактор, действащ в същата посока е наличието на гнойна маса. При хирургически интервенции нейното отстраняване повлиява положително резултата от антибактериална терапия с аминогликозиди.
Резистентност към аминогликозиди Най-важната за клиниката резис-тентност към аминогликозидите е провокирана от R-плазмиди и се изразява в активността на специфични ензими, класифицирани като фосфотрансферази, ацетилтрансферази и аденилтрансферази. Идентифицирани са най-малко 11 ензима, които имат способността да ги инактивират. Инактивирането става като биват променени хидроксилните и аминогрупите на антибиотиците, чрез които те се свързват с рибозомите. Поради това, че се намират в бактериите не е възможно екстрацелуларно инактивиране на лекарствата. Част от тези ензими предизвикват кръстосана резистентност на притежаващите ги микроорганизми спрямо повечето аминогликозиди. Щамове, притежаващи понижена пропускливост и респективно 2-4 пъти по-високи спрямо тях MIC може да бъдат селекционирани при третиране с аминогликозиди. Тези щамове показват кръстосана резистентност спрямо другите представители на групата. Хромозомни мутации, имащи за резултат резистентност, са относително важни освен за стрептомицин, при който се осъществява бързо даже по време на третирането, като резултат на едностъпкова мутация, водеща до високостепенна резистентност. Спрямо другите представители развитието на хромозомната резистентност е бавно, тъй като те имат много възможности за свързване с 30S рибозомни, свързващи пунктове, а стрептомицина има само един.
Фармакокинетика
След мускулно или подкожно въвеждане аминогликозидите се резорбират бързо и пълно от мястото на инжектирането им. Максималните концентрации след тези начини на въвеждане се получават в рамките на 30 минути. Те се резорбират в много ниска степен от храносмилателния канал при тяхното вътрешно въвеждане. При заболявания на храносмилателния канал обаче може да се очаква увеличена в значителна степен резорбция. За тях е характерна ниската степен на свързване с плазмените протеини (по-малко от 25%). Освен това преминават в много слаба степен тъканните и клетъчните бариери. Особено слабо е преминаването в черепномозъчната и окуларна течности. Има данни, че тобрамицин все пак осигурява по-високи нива в преднокамерната очна течност. Възпалителни процеси могат да увеличат проникването на аминогликозидите, но в слаба степен. Така описаната слаба проникваща способност на тази група антибиотици се обяснява с тяхната полярност и респективно ниска липоидоразтворимост. Налице е и избирателно свързване с кората на бъбреците, където аминогликозидите се откриват в изключително високи концентрации.
Аминогликозидите не метаболизират в организма или този процес е в много ниска степен, която не играе значима роля, както за неговото елиминиране така и по отношение на антибактериалната активност. Елиминацията им от кръвния ток е сравнително бърза и биологичният им полуживот варира при различните видове около 2 часа. Елиминирането им е почти изключително от страна на бъбреците – чрез гломерулна филтрация в непроменен вид. Нарушената бъбречна функция е причина за значително удължаване на задържането им в организма. Поради високите концентрации в бъбреците те често предизвикват дегенеративни промени. Освен това отделянето на антибиотиците от бъбречната тъкан е продължителен процес в рамките на 4 седмици. Това прави аминогликозидите едни от най-токсичните антибиотици. Сравнително ниски концентрации от аминогликозиди могат да бъдат установени и в жлъчката, което показва че макар и в по-слаба степен излъчването им по този път съществува. Концентрациите им в мляко, слъзни или слюнчени секрети са много ниски. Вътрешно въведените аминогликозиди се излъчват с чревното съдържание, като в храносмилателния канал те не претърпяват изменения или инактивиране. Налице е индивидуална специфика в отношението на отделни животни към тях, което създава възможност и за ясна индивидуална чувствителност от индивиди, принадлежащи към един вид. При анализиране поведението на аминогликозидите се установява, че то се характеризира най-често с три фази в изменението на кръвните концентрации с времето (означавани като a, b, g), отразяващи трите съставки на кривата която ги характеризира. a-фазата отразява, най-общо чрез съответнната стойност на полуживот, разпределението на антибиотиците. По същия начин b-фазата е илюстрация на класическата елиминация от кръвта, а g-фазата е свързана с освобождаването на тази част от антибиотика, концентрирана в кората на бъбреците и частично в черния дроб. Типична първа фаза се установява до 1-ия час след венозно въвеждане, втората продължава до 24 часа. Тя е използваемата при определяне дозата за клинично приложение. След това се явява третата фаза, продължаваща повече от 40 дни, която има значение преди всичко за определяне остатъчните вещества в организма на животни, чийто продукти подлежат на консумация. По подобен начин може да бъде интерпретирана и фармакокинетиката на повечето от останалите представители на групата. Едрите видове животни по принцип се нуждаят от относително по-ниски дози. В случаи на изчисление на дозите въз основа на телесната повърхност или на базисния метаболизъм (с коефициент 0,75) дозите при различните видове имат една и съща стойност.
Токсичност (нежелани ефекти)
Аминогликозидите могат да предизвикат четири типа дозозависими странични ефекти: нарушения в проксималните тубулни клетки на бъбреците; деструктивни изменения в сензорните клетки в кохлеата; деструкция в сензорните клетки на вестибуларния апарат; нервномускулна парализа.
Нефротоксичност. При високи концентрации и продължително задържане аминогликозидите предизвикват некроза в клетките на проксималните тубули. Те, особено тези които са поликатийонни като гентамицин и неомицин, преминават в клетките чрез пиноцитоза и имат способността да убиват клетките, водейки до остра интоксикация. Ако контактът с антибиотикат спре преди унищожението на клетките, токсичният ефект е напълно обратим. Токсикозата се установява по наличието на протеинурия и цилиндрурия.
Ототоксичност и влияние върху вестибуларния апарат. Аминогликозидите увреждат прогресивно сензорните клетки в кохлеата и вестибуларния апарат и може да се наблюдава загуба на слуха, вертиго, атаксия и загуба на равновесие. Унищожените сензори не се възстановяват, поради което увреждането може да бъде трайно. Тази токсичност зависи от площта под кривата на кръвните концентрации. Повишени концентрации, поради недиагностицирана бъбречна недостатъчност могат да се явят като предразполагащ фактор. Гентамицин и стрептомицин по-често предизвикват нарушение на вестибуларния апарат. Кохлеарните нарушения са по-често предизвикани от канамицин, амикацин и неомицин. Все пак при животни тези странични действия са рядко явление.
Нервномускулната парализа е резултат от блокиране движението на калциевите йони, необходими за освобождаването на ацетилхолин при деполяризацията. Провокира се от дози, малко по-високи от терапевтичните, или в терапевтични дози, ако предварително е използван миорелаксант. Най-често миорелаксация е наблюдавана след приложението на високи дози стрептомицин.
Някои рискови фактори, предразполагащи към токсикози, предизвикани от аминогликозиди са: възраст (възрастни и новородени индивиди), ацидоза, понижено ниво на натрий и калий, сепсис, бъбречна недостатъчност, предхождащо третиране с аминогликозиди, кумулиращи дози на аминогликозиди, чернодробни заболявания, анестезия с метоксифлуран, съвместно приложение с някои цефалоспорини, приложение на средства с проявена нефротоксичност.
|
Антибиотик |
Вестибуларен апарат |
Кохлеарен апарат |
Ренална токсичност |
Стрептомицин |
+++ |
++ |
+ |
|
Дихидрострептомицин |
++ |
+++ |
+ |
|
Неомицин |
+ |
+++ |
+++ |
|
Канамицин |
+ |
++ |
++ |
|
Амикацин |
+ |
+ |
++ |
|
Гентамицин |
++ |
+ |
++ |
|
Тобрамицин |
+ |
+ |
++ |
|
Апрамицин |
+ |
++ |
+++ |
|
Спектиномицин |
+ |
+ |
++ |
Относителен риск при използване на аминогликозиди и аминоциклитоли в терапевтични дози (по Prescott J., Baggot J., Walker R. Antimicr. Ther. in Vet. Med., 2000)
Представители
Аминогликозиди
Стрептомицин Получава се от Streptomyces globisporus streptomycini, както и от сродни микроорганизми. Прилага се като стрептомицинов сулфат. Антибиотичната му активност се проявява върху предимно Gr_ микроорганизми, но и върху някои Gr+, както и киселиноустойчиви бактерии. В антибактериалния му спектър влизат: коки, лептоспири, пастьорели, салмонели, шигели, бруцели, листерии, протеус, причинители на червенката, сапни бацили, туберкулозни бактерии, кампилобактерии и др. Познат е с бързо изграждащата се спрямо него резистентност, т.н. едностъпално придобиване, или резистентност от стрептомицинов тип. Често резистентността е кръстосана с други аминогликозиди. Притежава общите за групата отнасяния. Задържа се в кръвта след парентерално въвеждане в продължение на 10-12 часа в терапевтични концентрации (5-20 mg/l). Елиминира се почти напълно през бъбреците чрез гломерулна филтрация. Локално дразни. При венозно въвеждане може да причини хипотония и колапс, анафилактоидни реакции. При повторно въвеждане може да увреди VIII черепномозъчен нерв с последици засягане на вестибуларния апарат и слуха. Уврежда бъбреците. Дихидрострептомицин е производно на стрептомицин. Притежава близки до него свойства по отношение на антибактериална активност, фармакокинетика и отнасяния спрямо макроорганизма. Често се комбинират с пеницилин, при което се наблюдава синергичен антибактериален ефект. Не се комбинират с фениколи, тетрациклини и други бактериостатични антибактериални средства, с които имат най-често несъвместимост.
Неомицин Получава се от Actinomyces fradiae. Прилага се като сулфат. Притежава подобен на стрептомицин спектър, т.е. влияе предимно върху Gr_ микроорганизми но и върху някои Gr+ като стафилококи. След вътрешно приложение почти не се резорбира от храносмилателния канал. При мускулно въвеждане се резорбира бързо и в рамките на 1 час достига максимални нива в кръвния ток. Осигурява терапевтични нива в зависимост от дозата до 12 часа. Проявява висока токсичност, поради което се препоръчва предимно за локално приложение.
Канамицин Получава се от Actinomyces kanamyceticus. Прилага се като сулфат. Притежава по-широк спектър от стрептомицин. Влияе бактерицидно върху Escherichia coli, клебсиели, кампилобактерии, ентеробактерии, протеуси, салмонели, туберкулозни бактерии, стафилококи, псеудомонаси и др. Спрямо него резистентност се развива по-бавно и може да бъде кръстосана с други аминогликозиди. Резистентните спрямо стрептомицин микроорганизми може да бъдат чувствителни към канамицин. При вътрешно въвеждане практически не се резорбира. При мускулно въвеждане осигурява терапевтични нива в рамките на 8-10 часа в зависимост от дозата. Излъчва се сравнително бързо чрез гломерулна филтрация, но по подобие на другите аминогликозиди се задържа дълго време в тъканта на бъбреците. Токсичните му въздействия са подобни на предходните два антибиотика, но по-слабо проявени.
Гентамицин Получава се от Micromanospora purpurea. Всъщност представлява комплекс от три близки по структура и отнасяния съставки известни като С1, С1а и С2. Прилага е като водоразтворима сулфатна сол. Проявява бактерициден ефект върху широк спектър от Gr+ и Gr_ микроорганизми. Резистетност спрямо него изглежда се изгражда по-трудно и въпреки дългогодишното му приложение във ветеринарната медицина тя е относително малко разпространена и частично кръстосана. Съществуват много щамове резистентни на другите аминогликозиди, но чувствителни спрямо гентамицин. При вътрешно въвеждане се резорбира в ограничени количества и не може да осигури терапевтични нива в кръвния ток. При мускулно въвеждане се резорбира пълно и сравнително бързо, като в рамките на 45 минути – 1 час осигурява максимални кръвни концентрации, които се задържат в рамките на терапевтичните в продължение на 8-10 часа. Трудно преминава тъканните бариери, но при възпаления има по-добра проникваща способност. В млякото на лактиращи животни се открива в минимални концентрации.
Амикацин Представлява полусинтетичен антибиотик, получен от канамицин. Има антибактериален спектър подобен на гентамицин, но влияе и върху резистентни към другите аминогликозиди микроорганизми. Проявява по-ниска токсичност от гентамицин.
Тобрамицин Близък по структура и химични отнасяния до канамицин. Като антибактериален спектър е близък до гентамицин, като проявява по-висока активност спрямо отделни щамове. В същото време е показал по-добра проникваща способност в тъканите и по-слаба токсичност по отношение на бъбреците. Излъчва се както другите аминогликозиди.
Сизомицин, нетилмицин Близък до гентамицин. Все още намира приложение предимно в хуманната медицина и данните за животни са ограничени.
Аминоциклитоли
Апрамицин Представлява аминоциклитолов антибиотик, комплекс, известен като небрамицин, продуциран от Streptomyces tenebrarius. Прилага се като сулфат. Повлиява Gr+ и Gr_ микроорганизми, като по-отчетливо е повлияването на последните. По подобие на аминогликозидите действа бактерицидно срещу салмонели, пастьорели, Escherichia coli, щамове на псеудомонас, протеус, бордетела, микоплазми. Повлиява и стафилококи. Спрямо него по-трудно се изгражда резистентност, и това става сравнително бавно. Мненията относно кръстосана резистентност с аминогликозидите са различни, но все пак повече са доказателствата за липса на такава. Фармакокинетиката му е до голяма степен съответстваща на аминогликозидите, но има и своите особености. При вътрешно въвеждане се резорбира по-добре (до 10% от въведената доза), но недостатъчно, за да осигури терапевтични нива в кръвния ток и тъканите. Поради това този начин на въвеждане се прилага за лечение на заболявания на храносмилателния канал. При мускулно въвеждане се резорбира бързо и пълно и се задържа в кръвния ток в продължение на 8-12 часа в зависимост от вида, дозата и вида на заболяването. Прониква в тъканите по-добре от аминогликозидите. Не метаболизира и се излъчва непроменен почти 100% с урината при парентерално въвеждане. При вътрешно въвеждане по-голямата част се отделя с чревното съдържание. В жлъчката също се установяват високи концентрации. При лактиращи животни млякото го съдържа в субтерапевтични нива. Предназначен е само за ветеринарната медицина, предимно за лечение на колибацилоза, салмонелоза, както и за лечение на ентерити, предизвикани от други микроорганизми. Токсичен е за котки и не се прилага при тях.
Спектиномицин Продуцира се и се получава промишлено от Streptomyces flavopersicus. Прилага се като спектиномицин дихидрохлорид пентахидрат. Действието му е предимно бактериостатично (във високи концентрации може да бъде и бактерицидно) върху предимно Gr_ и по-малко срещу Gr+ микроорганизми. Повлиявани от него са салмонели, колибактерии, протеус, псеудомонас, пастьорели, диплококи, найсерии, клебсиели, хемофили, микоплазми, по-слабо кокцидии. Характерно за него е това, че активността му in vitro е слабо проявена и не съответства на истинската му активност in vivo. При вътрешно въвеждане се резорбира слабо – до 10%. Кинетиката му е близка до тази на апрамицин и аминогликозидите. Притежава ниска токсичност. Често се прилага в комбинации с антибиотици като: тилозин, линкомицин, еритромицин, тетрациклин и др. Прилага се при заболявания на храносмилателния канал и респираторната система.
Троспектомицин Полусинтетичен антибиотик, производeн на спектиномицин.
8. Тетрациклини
Тетрациклините са изолирани от различни видове на Streptomyces. От естествените представители са получени редица полусинтетични субстанции, имащи различна антимикробна активност и поведение в организма. По принцип представляват амфотерни субстанции, изградени от четиричленни пръстени, които се различават по мястото и състава на страничните радикали. Лесно образуват соли и се прилагат предимно като такива. Най-често използваните им соли са хидрохлориди. Използват се като терапевтични и профилактични средства в медицината и ветеринарната медицина.
Механизъм на антибактериално действие Притежават антимикробна активност, проявена чрез свързването с 30S рибозомни единици в телата на чувствителните микроорганизми. Блокират протеиновата синтеза на размножаващи се микроорганизми. Те имат много по-слабо проявен афинитет към рибозомите на бозайници, но все пак известно инхибиране може да се установи и при тях. В такива случаи се наблюдава катаболен ефект.
Антибактериален спектър Тетрациклините са първите описани антибиотици, които притежават класически широк спектър на антимикробна активност и бактериостатичен тип на действие. Повлияват Gr+ и Gr_ бактерии, включително анаероби. Активни са срещу хламидии, микоплазми, някои протозои, рикетсии, включително ерлихии. Активността на тетрациклините включва също Actinobacillus spp., Escherichia coli, Klebsiella spp., Pasteurella spp., Salmonella spp., щамове стафилококи и стрептококи
Резистентност По принцип спрямо тетрациклините резистентност се изгражда бавно. Описани са три различни механизми за изграждане на резистентност спрямо тетрациклините: активен ефлукс на антибиотика от микроорганизмите (активен механизъм на изхвърляне на антибиотика от тях); рибозомна протекция (свързване на рибозомите с протектиращи протеини); ензимна инактивация (наличие на производство на ензими, които инактивират антибиотика).
Фармакокинетика Тетрациклините може да бъдат прилагани венозно или мускулно. В практиката обаче, предпочитан начин на въвеждане е вътрешният поради това, че се избягват странични ефекти. Те се резорбират в различна степен от храносмилателния канал. Резорбцията на тетрациклин и окситетрациклин варира в широки граници в зависимост от животинския вид и лекарствените форми. Доксициклин се резорбира във висока степен. Имат продължителен биологичен полуживот (2-16 h), но осигуряват терапевтични концентрации не повече от 8-10 часа. Лесно се свързват с поливалентни катийони, които значително редуцират степента на резорбцията им. В този смисъл резорбцията на тетрациклини може да бъде редуцирана при съвместното приложение с калиеви, магнезиеви, железни, алуминиеви йони, антацидни средства, адсорбенти и др. Доксициклин е показал в значително по-ниска степен формиране на хелати с катийони и резорбцията му се повлиява в значително по-слаба степен Терапевтични дози, прилагани вътрешно не се препоръчват при преживни и коне, тъй като може да нарушат състава на микрофлората на храносмилателния канал. Обикновено биологичната наличност при вътрешно приложение на тетрациклин и окситетрациклин е между 5 и 23%, а на доксициклин – над 50%,. При животни с еднокамерен стомах стига до 90%. Резорбцията на широко използваните депо-форми за мускулно прилагане от мястото на инжектиране е неравномерна, като първите 48 минути се наблюдава бърза фаза (за около 18% от дозата) и след това в продължение на 18 часа – бавна (за 38%) при доза от 20 mg/kg.
Тетрациклините са липоидоразтворими съединения и като такива се разпределят много добре в тъканите. Доксициклин е най-добре разтворим в липиди и най-добре прониква. Разпределят се в сърцето, бъбреците, белите дробове, мускулите, плевралната течност, бронхиалния секрет, урината, синовията, асцитната течност, предната и задна очни камери. Малки количества тетрациклин и окситетрациклин се разпределят в централната нервна система, като терапевтични нива не се достигат. Миноциклин и доксициклин имат по-добра проникваща способност, включително и в централната нервна система. Тетрациклините преминават плацентарната бариера и попадат във феталната циркулация. Преминават и в млякото. Свързването им с протеини е между 20 и 67%. Тетрациклините претърпяват частична биотрансформация в организма на домашните животни. Метаболизмът на доксициклин е незначителен. Тетрациклин и окситетрациклин се елиминират предимно непроменени чрез гломерулна филтрация. Поради това при пациенти с нарушена бъбречна функция се наблюдава удължаване на биологичния полуживот и при многократни дози кумулират. Жлъчката също е важен път за отделянето на тези антибиотици от организма. Доксициклин се излъчва след преминаване в чревното съдържание по път различен от жлъчния в неактивна форма, и от там с чревното съдържание се изхвърля. Част от него е инактивирана чрез хелатообразуване в червата. По този път при кучета се излъчва около 75% от получения антибиотик. Реналната му екскреция е около 25% от дозата, чрез билиарна секреция се отделя по-малко от 5%. При телета се наблюдава подобна картина. Доксициклин не кумулира при пациенти с нарушена бъбречна функция.
Токсичност и контраиндикации.
От фармакологична гледна точка тетрациклините са относително сигурни лекарства. Страничните ефекти могат да бъдат свързани с техния дразнещ ефект (повръщане след вътрешно въвеждане, тъканни нарушения в мястото на инжектиране), с влиянието им върху интестиналната микрофлора, способността им да свързват калциевите йони (кардиовазкуларен ефект, депониране в костите и зъбите), и техния токсичен ефект върху чернодробните и бъбречни клетки. наблюдавана е също анафилаксия. След венозно въвеждане те могат да предизвикат колапс. Тетрациклините могат да предизвикат дозозависими функционални промени в реналните тубули на няколко вида. Тетрациклинпровокираната ренална токсикоза може да бъде изострена от дехидратация, хемоглобинурия, миоглобинурия, токсемия или наличие в организма на друго средство с нефротоксичност. Остро чернодробно увреждане може да бъде свързано с превишена доза, увредени бъбреци и удължено задържане на тетрациклини или късна бременност. При говедо високи дози са предизвикали мастна инфилтрация на черния дроб и некрози в проксималните ренални тубули. Поради това тетрациклините се прилагат при този вид в строго определени дози, за да се избегне нефротоксикозата. При коне най-честият токсичен ефект на тетрациклините е тяхната способност да предизвикат супресия на интестиналната микрофлора и суперинфекция. Резултатът може да бъде остър и често летален гастроентерит. Окситетрациклин, приложен мускулно дразни тъканите. Определени различия са установени в зависимост от лекарствената форма. Колкото по-силен е ефектът на дразнене, по-малка е бионаличността и по-голямо съдържанието на антибиотика, което се секвестира в мястото на инжектиране. Типичен пример за ясно дразнещи са лекарствените форми с депо-действие. във високи дози тетрациклините имат катаболен ефект и може да предизвикат азотемия.
Представители
Хлортетрациклин Първият открит и въведен в медицинската практика тетрациклинов антибиотик. В момента се използва рядко за лечение на инфекции, особено при дребни животни, но намира сравнително широко приложение като добавка във фуража на селскостопански животни, самостоятелно или в комбинации с други антимикробни средства (пеницилини, сулфонамиди, ампролиум, етопабат, монензин и др.). Фармакокинетиката му е аналогична на описаната за тетрациклините като група. Отделя се с млякото. Прилага се вътрешно при прасета, телета, пилета, пуйчета и др.
Тетрациклин Получава се синтетично от окситетрациклин и хлортетрациклин, и по биосинтетичен път. Използва се за лечение на дребни и екзотични животни, понякога и при селскостопански животни. Фармакокинетиката му се подчинява на общите закономерности, характерни за групата. Разпределението му в организма е малко по-слабо от това на хлортетрациклин. Прониква в еритроцитите. При приложението му на телета е установена нефротоксичност. Наблюдавани са различни странични действия като провокирането на анафилактичен шок при кучета след венозно въвеждане, повишаване активността на трансаминазите при котки, кардиовазкуларни ефекти, колапс при бързо венозно инжектиране при крави и др. Колапсът се избягва с предварително въвеждане на калциев бороглюконат.
Окситетрациклинът е най-масово използваният тетрациклин във ветеринарната медицина и е прилаган върху почти всички видове домашни животни като конвенционални и депо-лекарствени форми, приложими вътрешно и парентерално (най-често мускулно). Нежеланите му ефекти са подобни на тези, проявявани от тетрациклина.
Доксициклин Представлява полусинтетичен тетрациклин. Синтезира се от окситетрациклин или от метациклин и е с антибактериалния спектър на останалите тетрациклини. Доксициклин както и метациклин притежават по-ясно изразена липофилност, което има за резултат по-доброто им проникване в тъканите, по-висок обем на разпределение и по-добра антимикробна активност. Освен това доксициклин се излъчва чрез чревното съдържание свързан под формата на хелати и неактивен, което го прави по-слабо влияещ на интестиналната микрофлора. Свързва се със серумните протеини в по-висок процент (91-98%) от другите тетрациклини и има по-дълъг биологичен полуживот. Резорбира се в значително по-висока степен от останалите представители на групата при вътрешно въвеждане. Поради уникалния начин на елиминиране с червата при бъбречни увреждания фармакокинетиката му не се променя значително. Това го прави предпочитан при бактериални инфекции, съчетани с бъбречни увреждания. Поради кардиоваскуларни ефекти при коне не се прилага. При кучета и котки е наблюдавано повръщане и също се препоръчва ограничение на прилагането му.
Миноциклин По подобие на доксициклин, миноциклин е полусинтетичен тетрациклинов антибиотик, с повишена резорбция от храносмилателния канал, удължен биологичен полуживот и повишено проникване в тъканите. Наличието на повишено проникване в бактериалните клетки има за резултат по-висока активност срещу пеницилиназо-резистентни стафилококи, както и други микроорганизми. Повишената антибактериална активност на миноциклин се явява едно от неговите предимства. Относно фармакокинетиката му при животни все още данните са ограничени. Известна е по-високата му степен на резорбция, която по подобие на другите тетрациклини се повлиява от храна, мляко, железни съединения. Разпределя се по-добре от конвенционалните тетрациклини. Излъчването му не зависи от състоянието на бъбреците, което го прави използваем при заболявания, съпътствани от бъбречна недостатъчност. Основен път на елиминиране е с чревното съдържание, по подобие на доксициклин. Смята се освен това, че удълженото му присъствие в организма на третирани животни е свързано със забавено излъчване поради високият процент на свързване с плазмени протеини и наличието на ентерохепатален кръговрат. при кучета може да предизвика повишаване активността на трансаминазите в серум, понижаване нивото на хемоглобин в кръвта, процента на хематокрита и броят на еритроцитите.
Глицилциклини
Използването на тетрациклините за третиране на бактериални инфекции в последните години е ограничавано поради развитие на резистентни микроорганизми. Търсенето на пътища за преодоляване резистентността е довело до развитието на групата на глицилциклините. Най-напреднали на този етап са изпитванията на глицилциклина тигециклин (Tigecycline). Представлява производно на миноциклин. Глицилциклинитe притежават активност типична за по-старите тетрациклини, но са по-активни срещу тетрациклин резистентни микроорганизми поради двата механизма на резистентност - ефлукс и рибозомна протекция. Активни са срещу други резистентни патогени, включително метицилин-резистентни стафилококи, пеницилин-резистентни стрептококи, Streptococcus pneumoniae и ванкомицинрезистентни ентерококи. Тигециклин е прилаган засега само като инжективна лекарствена форма. Показва по-висок обем на разпреление от останалите тетрациклини. Свързването му с протеините е около 68%. Има добро проникване в тъканите. Излъчва се бавно – биологичният му полуживот при човек е 36 часа. По-малко от 15% от въведения тигециклин се излъчва непроменен с урината. Фармакокинетиката му се повлиява от фактори като вид, възраст, пол или патологично състояние. Важен фактор за проявата на антибактериалната активност е времето, през което в организма се задържат концентрации по-високи от MIC. Понасят се добре от животни.
9. Фениколи
Групата включва три близки по структура субстанции със сходен механизъм на действие и антибактериален спектър. Основната разлика е способността на хлорамфеникола да провокира апластична анемия, докато двата му аналога тиамфеникол и флорфеникол не притежават подобна активност. Флорфениколът има някои предимства по отношение спектъра на действие.
Хлорамфеникол Проявява антибактерилна активност посредством подтискане на бактериалната протеинова синтеза. Свързва се с рецепторите на 50s бактериална рибозомна субединица и пречи на формирането на пептиди чрез блокиране на ензима пептидин-трансфераза. На същия принцип блокира протеиновата синтеза в клетките на костния мозък при бозайници. Хлорамфениколът е класически широкоспектърен антибиотик, повлияващ голям брой Gr+ и Gr_ микроорганизми, срещу които показва бактериостаза. Сравнително често се срещат резистентни микроорганизми.
Резорбцията му при вътрешно приложение е варираща в междувидов и възрастов аспект. При моногастрични и преруминантни млади преживни се резорбира добре от храносмилателния канал. При преживни с развити предстомашия се инактивира частично в румена и резорбцията е слаба. При мускулно и подкожно приложение бионаличността му е почти 100%. Способността на хлорамфеникол да преминава през клетъчните бариери и средновисокият процент на свързване с протеините му позволяват да достига в ефективни концентрации в церебралната течност, централната нервна система, хумор аквеус. Преминава и през плацентарната бариера. Може да увреди плода поради незрелостта на чернодробните ензими, които го разграждат. Намира се във високи концентрации в храносмилателния канал, черния дроб, жлъчката, бъбреците и белите дробове. Основният път на метаболизиране, което е частично, е чрез свързване с глюкуронова киселина. Неметаболизиранатa част се излъчва чрез гломерулна филтрация между 10 и 20% при котки и кучета. При тревопасни е незначителен. Метаболитите се екскретират с урината и по-слабо в жлъчката. Излъчените с жлъчката метаболити може отново да бъдат хидролизирани в червата и да се възстанови активната субстанция. Съществува видова особеност в скоростта на елиминиране на хлорамфеникола. Поради това, че инхибира активността на лекарствометаболизиращите ензими в черния дроб, прилаганите съвместно с него лекарствени вещества са метаболизирани по-бавно и проявяват по-дълъг фармакологичен ефект. При съвместно приложение с бактерицидни антибиотици често се наблюдава антагонистичен ефект.
Може да предизвика дозозависима супресия в червения костен мозък. Най-важният въпрос, свързан с токсичността и приложението на хлорамфеникола, е предизвиканата от него независима от дозата аплазия във функцията на костния мозък при хора и проявената дълбока и перзистираща панцитопения, както и синдрома “сива кожа”. Поради това той се допуска за приложение само при животни за компания в малко случаи на специфична диагноза – дълбоки инфекции в очните тъкани, салмонелоза.
Тиамфеникол Тиамфениколът представлява полусинтетичен аналог на хлорамфеникола. Той блокира бактериалната протеинова синтеза чрез свързване с 50s рибозомална субединица, както хлорамфеникола. Притежава подобен на хлорамфеникола спектър, но има данни, че е по-слабо активен. Поради структурните различия проявява различна фармакокинетика, което също се отразява върху неговата активност. Тиамфениколът е по-добре разтворим във вода и по-малко в мазнини, поради което неговото проникване през липидните мембрани е по-бавно. Все пак е показал сравнително висока степен на резорбция при моногастрични животни (25-35%) и млади преживни с все още неразвити предстомашия. Освен това, той не се метаболизира в значима степен в черния дроб, а по-голямата част от приетата доза се излъчва в урината непроменена чрез екскреция. Излъчването му е бързо. При кучета след мускулно въвеждане е установен значително по-дълъг период на полуелиминация – 5,6 h, след резорбция от 97%. Причината за това е бавното освобождаване от мястото на инжекция. Резистентността към тиамфеникол е по-малка от тази спрямо хлорамфеникол. Токсичността на тиамфеникол е по-ниска от тази на хлорамфеникол, но най-важното му предимство е липсата на апластична анемия при неговото приложение. Това го прави използваем в практиката и има регистрирани различни лекарствени форми с него.
Флорфеникол По същество представлява флуорирано производно на тиамфеникол, при което хидроксилна група е заместена от флуорен атом. По подобие на тиамфеникол не провокира апластична анемия, но за разлика от него се поддава по-трудно на инактивиране от хлорамфеникол трансацетилазите. Проявява същият антимикробен ефект както и другите два представителя на групата. Има бактерицидна активност срещу Haemophylus и Pasteurella в концентрации близки до бактериостатичните. Спрямо високо чувствителни микроорганизми като пастьорели, стрептококи и други, MIC90 са 1-2mg/l. Ентеробактериите проявяват по-малка чувствителност. Микроорганизмите могат да развият резистентност, която обикновено е кръстосана с хлорамфеникол. Микроорганизмите, резистентни срещу хлорамфеникол поради трансацетилиране, са чувствителни към флорфеникол. В сравнение с тиамфеникол е показал по-ниски стойности на MIC и два до четири пъти по-дълъг постантибиотичен ефект. Фармакокинетичните свойства на флорфеникол са подобни на тези, които притежават двата негови аналога и особено хлорамфеникол. По отношение на разпределението в тъканите и високата бионаличност той е аналогичен с хлорамфеникол. Сравнително малко са данните относно неговия метаболизъм. При говеда се излъчва непроменен с урината. За други видове все още липсват данни. Към токсичните явления, резултат от прилагането на флорфеникол може да се отнесат временната диария и безапетитие при говеда. По-ниската токсичност на този антибиотик се свързва от една страна с липсата на повлияване върху костния мозък и от друга с практическа липса на метаболизъм в черния дроб.
10. Макролиди
Основна фармакологична характеристика
Групата макролиди включва няколко антибиотика, характерни с макроцикличен лактонов пръстен, свързан с два или повече захари чрез гликозидни връзки. В групата има природни продукти и техни полусинтетични представители. Природните продукти се получават от различни видове Streptomyces.
Класификация на макролидите
|
Притежаващи 14-членен пръстен |
Притежаващи 15-членен пръстен |
Притежаващи 16-членен пръстен |
|
Еритромицин |
Азитромицин |
Тилозин* |
|
Олеандомицин |
Кларитромицин |
Спирамицин |
|
Тролеандомицин |
|
Тилмикозин* |
|
Рокситромицин |
|
Тилдипирозин* |
*Предназначени само за ветеринарната медицина
Антибактериален спектър и механизъм на антибактериална активност Макролидите притежават широк антибактериален спектър, като от особено значение е активността им спрямо кампилобактерии, хламидии, микоплазми, коринебактерии, еризипелотрикси и др. Макар и активността им да е предимно върху Gr+ микроорганизми, те могат да повлияват и някои Gr_ – Pasteurella spp., Haemophillus spp. Чувствителни са коки, включително и такива резистентни към бета лактами. Проявяват предимно бактериостатичен ефект, като е характерно бързото развитие на резистентност спрямо тях. Бактерициден ефект може да се очаква от дози, често пъти по-високи от обикновените, препоръчани. Той е бавен и зависим от времето за контакт с микроорганизмите. Антибактериалната им активност се дължи на блокиране протеиновата синтеза чрез свързване и увреждане на 50s субединица на рибозомите на прокариоти, в резултат на което се нарушава подреждането на транспортните РНК при синтезата на белтъчната макромолекула. Мястото на свързване е близко това на хлорамфеникол и производните му, поради което между тях може да се наблюдава антагонизъм при съвместно приложение. Те могат да се свързват с митохондриалните рибозоми, но не преминават митохондриалните мембрани (за разлика от хлорамфеникол). Поради това не предизвикват подтискане на червения костен мозък на бозайници, което ги прави слабо токсични. Антибактериалната активност на макролидите се проявява като оптимална при рН по-високо от 8. Киселата среда на абсцеси, некротични тъкани, урина я подтиска.
Резистентност към макролидите се явява сравнително бързо, често е плазмидно медиирана, може да бъде кръстосана с други макролиди или линкозамиди и се дължи на следните причини: намаляване степента на проникване в бактериалните тела (по-често срещана при Gr_ микроорганизми); синтеза на бактериални ензими, които ги хидролизират; промени в рибозомите на микроорганизмите.
Фармакокинетика Резорбцията от храносмилателния канал на еритромицин като база не осигурява високи нива, тъй като част от тях биват инактивирани от киселото съдържание на стомаха. Поради това се прилага вътрешно като соли, стеарат, естолат фосфат и други, които имат по-висока стабилност в кисела среда или се използват покрити таблетки. Солите като например стеарати и фосфати дисоциират в червата и се резорбират като активна субстанция. Естерите се резорбират като такива и хидролизират в тялото като освобождават активно лекарствено средство. Присъствието на храна в стомаха намалява резорбцията. Тилозин се резорбира добре в храносмилателния канал, а тилмикозин бавно с бионаличност около 20%. Мускулното и подкожно въвеждане осигурява високи нива, но може да бъде болезнено (еритромицин, тилозин при коне и кучета) или да бъде фатално за свине и коне. Макролидите обикновено имат по-високи нива в тъканите в сравнение с кръвта. От особено значение са белодробните, поради приложението им за лечение на респираторни инфекции, също така в някои течности – жлъчката, простатата, семенната течност, плеврални и перитонеална течности и тъкани – черен дроб, сърце, далак, бъбреци. Преминаването им през кръвно-мозъчната бариера е слабо и не осигурява терапевтични нива. Преминават плацентарната бариера. Високи нива се намират в чревното съдържание, най-вече поради високото съдържание в жлъчката. Висок процент от антибиотицитие имат билиарна екскреция. Високите тъканни концентрации рефлектират във високите стойности на обема на разпределение – между 3 и 6 l/kg за еритромицин и 1-2,5 l/kg за тилозин при повечето видове животни. Азитромицин притежава екстремно висок обем на разпределение – над 20 l/kg. Свързването с протеините на представителите на тази група е сравнително ниско – 18-30%. Еритромицин метаболизира в черния дроб, чрез деметилиране от чернодробните микрозомални ензими. Деметилираните продукти имат малка антибактериална активност и представляват 90% от антибиотичното съдържание в жлъчката. Малка част 2-5% от активния еритромицин се излъчват в урината след венозно въвеждане. Поради това реналната недостатъчност не влияе значително върху елиминацията му. Биологичният полуживот на еритромицин варира между 1 час при гризачи и зайци и 3-4 часа при говеда. Тилозин се резорбира добре от храносмилателния канал, не се разрушава в стомаха, разпределя се добре в организма по подобие на еритромицин. Частично метаболизира в черния дроб и се излъчва с жлъчката и чревното съдържание.
Нежелани ефекти След приложение на макролиди те са сравнително рядко срещани при животни. Някои от наблюдаваните нежелани ефекти след приложение на еритромицин са повръщане, треска, статичен хепатит. При коне може да предизвика диария.
Представители
Еритромицин Поради високата степен на тъканно разпределение и продължително интрацелуларно задържане, той се прилага при инфекции, предизвикани от бактерии, които не могат да бъдат достигнати от полярни и по-слабо мастно разтворими субстанции. В този смисъл се явява алтернатива на приложението на пеницилините. Активен е срещу стафилококи, стрептококи, коринебактерии, клостридии, листерии, еризипелотрикси, бруцели, пастьорели, микоплазми, хемофилуси, кампилобактерии и др. Може да предизвика гадене и повръщане. При коне понякога предизвиква нарушения в мотилитета на храносмилателния канал. Излъчването му с млякото е продължително.
Тилозин Тилозин се прилага само във ветеринарната медицина за лечение на различни инфекции, причинени от Gr+ микроорганизми при домашни и диви животни: респираторни заболявания, инфекции на храносмилателния канал. Особено често е неговото вътрешно приложение с храната при свине и птици. В близкото минало бе използван и като нутритивен антибиотик, приложение, което в момента е забранено, поради опасност от развитие на резистентност. По подобие на еритромицин се излъчва продължително време с млякото, поради което не се препоръчва при лактиращи животни, чието мляко се използва за консумация.
Тилмикозин Сравнително нов полусинтетичен макролид. Използва се като ефективно средство за лечение на респираторни заболявания при говеда. Високо чувствителни към него са се показали пастьорели и микоплазми. Други високо чувствителни микроорганизми са стафилококи и стрептококи. Повечето от Gr_ микроорганизми, различни от пастьорели и хемофилус са резистентни. Приложен вътрешно, тилмикозин се резорбира във висок процент от храносмилателния канал, висока степен на резорбция показва и след подкожно приложение. Излъчва се бавно, поради което понякога е достатъчно еднократно третиране. Прилаганите дози са 10 mg/kg подкожно при телета, след което осигурява терапевтични концентрации от 3 дни и 20 mg/kg при пилета и терапевтични концентрации от 48 до 72 часа. Има 28 дневен карентен срок. Излъчва се с млякото в продължение на 30 дни, поради което не се препоръчва за приложение на лактиращи животни. Инжектирането на тилмикозин на коне, кози, свине и други видове може да бъде последвано от токсични реакции с фатален край. Засяга предимно сърдечната дейност. Като антидот при кучета може да бъде използван добутамин. Предизвиканото подтискане на сърдечната дейност не се премахва от адреналин. Вътрешното приложение на тилмикозин при свине се понася добре. Поради това е разрешен за лечение на респираторни заболявания при прасета. Приложим е с храната.
Спирамицин има ограничено приложение във ветеринарната медицина. Има способността, както и другите макролиди да подтиска активността на лекарствометаболизиращите ензими на черния дроб. Проявява по-слаба антимикробна активност от еритромицин in vitro. Той обаче има изключителна способност да се концентрира в тъканите, където осигурява 20-60 пъти по-високи от кръвните нива. Особено активен е при интрацелуларни инфекции.
Кларитромицин Сравнително нов макролидов антибиотик, представляващ полусинтетичен (6-O-methyl дериват) на еритромицин. При хора е показал по-добра поносимост от еритромицин, има по-широк спектър от него, по-висока активност и два пъти по-дълъг биологичен полуживот.
Азитромицин Първият представител на групата азалиди. Те са близки до макролидите и имат подобен на тях механизъм на действие Азитромицин се резорбира по-добре от еритромицин при вътрешно въвеждане, по-добре се понася и има по-дълъг период на задържане в организма (особено в тъканите). Тъканните концентрации са около 100 пъти по-високи от серумните, а тези в левкоцити, макрофаги и фибробласти – 200-300 пъти по-високи. Биологичният му полуживот при котки е между 13 и 72 часа, обемът на разпределение 23 l/kg, а при кучета 12 l/kg. Излъчването му при кучета също е забавено. Оралната му резорбция е сравнително висока – над 58% при котки и 97% при кучета. Притежава и по-широк антибактериален спектър. Влияе върху някои Gr_ микроорганизми като представители на Haemophylus, както и хламидии и токсоплазми. Активен е срещу микобактерии и микоплазми. Поради високото му съдържание в тъканите, фармакокинетичните параметри не винаги корелират с неговата активност in vivo. Бавното освобождаване на азитромицин от левкоцитите го разграничава от другите макролиди и флуорохинолоните, при които настъпва бързо освобождаване на фракциите от този вид клетки. Клиничното приложение на азитромицин е ограничено в рамките на видовете куче, котка и птици, но неговото приложение постоянно се разраства. Приложението му обикновено е един път дневно в продължение на 3-5 дни в дози 5-10 mg/kg. Поносимостта му е сравнително висока.
Рокситромицин Представлява полусинтетичен киселинноустойчив дериват на еритромицин подобна антибактериална активност и по-добра резорбция при вътрешно приложение. Притежава и значително по-продължителен биологичен полуживот – 13 h. Понася се много добре при вътрешно прилагане.
Тилдипирозин Нов полусинтетичен антибиотик, аналог на тилозин. Притежава антибактериалния спектър и механизъм на действие на другите макролиди. Осигурява високи интра- и екстрацелуларни терапевтични концентрации в белодробната тъкан в бронхиалния секрет на телета в продължение на повече от 20 дни.
11. Линкозамиди
Групата включва два антибиотика със сходна структура линкомицин и клиндамицин. В много отношения тези два антибиотика са близки до макролидите. Намират приложение преди всичко за третиране на инфекции, предизвикани от резистентни към пеницилини Gr+ микроорганизми или наличие на непоносимост спрямо пеницилини. Най-често линкозамидите се използват за третиране на инфекции, предизвикани от стафилококи и стрептококи.
Линкомицин Представлява слаба основа. Механизмът на антибактериалната му активност е свързан с подтискане на протеиновата синтеза на микроорганизмите чрез свързване с 50s рибозомални субединици по начина, по който се свързват и макролидите. Линкомицин е активен срещу микроорганизмите, показващи чувствителност спрямо макролиди. резорбира се бързо и непълно от храносмилателния канал. Налице са данни за биологична наличност при прасета в рамките на 20-50%. Максимални серумни нива се установяват след вътрешно приложение след около един час, а след мускулно – в рамките на 2 до 4 часа. Разпределя се добре в тялото, като телесните тъкани имат по-високи концентрации от серума. В централната нервна система преминава в ниски концентрации. При вътрешно въвеждане по-голямата част от антибиотика се открива в червата и малка част (14%) в урината при кучета. След мускулно въвеждане 38% се излъчват с чревното съдържание и 49% с урината. Най-високи нива са установени в черния дроб и бъбреците и ниски такива в мускулатурата. По отношение степента на неговият метаболизъм няма единодушие, но се смята, че при пилета се излъчва като непроменен и като метаболити чрез жлъчката и урината. Токсичността и страничните ефекти при прилагането му се доближават до тези, проявявани след приложение на макролиди. При кучета и котки те са рядко явление и се изразяват в диария и повръщане. При прасета се наблюдава преходна диария. При преживни, коне, зайци, хамстери и др. съществува риск от развитие на клостридии, последвано от тежък ентерит, ентероколит, диария и смърт. Най-висока чувствителност проявяват зайци и коне. Налице са и данни, че при млечни крави провокира кетоза. Линкомицин се използва за третиране на Gr+ аеробни и анаеробни инфекции, по подобие на показанията на макролидите. От особено значение е неговото приложение при инфекции на храносмилателния канал и кожата. В последно време при кучета и котки той е заменян от клиндамицин. При комбинирането на линкомицин със спектиномицин се получава допълване на спектъра и потенциращ ефект.
Клиндамицин Химически представлява 7-хлорлинкомицин и се продуцира от същия щам микроорганизми Streptococcus licolnensis, var. lincolnensis. Има същия механизъм на действие и по-висока активност върху анаеробни бактерии, включително Gr_ анаероби в сравнение с макролидите. Съществуват обаче и данни, които свидетелстват за липса на особени предимства в тази насока за клиндамицин пред линкомицин и макролидите. Клиндамицин се резорбира от храносмилателния канал по-добре от линкомицин и достига по-високи серумни концентрации. Разпределя се добре в тъканите и осигурява високи интрацелуларни концентрации, което рефлектира във високи стойности на обема на разпределение – >1,6 l/kg. Най-високи концентрации са открити в белите дробове, следвани от черен дроб, далак, тънки черва. Ниски са нивата в централната нервна система. След мускулно въвеждане са установени високи стойности на бионаличност - 87-100%. Проявява освен това удължено излъчване. При вътрешно въвеждане наличието на храна в стомаха не повлиява неговата резорбция. Добре се разпределя и в секретите, плевралната течност, ставите, костния мозък, фагоцитите. Преминава плацентарната бариера, но не са налични данни за неговата фетотоксичност. Метаболизмът на клиндамицин е подобен на този на линкомицин. При кучета 36% от въведеното количество се излъчва непроменено с жлъчката и урината. Обикновено 28% се екскретира като глюкуронид (неактивен), 28% като сулфоксид (с 25% активност) и 9% като деметилиран продукт. Основен път на елиминацията им е чрез жлъчката. Най-сериозните странични явления, които може да се очакват са свързани с развитието на псевдомембранозен колит, дължащ се на развитието на Clostridium difficile, но при животни не са регистрирани подобни случаи. Наблюдавани са позиви за повръщане, повръщане и диария. Противопоказано е приложението на клиндамицин за лечение на токсоплазмоза при котки, поради усложняване на клиничните признаци.
Пирлимицин Сравнително нов и все още слабо познат за ветеринарната медицина. Активността му срещу аероби и анаероби е подобна на тази на клиндамицин, но 2 до 20 пъти по-висока, вероятно поради високите му концентрации в тъканите.
12. Анзамицините представляват група природни антибиотични продукти, продуцирани от Streptomyces mediterranei и техни полусинтетични производни. За ветеринарната медицина реално значение имат само рифамицин и рифампицин. Механизмът на действие включва проникване в бактериалните клетки и формиране комплекс с бета субединица на ДНК-зависимата РНК-полимераза. По този начин инактивира ензими, участващи в синтезата на РНК. Този тип блокиране може да се случи и в клетки на бозайници, за което обаче са необходими по-високи концентрации. Влиянието им е по-силно в логаритмичната фаза от развитието на инфекцията. Повлияват предимно Gr+ микроорганизми, микобактерии, анаероби. Изграждането на резистентност спрямо тях е бързо. Поради това те се прилагат в случай на изградена резистентност спрямо други антибактериални средства. Резистентността спрямо тях не е свързана с такава спрямо други антибиотици. Съвместими са с макролиди, фениколи, новобиоцин, тетрациклини. Особеното при тях е високата им активност срещу интрацелуларно развиващи се микроорганизми.
Рифамицин, Рифамицин SV Повлиява в ниски концентрации коки (стрептококи, стафилококи), причинители на антракса, Clostridium perfringens, Mycobacterium tuberculosis. Gr_ микроорганизми се повлияват от високи концентрации. Поведението му в организма се характеризира със слаба резорбция от храносмилателния канал, поради което се предпочита парентералното му приложение. Осигурява терапевтични концентрации в продължение на 8-12 часа. Разпределя се добре в организма. Високи нива са измерени в черния дроб, бъбреците, белите дробове, жлъчката и урината. Излъчва се с жлъчката и урината. Подлага се на ентерохепатален кръговрат. Рифамицин проявява относително висока токсичност. При предозиране предизвиква чернодробни увреждания, промени в бъбреците, в кръвната картина. Прилага се при инфекции, причинени от микроорг. резистентни към други антибиотици, при вътреклетъчно развиващи се инфекции, както и локално при мастити. Не се прилага при чернодробни увреждания.
Рифампицин римактан, рифампин, тубоцин Активен е срещу Gr+ микроорганизми (стафилококи, микобактерии, хемофилус, наисерии, хламидии, анаероби). активността му спрямо Gr_ микроорганизми е ограничена. Резорбира се бързо от храносмилателния канал на животни с еднокамерен стомах, като храната забавя резорбцията му. При преживни се наблюдава известно забавяне и удължаване на процеса. Свързва се в 80% с плазмените протеини. Разпределя се в организма с особено високи нива в белите дробове, черния дроб, жлъчката и урината. Метаболизира до активен метаболит – 25 дезацетилрифамицин, в малка степен до глюкуронид. Излъчват се в жлъчката и чрез пасивен транспорт в бъбреците. Фармакокинетиката му показва бързо достигане на високи концентрации, независимо от начина на въвеждане и сравнително дълъг биологичен полуживот - 45 h при овце, 4,75 h при коне. Рифампицин може да бъде използван за лечение на микробни инфекции, предизвикани от стафилококи, стрептококи, родококи, коринебактерии, клостридии, наисерии, листерии и др. Резистентни са псеудомонаси, E. coli, ентеробактерии, клебсиели, салмонели, протеуси и др. Показал е известен синергичен ефект с амфотерицин В срещу някои гъбички (Saccharomyces cerevisiae, Aspergillus, Blastomyces). Като негови токсични действия са известни тератогенност, хепатит, тромбоцитопения, повръщане, диария, хемолитична анемия. Оцветява урината в червено.
13. Полимиксини
Полимиксин В е комплекс от две съединения (B1 и В2). Полимиксин Е е известен като колистин. Те са основни повърхностноактивни катийонни детергенти, които взаимодействат с фосфолипиди в клетъчната мембрана, проникват през мембраната и разрушават структурата и. Същевременно провокират промени в пермеабилитета в клетките и причиняват смъртта им, което прави тези антибиотици с бактерицидни качества. Полимиксините се резорбират в много малка степен от храносмилателния канал. При парентерално приложение търпят бърза резорбция. Свързват се с плазмените протеини в рамките на 70-90%, разпределят се в повечето вътрешни органи. При птици колистин показва висока токсичност при венозно въвеждане. При вътрешно приложение се резорбира между 0,5 и 5% в зависимост от възрастта, като по-млади птици до 1 седмица имат по-висока резорбция. Проявяват активност към Gr_ микроорганизми като щамове на E. coli, Haemophylus, салмонели, псевдомонаси, протеуси. Поради слабата им резорбция полимиксините се използват предимно за лечение на заболявания на храносмилателния канал и локално при заболявания на кожа и лигавици. Парентералното им приложение е свързано с повече рискове от бъбречни увреждания, засягане на ЦНС и последици като депресия, колапс.
14. Нутритивни антибиотици
Имат способността да подобряват усвояването на фуража, да повишават прираста и да намаляват заболеваемостта и смъртността. Подобряването на прираста е между 4 и 8%, а оползотворяването на храната е между 2 и 5%. Механизмите за повишаване на прираста не са достатъчно добре познати. Известни са четири взаимно допълващи се хипотези: бактериалното разрушаване, подобряване на резорбцията на хранителни вещества посредством изтъняване бариерата на тънките черва, намаляване продукцията на токсини от чревните бактерии, намаляване на случаите на субклинични чревни инфекции.
Използването на нутритивните средства е присъщо на модерното животновъдство, но като практика не е безкритично. В началото са използвани почти всички познати антибиотици, въпреки че не всички повишават прираста, други са твърде скъпи. В последствие е установено, че неконтролираното използване на антибиотици като нутритивни средства може да доведе до увеличаване на резистентността на бактерии при хора и животни, особено Gr_ патогени. Тази теория доведе до ограничаване на приложението на нутритивни антибиотици до такива, които отговарят на следните изисквания: да предизвикват значим икономически ефект при прираста; да не са (бъдат) прилагани като терапевтични средства на хора и животни; да не нарушават ефективността от приложение на други терапевтични антимикробни средства, предизвиквайки развитие на резистентни щамове към тях; не се допускат остатъчни вещества от тях в продукти от животински произход.
Бамбермицин, флавофосфолипол, флавомицин. Представлява гликолипиден антибиотик, продуциран от щамове на Streptomyces species. Блокира изграждането на бактериалната стена. Не изгражда кръстосана резистентност с пеницилините. Активен е предимно върху Gr+ микроорганизми, но влияе и върху някои Gr_ като пастьорели и бруцели. Спектърът на неговата активност покрива стафилококи и стрептококи и е подобен на този на пеницилините и отчасти макролидите. Бамбермицинът се резорбира слабо от храносмилателния канал. Не води до остатъчни вещества в тъканите и органите. Не са известни и данни за концентрациите на антибиотика в храносмилателния канал на третираните животни. В храносмилателния канал той редуцира броя на C. perfringens, въпреки че in vitro е налице нечувствителност към него. Не показва влияние върху ентерококи, кампилобактерии, лактобацили в червата на пилета. Влиянието му върху салмонели е дискутируемо. Може да доведе до ограничаване образуването на резистентни щамове от Е. coli и салмонели спрямо други антибиотици.
Стрептограмини Състоят се от А и В компоненти, действащи като синергисти. Принадлежат към групата MLS (макролиди – линкозамиди – стрептограмини). До сега са използани три стрептограмини като терапевтични средства и стимулиращи прираста – виргиниямицин, пристинамицин и квинапристин/далфопристин. Виргиниямицин е използван за локално третиране в хуманната и ветеринарната медицина и като стимулиращо прираста средство. Продуцира се от Streptomyces virginiae. Другите два продукта нямат практическо значение за ветеринарната медицина и са прилагани ограничено в хуманната.
Авиламицин Авиламицинът принадлежи към олигозахаридната група антибиотици и е използван само като стимулиращ прираста и продуктивността. Продуцира се от Streptomyces viridochromogenes и представлява смес от няколко компонента. Активността му се проявява чрез свързване с 30S рибозомна субединица. Има и данни за свързване с 50S субединица на рибозомите. Активен е срещу Gr+ микроорганизми. Оралното приложение на авиламицин в концентрации 60 ppm има за резултат излъчване изключително с чревното съдържание и много ниски концентрации са намерени в тъканите на свине и плъхове. Под въздействието на авиламицин се редуцира броят на C. perfringens в черва на пилета. Освен това предпазва от некротичен ентерит, предизвикан от C. perfringens при пилета, но не променя колонизацията от Salmonella.
Бацитрацин Бацитрацинът е полипептиден антибиотик, продуциран от Bacillus licheniformis. По-стабилен е като цинкова сол, която се използва като стимулатор на прираста и локално се прилага в хуманната и ветеринарната медицина. Механизмът на действие се изразява в синтезата на пептидогликан и в подтискане формирането на бактериалната стена. Активен е предимно срещу Gr+ микроорганизми, като антибактериалният му спектър е подобен на този на пеницилиновата група. Може да елиминира резистентност на микроорганизми спрямо други антибиотици. Резорбира се много слабо в храносмилателния канал. Показал е алергогенност при хора. Влиянието върху чревната флора се изразява в намаляване броя на ентерококите. Предпазва от некротичен ентерит, провокиран от C. perfringens.
Ключови понятия
|
[2] Адитивен ефект |
Активността на комбинацията е равна на сумата от активностите на двете компоненти. |
|
[3] Синергизъм между антибиотици |
Активността на комбинацията е значително по-висока от тази на двете компоненти, поради: последователно инхибиране на следващи стъпки в метаболизма (сулфонамиди – триметоприм), последователно инхибиране на синтезата на бактериалната стена (мецитицилин – ампицилин), улесняване проникването на единия антибиотик от страна на другия (бета-лактами – аминогликозиди), инхибиране на инактивиращи ензими (амоксицилин – клавуланова киселина), предпазване от развитие на резистентна микробна популация (еритромицин – рифамицин). |
|
[4] Антагонизъм между антибиотици |
Активността на комбинацията е значително по-малка от активността на всеки един от компонентите и. Обикновено повече от бактериостатичните субстанции намаляват активността на бактерицидните. |
|
[1] Бактерицидна и бактериостатична активност |
Средствата с бактериостатична активност спират размножаването на микроорганизмите, но не ги убиват. Бактерицидната активност е свързана с унищожаване на микроорганизмите, предизвикали инфекцията. |
Налице е клиничен случай с диагноза остро възпаление на млечната жлеза при лактираща крава, предизвикан от стафилококи. Какъв антибиотик за лечение трябва да бъде предпочетен като първи избор и какъв като втори?




