Приложение на фармакокинетиката в терапията
Учебни цели
Темата включва:
- Основни фармакокинетични параметри.
- Междувидови различия и изчисление (екстраполиране) на дози от един на друг вид.
При всяко едно лекарствено приложение на даден пациент, решението за дозата и планирането на дозовия режим са от съществено значение. Това решение се основава на целта да бъде достигнат определен желан фармакологичен ефект върху състоянието на третирания пациент. В част от случаите ефектът от лекарствено приложение е лесно наблюдаван и служи като ориентация за дозите и честотата на тяхното приложение. В много от случаите обаче този подход е неприложим. Като алтернативен подход се използва съчетание на данни за лекарствените плазмени концентрации с наблюдаваните фармакологични ефекти. Основното в подхода е проследяване промените на плазмените концентрации след различни начини на въвеждане като функция на времето, подбор на адекватни математически методи за тяхното описание и маркиране на определени математически константи за характеризирането им. С други думи използват се математически константи, характеризиращи поведението на дадено вещество в организма след неговото въвеждане.
Основните пътища на въвеждане на лекарствените средства във ветеринарната медицина са:
- ентерални – вътрешно (орално, директно в стомаха или румена), ректално;
- парентерални – венозно (интравенозно) интраартериално, мускулно, подкожно, интраперитонеално, интраплеврално, субарарахноидално, инхалативно и др.
Често лекарствени форми се прилагат и локално (терминално) – интраназално, конюнктивално, вътреставно, интрацистернално (интрамамарно).
Всеки един от изброените начини определя специфични профили на кривите на кръвните и тъканни концентрации на прилаганите вещества, въпреки, че те зависят и от индивидуалните особености на всяка субстанция.
1. Основни фармакокинетични параметри
- [1] площ под кривите на кръвните концентрации - (AUC)
- [2] тотален телесен клирънс – (ClB)
- [3] привиден обем на разпределение – (Vd)
- [4] биологичен полуживот – (t1/2)
- [5] биологична наличност (бионаличност) – (F)
- [6] интервал между приложение на две единични дози – (t)
Телесната маса също е широко използван параметър, характеризиращ пациента. Дозирането на лекарствените вещества най-често е на единица телесна маса – килограм.
Чрез използване значението на фармакокинетичните параметри се цели оптимизиране на дозовият размер и режима на дозиране. Поради необходимостта от многократно въвеждане е необходимо да се намерят най-подходящите дози и интервали на третиране, които осигуряват необходимото количество от дадено вещество в определен орган за определено време.
Математическото моделиране на поведението на дадено лекарство е обвързано със схематичното представяне на организма като система от отделни свързани помежду си пространства (#компартименти#). Тъканите на всеки компартимент се характеризират еднотипно отношение към определена лекарствена субстанция, без да са задължително анатомично и физиологично обособени като сходни.
Това означава, че организмът може да се разглежда като едно хомогенно, 2, 3 или повече, свързани помежду си и с движението на лекарствените субстанции пространства.
Еднопространственият модел представя организма като единично общо пространство, в което лекарственото вещество след бързо венозно въвеждане се разпределя бързо и се елиминира с определена и специфична за всяко вещество скорост. Скоростта на елиминация се дефинира с елиминационна скоростна константа. Кривата на кръвните концентрации може да бъде описана чрез уравнения от типа: Cp=B.e-bt, където Cp e стойността на концентрацията във време t; В се представя като стойността на кръвната концентрация във време 0; b e скоростната елиминационна константа; е е основата на натуралните логаритми (2.303).
Този модел може да характеризира поведението на малък брой лекарствени вещества, които имат много бързо и равномерно разпределение в организма. Повечето от тях се разпределят с различна скорост в различните тъкани и течности. Те се разпределят веднага в т.н. централен компартимент, който включва най-често кръвта, екстрацелуларните течности и добре кръвоснабдените органи като сърце, черен дроб, бели дробове, бъбреци.
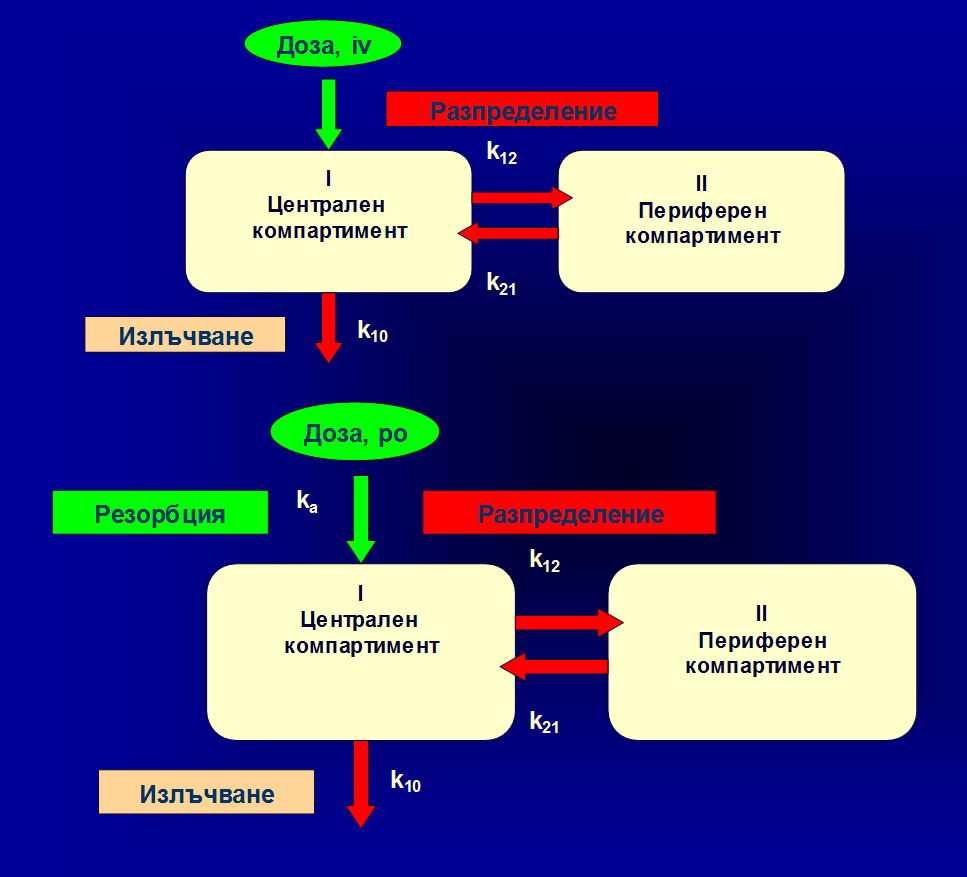
Схема на основните фармакокинетични процеси осъществявани в организма с лекарствено вещество.
Разпределението в останалите по-слабо кръвоснабдени органи и тъкани е по-бавно. Това определя отчитане наличието на втори, т.н. периферен компартимент, в който постъпването на лекарствените вещества е забавено.
Кръвните нива в тези случаи имат вид на крива с две части – начална стръмна и втора – с по-слаб наклон. Тези криви са характерни за венозно въвеждане на вещества и описват разпределението в различните тъкани на организма (a фаза) и излъчването им (чрез метаболизъм и екскреция) от организма (b фаза). Двете константи характеризират наклона на кривите в двете фази – съответно разпределение и елиминация. Кривата на кръвни концентрации в такива случаи може да бъде описана чрез уравнения от типа: Cp=A.e-at + B.e-bt, където Cp e стойността на концентрацията във време t; А и В представят стойността на кръвните концентрация във време 0 за фазите на разпределение и елиминация съответно; a e скоростна константа, характеризираща разпределението; b e скоростната елиминационна константа; е е основата на натуралните логаритми (2.303).
 От наклона на частта от кривата, характеризираща фазата на елиминация и при двата модела (b) се изчислява стойността на биологичния полуживот, която се дефинира като време, през което стойностите на кръвните концентрации намаляват двойно. Обикновено се приема, че за време равно на стойността на пет биологични полуживота лекарственото вещество практически е излъчено от организма.
От наклона на частта от кривата, характеризираща фазата на елиминация и при двата модела (b) се изчислява стойността на биологичния полуживот, която се дефинира като време, през което стойностите на кръвните концентрации намаляват двойно. Обикновено се приема, че за време равно на стойността на пет биологични полуживота лекарственото вещество практически е излъчено от организма.
Движението на вещества с по-сложно разпределение могат да бъдат описвани чрез по-сложни математически модели, като например трипространствен, характерен за аминогликозидните и тетрациклиновите антибиотици. Като обяснение на модела за първата група антибиотици се приема натрупването на представителите на тази група в бъбречната тъкан във високи концентрации и елиминирането им от там в продължение на седмици и месеци. Така те играят роля на тъкан с различно отношение към тези антибиотици в сравнение с всички други тъкани на организма.
Познати и използвани са и некомпартиментни и нелинеини методи, описващи поведението на лекарствени вещества в организма. В повечето случаи промените на плазмените концентрации тясно корелират с началото, интензивността и продължителността на фармакологичния ефект.
 При екстраваскуларните пътища на въвеждане (вътрешно, мускулно, подкожно) лекарствените вещества попадат в кръвния ток с различна скорост и кривата им се характеризира с начална възходяща част, отразяваща скоростта на резорбция от мястото на въвеждане. Често появяването в кръвния ток е след определен интервал от време наречен lag time. След екстраваскуларните въвеждания лекарствените вещества се подлагат едновременно на резорбция, разпределение и елиминация. Скоростта на осъществяването на всеки от тези процеси се отразява върху характера на кривата на лекарствените вещества в кръвния ток.
При екстраваскуларните пътища на въвеждане (вътрешно, мускулно, подкожно) лекарствените вещества попадат в кръвния ток с различна скорост и кривата им се характеризира с начална възходяща част, отразяваща скоростта на резорбция от мястото на въвеждане. Често появяването в кръвния ток е след определен интервал от време наречен lag time. След екстраваскуларните въвеждания лекарствените вещества се подлагат едновременно на резорбция, разпределение и елиминация. Скоростта на осъществяването на всеки от тези процеси се отразява върху характера на кривата на лекарствените вещества в кръвния ток.
Съпоставяне на кривите на кръвните концентрации след венозно и вътрешно въвеждане. 1 крива след венозно и 2 след невенозно въвеждане.
В началото скоростта на резорбция е по-висока от елиминационната, поради което нивата в кръвта нарастват. По различни причини (напр. намаляване количеството в мястото на резорбция) резорбцията постепенно се забавя и при изравняването и с елиминационната се стига до максимални концентрации (Cmax). Това се осъществява в определено време след приложението (tmax). След това скоростта на елиминация превишава и концентрациите намаляват. Математически величината на бионаличността (F) се изчислява като съотношение между площта под кривите на кръвните концентрации при екстраваскуларен начин на въвеждане се осъществява чрез формулата F(%)= AUCp.o./AUCi.v.х100 , където AUC означава площ под кривата след екстраваскуларно и венозно въвеждане. Стойностите на площ под кривата се изчисляват съобразно формулата AUC=A/a=B/b при венозно въвеждане и по т.н трапецоиден метод след ектстраваскуларно приложения
За относителна бионаличност се приема съотношението между стойностите на AUC на две лекарствени форми приложени екстраваскуларно. Ако две лекарствени форми, съдържащи едно и също активно вещество имат близки стойности на Тmax, Cmax и AUC те са биоеквивалентни.
Количествен израз на степента на разпределение на дадено лекарствено вещество в организма е т.н. обем на разпределение (Vd), който се изчислява в различни варианти. Изхождайки от определението, изразено в съотношението Vd=D/AUC може да се направи заключение, че най-общо високите плазмени концентрации съответстват на ниски тъканни т.е. ниски стойности на Vd и обратно-ниските плазмени концентрации предполагат висока степен на натрупване и задържане в тъканите т.е. наличие на високи стойности на Vd.
Изчислението на стойностите на две от значенията на обема на разпределение са : Vd(area)=D/AUC.b , където D е приложената доза.
Общият телесен клирънс се определя съобразно формулата ClB=Vd(area).b.
Многократното приложение, необходимо за поддържане на ефективни концентрации, е свързано освен с дозата и с времето между приложенията на всяко едно от еднократните въвеждания. От продължителността на дозовите интервали зависи т.н. “steady state” (стационарно състояние) на концентрациите в организма. Средна стойност на стационарната концентрация може да бъде изчислена чрез формулата: Cp=F.D/ClB.t, където
F e бионаличност;
D – доза;
ClB – тотален телесен клирънс;
t – продължителност на дозовия интервал.
Въз основа на тази зависимост може да бъде изчислена доза, която да поддържа определени концентрации:
D=Cp.ClB.t/F, където значението на символите е аналогично на това в предната формула.
Във ветеринарната практика фармакокинетичните параметри имат значение и за определяне на времето между последното третиране и момента, в който количествата остатъчни лекарствени вещества са по-ниски от максималните допустими (MRLs - maximum residue levels), които не създават опасност за здравето на консумиращи продукти от третирани животни. Стойностите на MRLs се изчисляват въз основа на сложни експерименти върху опитни животни и математически формули. От значение е стойността на т.н. допустим дневен прием за хора на хранителни продукти, който не допуска риск за здравето, при условие на непрекъсната консумация в продължение на цял живот (acceptable daily intake, ADI). Ориентировъчно карентния срок на дадено вещество може да бъде определен чрез зависимостта: t=(lnR-lnct)/b, където:
t е времето на продължителност на карентния срок;
R – начална концентрация на лекарственото вещество в съответната изследвана тъкан, определена чрез екстраполиране на кривата на тъканните концентрации в елиминационната и част;
Ct – желаната тъканна концентрация за изпитваното вещество (обикновено равна на стойността на MRL);
b – елиминационна константа на изпитваното вещество за съответната тъкан.
На практика карентните срокове се определят чрез директно измерване на тъканни концентрации от дадено вещество в черен дроб, бъбреци, месо, тлъстини (при птици кожа с мастна тъкан). За остатъчни вещества (респективно определяне на карентни срокове) се изследват мляко и яйца.
Съществуват редица фактори, които могат да повлияят процесите на лекарствената кинетика в организма на третираните животни като видова, възрастова, полова специфика, патологични състояния и др.
2. Междувидови различия и изчисление (екстраполиране) на дози от един на друг вид.
Крайната цел на изучаване на междувидовите различия във фармакикинетиката е предвиждане на дозата и евентуалната токсичност за вид, за който липсват данни. Основна пречка за това са възможностите за допускане на грешки поради междувидови различия във фармакокинетиката (особено разпределение, метаболизъм и екскреция), както и различия във фармакодинамиката поради междувидови различия в чувствителността. Обикновено за антибиотици и други химиотерапевтици, причини от този тип са по-маловажни. За лекарствени вещества влияещи върху видово-специфични рецептори, фармакокинетичните параметри може да не са достатъчни за предвиждане на тяхното въздействие.
Най-използваният подход за междувидово екстраполиране на фармакокинетични параметри, респективно дози, е ниво на основния метаболизъм. Емпирични измервания показват, че един физиологичен параметър като например реналната гломерулна филтрация (GFR) е функция на телесната маса на вида GFR=(BWkg)0.75 , където BW e телесната маса. Това означава, че нивото на гломерулна филтрация се забавя с увеличаване на телесната маса на животните в междувидов и вътревидов аспект. На базата на теорията, че тази зависимост е валидна за всички процеси в организма, стои подходът за екстраполиране на лекарствената фармакокинетика от един вид на друг. Уравнение, което показва зависимостта на определен параметър от метрична характеристика на организма се дефинира като алометрично. Тъй като повече от фармакокинетичните параметри са тясно свързани и зависят от определена физиологична функция, те също се включват в уравнения от типa: Y=a.(BW)b, където Y e фармакокинетичен параметър, а е алометричен коефициент и b – алометричен експонент. За повечето от физиологичните процеси, респективно фармакокинетични параметри, стойностите на експонента варират около 0.75.
Ключови понятия
|
[1] AUC |
Площ под кривите на кръвните концентрации. |
|
[2] ClB |
Тотален телесен клирънс. |
|
[3] Vd |
Привиден обем на разпределение. |
|
[6] t |
Интервал между приложение на две единични дози. |
|
[4] Биологичен полуживот (t1/2) |
Време за намаляване на плазмената концентрация на дадено лекарствено вещество наполовина във фазата на елиминиране. |
|
[5] Бионаличност (F) |
Количеството лекарствено вещество, което се резорбира след екстраваскуларен начин на въвеждане и попада непроменено в кръвния ток, съотнесено към същото след венозно въвеждане. |
Литература
Ветеринарномедицинска фармакология, 1996 г.
Автори: Д. Друмев, Р. Гахниян-Мирчева, Д. Пашов, Ст. Вангелов
Rang & Dale's Pharmacology
Автори: H. P. Rang, M. M. Dale, J. M. Ritter, R. J. Flower, G. Henderson




