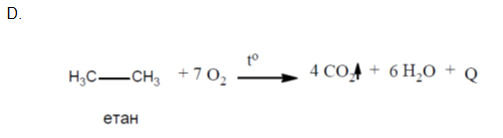НАСИТЕНИ АЛИФАТНИ ВЪГЛЕВОДОРОДИ
АЛКАНИ (ПАРАФИНИ)
I. ОПРЕДЕЛЕНИЕ, ХОМОЛОЖЕН РЕД, НОМЕНКЛАТУРА

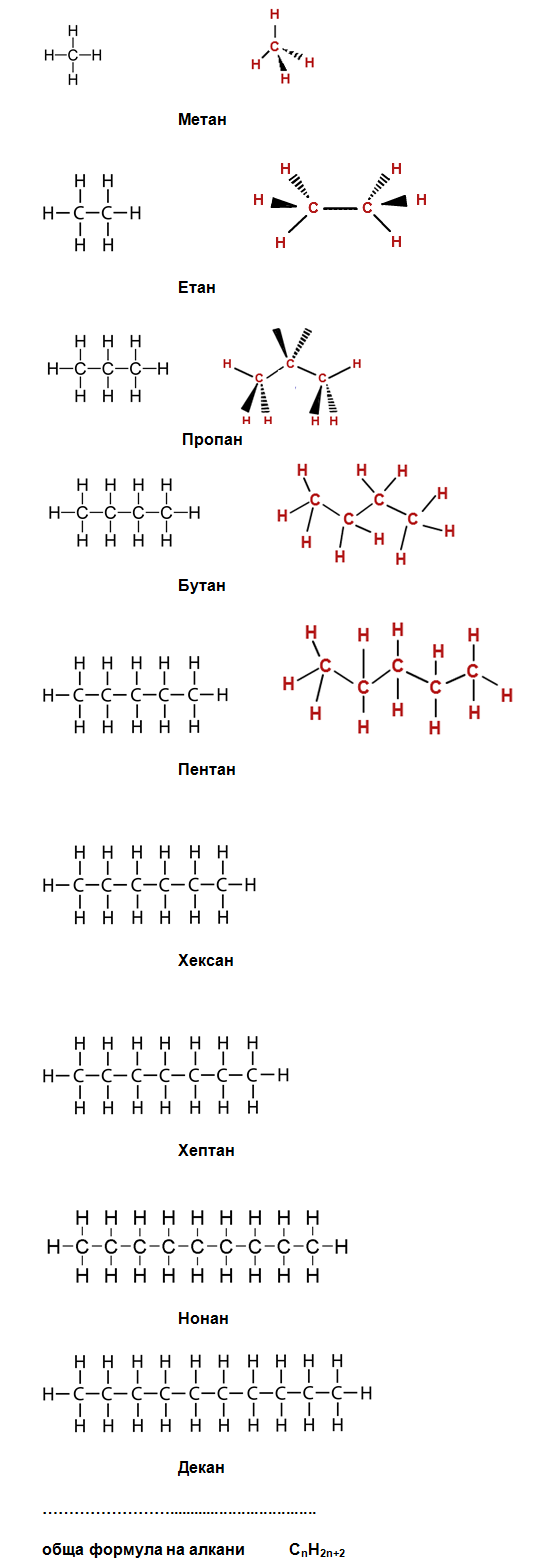
Алканите съдържат най-голям брой водородни (Н) атоми, което определя названието им наситени или пределни въглеводороди. Алканите са с най-малка реактивоспособност, сравнени с другите въглеводороди, поради което се наричат и парафини - от латински „parum affinis” – малко сродство.
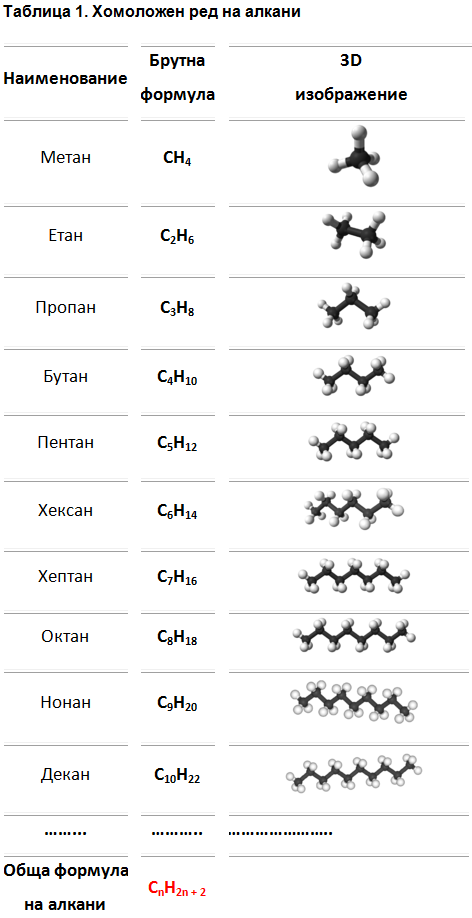
Наименованията на алканите се образуват по номенклатура IUPAC, с изключение на първите четири члена на хомоложния ред, които имат тривиални (случайни) наименования: СН4 - метан , С2Н6 - етан , С3Н8 - пропан и С4Н10 - бутан. IUPAC - International Union of Pure and Applied Chemistry, Международен съюз за чиста и приложна химия - международна неправителствена организация, подпомагаща прогреса в областта на химията. Занимава се с разработки и разпространение на стандарти в областта на наименованията на химическите съединения чрез международна комисия по номенклатура и обозначения. Член е на Международния съвет на науките (International Council for Science, ICSU).
СН3-СН2-СН2-СН2-СН2-СН3 хексан
СН3-СН2-СН2-СН2-СН2-СН2-СН3 хептан
Ред от съединения, които имат еднакъв качествен състав, притежават сходни химични свойства и всеки два члена се различават с една метиленова група (-СН2-), се нарича хомоложен ред. Съединенията се наричат хомолози, а явлението хомология (от гр. homos – еднакъв, подoбен). Алканите образуват хомоложен ред с бщата формула CnH2n+2. Всяка прибавена нова -СН2 група в молекулата на хомолозите, води до получаване на ново съединение, което има свойства различаващи се незначително от свойствата на предходния хомолог. Ако се отнеме един водороден атом от молекулата на алканите се получават алкилови радикали с обща формула CnH2n+1, които съществуват за много кратко време в свободно състояние.
метан СН4 – CH3 – метилов радикал
етан С2Н6 – C2H5 – етилов радикал
пропан С3Н8 – C3H7 – пропилов радикал
бутан С4Н10 – C4H9 – бутилов радикал
:
:
алкан CnH2n+2 – CnH2n+1 - алкилов радикал
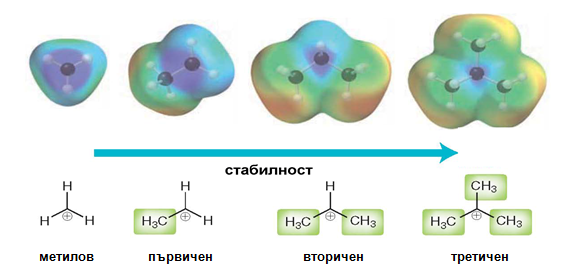
При образуване на алкилкарбокатиони тяхната стабилност нараства от първичен към третичен.
Пълното наименование на даден алкан се образува при спазване на следните правила:
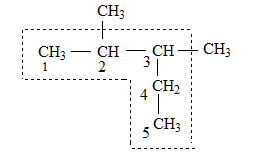
- най-дългата въглеродна верига (може и да не е права) се приема за главна, а свързаните към нея алкилови групи (R) се разглеждат като заместители;
- въглеродните атоми в главната верига се номерират с арабски цифри, като началото на веригата се избира така, че заместителите да получат най-малък пореден номер, напр. в написаната по-долу формула номерата на страничните заместители ще бъдат 2,3-диметил...., а не 3,4-диметил……
- с арабски цифри се посочват номерата на въглеродните атоми от главната верига,
- ако има няколко еднакви алкилови радикала, техният брой се означава чрез представките ди- (два заместителя), три- (три заместителя), тетра- (четери заместителя), пента- (пет заместителя), и т. н.;
- в случаите, когато два еднакви заместителя се намират при един и същи С-атом то номерация се поставя за всеки от тях:
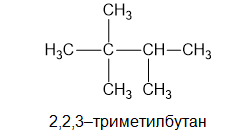
- При два или повече различни заместителя при номерирането те се подреждат по нарастване на тяхната сложност (метил-, етил-, пропил- и т.н.) или по азбучен ред (етил-, метил- и т.н.):
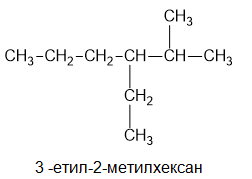
- След като се извършат всички предхождащи операции се определяне на названието на въглеводорода, което съответства на главната въглеродна верига.
II. МОЛЕКУЛЕН СТРОЕЖ НА АЛКАНИ

В молекулите на алканите всеки въглероден атом е в sp3-хибридно състояние и с по четири равностойни sp3-хибридни орбитали, образувани чрез хибридизация (смесване) на 2s- с 2px -, 2py – и 2pz - атомните орбитали на С-атом.Те се разполагат около ядрото на С-атом с обемистите части навън, под ъгъл 109о5’ във формата на правилен тетраедър.
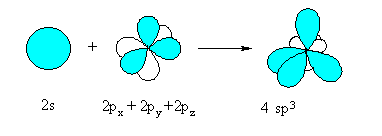
Фиг. 51. Sp3 хибридизация на С атом
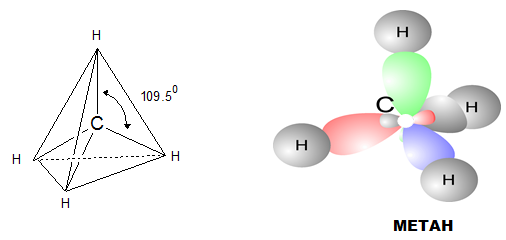
В молекулите на алканите въглеродните атоми са свързани чрез ковалентни прости σ-връзки помежду си и с водородните атоми. Въглеродният атом в молекулата на метана – първият член от хомоложния ред на алканите, е в центъра на правилен тетраедър с валентен ъгъл от 109ο5' . Четирите C-H връзки са напълно равностойни и са насочени към върховете на правилен тетраедър.
Алканите се наричат още наситени или пределни въглеводороди, тъй като С атоми в молекулите им са свързани с максимален брой водородни атоми. Връзките С–С σ- sp3-sp3 са практически неполярни, а С–Н σ-връзки са слабо полярни, поради факта, че електроотрицателността на С атоми в sp3 хибридно състояние е малка и е приблизително равна на електроотрицателността на Н атоми. В молекулата на метана σ-връзките С–Н (sp3-σ) са слабо полярни, но тетраедричното им разположение взаимно ги уравновесява и молекулата е неполярна. За разкъсване на s-връзка в метана е необходима значителна енергия (427 KJ/mol). За разкъсване на s С–С връзка в етана е необходима енергия 347 KJ/mol. Дължината на простата С–С σ-връзка е 0.154 nm т.е. тя е най-дългата σ-връзка в молекулата на алкана. Според стериохимичната теория на Вант Хоф и Льо Бел връзката между отделните тетраедрични sp3 С атоми в алканите се реализира с общ връх на тетраедрите. Въглеродната верига на пропана (С3Н8) е изградена от три тетраедъра свързани връх с връх.
III. ИЗОМЕРИЯ ПРИ АЛКАНИ

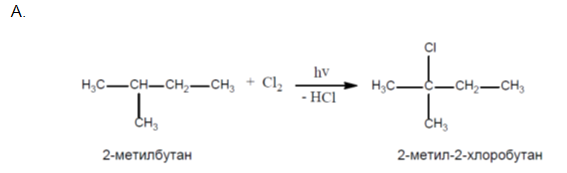
Съединения, които имат еднакъв качествен и количествен състав, но различен строеж, а от тук и различни свойства се наричат изомери, а явлението изомерия. Изомерията при алканите е структурна и пространствена. Структурната изомерията е открита от руският учен Бутлеров. Той установява, че има две съединения с емпирична формула С4Н10, които се различават по физични свойства (температурата на кипене):n-бутан, 2-метилпропан (изобутан). Структурната изомерия бива верижна, функционална и позиционна, а пространствената – геомертична и оптична.
III.1. ВЕРИЖНА ИЗОМЕРИЯ ПРИ АЛКАНИ
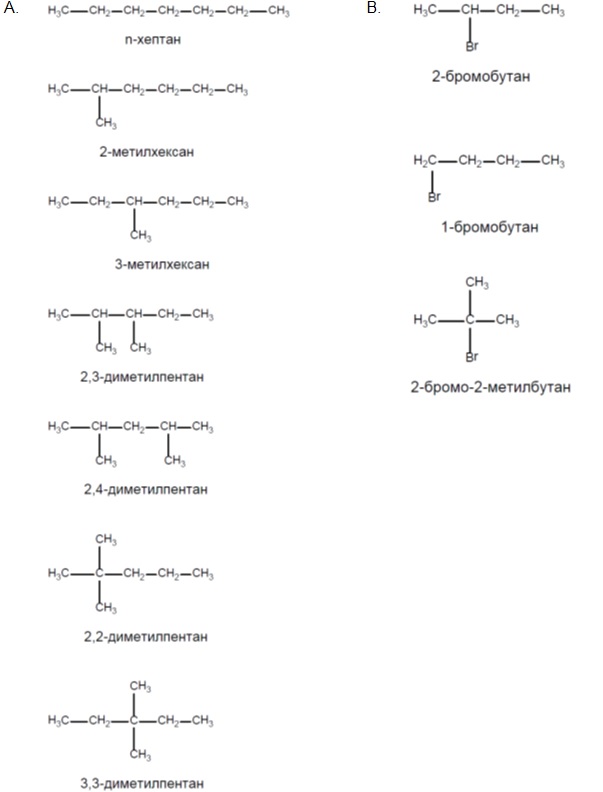
Характерна изомерия при алканите е верижната.Тя се наблюдава при алкани с четири и повече въглеродни атома и се дължи на способността на С атом да образува прави и разклонени вериги. При пентана (C5H12) са възможни три верижни изомера: n-пентан, 2-метилбутан и 2,2-диметилпропан:
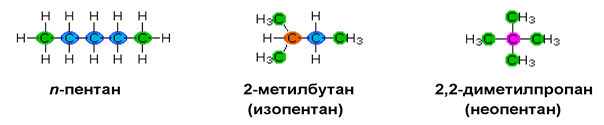
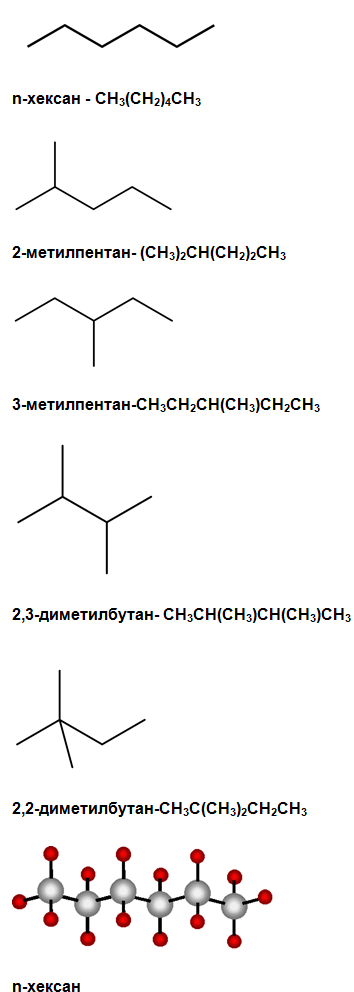
С увеличаване броят на С атоми в молекулата на алканите нараства и броят на възможните верижни изомери. При хексана (С6Н14) броят на възможните верижни изомери е 5, a при хептана – 9.
III.2. ОПТИЧНА ИЗОМЕРИЯ ПРИ АЛКАНИ
Когато в молекулата на даден алкан се съдържа асиметричен въглероден атом (*С) – въглероден атом с четири различни заместителя, възможна е и оптична (пространствена) изомерия. При наличие на един асиметричен въглероден атом в молекулата на дадено химично съединение енантиомерите (антиподите) са два. Те се различават по конфигурацията при *С атом (D, L) и по своята оптична активност. D- и L-конфигурациите се отнасят помежду си като предмет към огледален образ или както лявата към дясната длан. Проекционните формули на двата пространствени изомера на субституирания наситения въглеводород 2-хлоробутан могат да се представят по следния начин (фиг. 52):
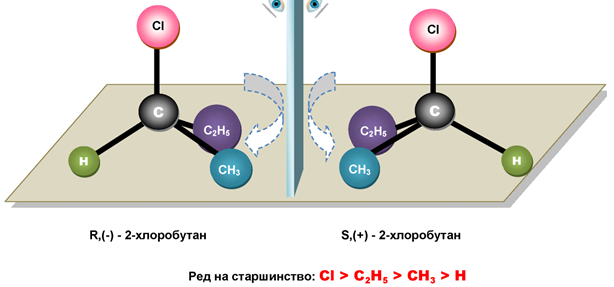
Фиг. 52. Оптични изомери D(-) и L(+)-2-хлоробутан
III.3. КОНФОРМАЦИОННА ИЗОМЕРИЯ ПРИ АЛКАНИ
Поради възможността за свободното въртене около простата С – С σ-връзка (два тетраедъра имат общ връх), при алканите е възможна и конформационна изомерия, която е вид пространствена изомерия. За разлика от останалите видове изомерии при конформационната не се променя конфигурацията и структурата на молекулата. Съществуват безброй възможности за пространствено разположение на Н-атоми при въртене около простата С – С σ-връзка. Различават се две гранични конформации на енергетично най-богатата и енергетично най-бедната молекулна структура:
-
Цисоидална (засенчена) конформация- Н-атоми са възможно най-приближени един до друг, съществува енергия на отблъскване между тях, конформерът е енергетично богат и следователно нетраен.
-
Трансоидна (затормозена) конформация - Н-атоми са най-отдалечени един от друг, при което енергия на отблъскване между тях е минимална, конформерът е енергетично най-беден и следователно най-стабилен, тъй като в природата се предпочитат енергитично бедните състояния.
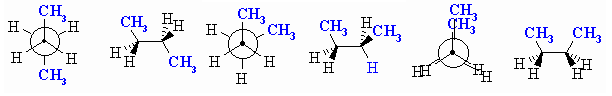
Конформационните изомери при етана (С2Н6) се различават по взаимното разположение на Н-атоми от двете метилови групи. На фиг. 53 са представени двата гранични конформера (цисоиден ъгъл между Н атоми е 0ο и трансоиден ъгъл между Н атоми е 60ο, които непрекъснато преминават един в друг, следователно всеки един от тях е моментно състояние на молекулата и може да се изобрази с формулите на Нюман:

Фиг. 53. Цисоидална и трансоидна конформации на етан
Освен представените на фиг. 53 две гранични конформации на етана, са възможни множество други междини конформации
Фиг.54. Моментни конформациионни изомери на бутан
Двата гранични конформера преминават един в друг чрез 60 градусово завъртане около простата σ С–С връзка. От графиката представена на фиг. 55 се вижда, че енергията на трансоидния конформер (60, 180, 300 градуса) е по-малка от тази на цисоидния.
Фиг. 55. Енергетични преходи при конформациите на етан
IV. ФИЗИЧНИ СВОЙСТВА

Физичните свойства на алканите с права въглеродна верига се изменят пропорционално с увеличаване на молекулните им маси (М). При стайна температура низшите алкани до С4 са газове, средните до С16- течности, а висшите след С17 постепенно се уплътняват до твърди вещества. Температурите на кипене и топене се повишават при нарастване на техните М, поради нарастване на междумолекулните сили. Като съединения с неполярни ковалентни σ-връзки, въглеводородите са практически неразтворими в полярни разтворители, каквато е водата, но се разтварят добре в неполярни разтворители. Някои от течните алканови въглеводороди са добри органични разтворители.
V. ХИМИЧНИ СВОЙСТВА

Названието парафини използвано за за наситените въглеводороди е свързано с тяхната инертност при обикновени условия, спрямо най-често използваните реагенти - киселини и основи. При подходящи условия обаче те участват в различни химични реакции.
Поради наличието на неполярни химични връзки в молекулите на наситените въглеводороди за тях са характерни заместителни реакции, при които Н атоми в молекулата им се заместват с атоми или атомни групи до получаване на съответните производни. Тези реакции протичат преимуществено по верижно-радикалов механизъм. Аканите участват и в крекинг процеси, при които се разкъсват С – С σ-връзки.
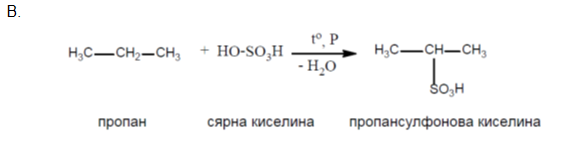
Взаимодействието с халогенни елементи (Х2) е типично за алканите и протича като заместителна реакция по верижно-радикалов механизъм - междинните продукти са радикали. Свободните радикали са частици, който се получават чрез отнемане на един или няколко атома от молекулите на дадено химично съединение. Свободните радикали са химически много реактивни частици, тъй като съдържат един или повече нездвоени електрони. Под халогениране на алкани се разбира взаимодействие с хлор или бром, тъй като флуорът е много активен и деструктира алканите:

Йодът поради малката си активност, практически не реагира с алканите. При облъчване с пряка слънчева светлина хлорът, също като флуорът може да деструктира алканите, като реакцията протича експлозивно. Ако в цилиндър се смесят метан и хлор и се оставят на тъмно, жълтозеленият цвят на сместа не се променя - метанът не взаимодейства с хлор на тъмно. Ако същата смес се остави на слънчева светлина, тя се обезцветява – доказателство, че хлорът взаимодейства с метана. Заместването на Н атоми с халогенни елементи може да се извърши до различна степен. При нискомолекулните алкани халогенирането протича до пълно заместване на водородните с халогенни атоми и реакционният продукт е смес от халогенопроизводни: хлорометан, дихлорометан, трихлорометан (хлороформ) и тетрахлорометан.
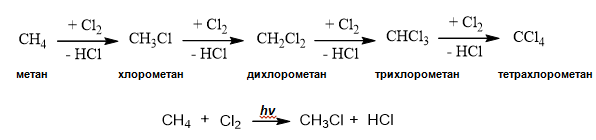

Реакцията на халогениране на алкани протича по верижно-радикалов механизъм на няколко етапа:
- иницииране на реакцията
При облъчване с разсеяна слънчева светлина (иницииране) хлорната молекула се разкъсва хомолитично до два активни хлорни радикала:
- верижна реакция
Хлорният радикал атакуват молекулата на алкана (СН4) и полученият метилов радикал (●СН3) реагира с нова молекула хлор. Получава се реакционен продукт СН3Сl (метил хлорид) и нов хлорен радикал, който реагира с нова молекула СН4 или СН3Сl и продължава верижния процес до пълно заместване на водородните атоми с хлорни и получаване на тетрахлорометан като краен реакционен продукт.
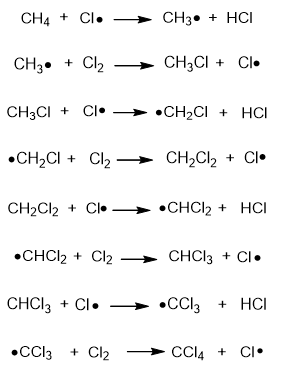
- прекъсване на веригата
Верижната реакция може да се прекъсне при случаен сблъсък на два радикала в резултат на което се получава стабилен реакционен продукт.
При алкани с разклонени вериги най-лесно се заместват Н атоми с халогенни при третичен С атом, след това - при вторичен и накрая при първичен.
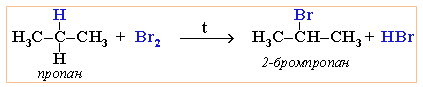
V.2. ЗАМЕСТИТЕЛНИ РЕАКЦИИ С МИНЕРАЛНИ КИСЕЛИНИ ПРИ НАГРЯВАНЕ
- Нитриране (12% HNO3 )- реакция на Коновалов
Концентрираната HNO3 действа оксидативно на алканите. Руският химик Коновалов е открил, че заместването на Н-атоми с нитрогрупа (–NO2) в молекулите им се извършва с разредена (12%) HNO3, при нагряване и под налягане. В органичната химия реакцията е известна като реакция на Коновалов. Нитрирането се извършват най-лесно при третичен, по-трудно при вторичен и най-трудно при първичен С атом.
-
Сулфониране (взаимодействие със H2SO4)
Сулфорирането се провежда при висока температура с димяща H2SO4, като при тази реакция Н атоми в молекулата на алкана се заместват със сулфо група (SO3H). Най-лесно протича заместването на водородни атоми свързани с третичен, по-трудно - при вторичен, а най-трудно при първичен въглероден атом.
Получените съединения се наричат алкансулфонови киселини и се използват за производство на повърхностно активни вещества (ПАВ).
V.3. ДЕСТРУКЦИЯ
При висока температура (»1000оС) в отсъствие на кислород метанът се разлага:
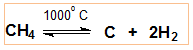
V.4. ОКСИДАЦИЯ
При обикновени условия алканите са устойчиви на оксиданти като бромна вода, калиев перманганат и др. Чрез тези качествени реакции могат да се различат парафините от ненаситените въглеводороди (алкени и алкини).
- Деструктивна оксидация-горене
Запалени в присъствие на въздух алканите горят. Реакцията е силно екзотермична (+ Q) и при пълно горене като крайни продукти се получават СО2 и вода:
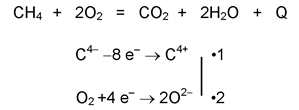
Фиг. 56. Горене на метан
- Умерена оксидация
Освен деструктивна при алканите е възможна и умерена оксидация в присъствие на катализатори и по-ниски температури - 100-160 оС. Умерената оксидация на алканите има практическо приложение – междинните реакционни продукти, които се получават са алкохоли и алдехиди, а крайните реакционни продукти са карбоксилови киселини.
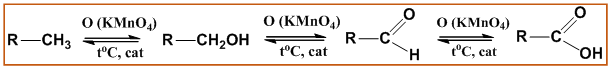
При пропускане на О2 през алкани с дълга С верига (течни парафини) в присъствие на катализатори (KMnO4, K2Cr2O7) крайните реакционни продукти, които се получават са смеси от карбоксилови киселини. При умерена оксидация на хейкозан (С21Н44) се получава смес от нонанова и деканова киселини:
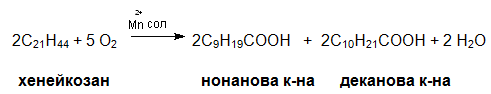
Един от перспективните методи за получаване на етанова (оцетна) киселина е пряка каталитична оксидация на бутан:
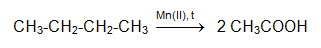
V.5. ДЕХИДРОГЕНИРАНЕ НА АЛКАНИ
Дехидрогенирането(елиминирането на водород) на алкани е метод за получаване на алкени и протича в присъствие на катализатори никел (Ni) или паладий (Pd). Чрез дехидрогениране на пропан при каталитично нагряване около 700○С промишлено се получава етен:
Фиг 57. Каталитично дехидрогениране на пропан
При дехидрогениране на бутан (700○С, Ni/Pd) се получават два реакционни продукта: 1-бутен и 2-бутен, като основният продукт е 2-бутен, тъй като молекулата е с по-голяма симетрия и следователно енергитично по-бедна.
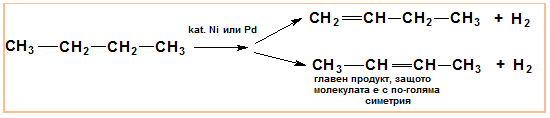
V.6. ЦИКЛИЗАЦИЯ
Алкани с въглеродна верига С6 и С7 атома при нагряване и в присъствие на катализатори, образуват пръстенни въглеродни вериги (циклизират) с отделяне на водород.
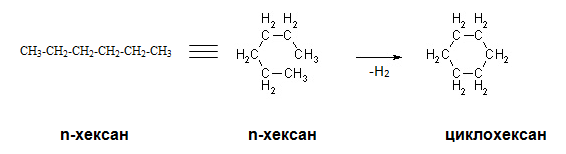
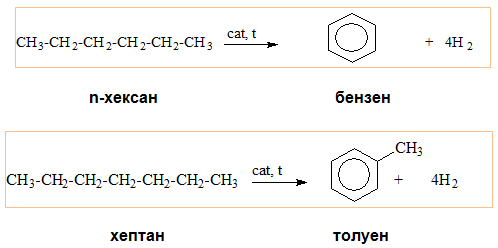
V.7. ДЕХИДРОЦИКЛИЗАЦИЯ (РИФОРМИНГ ПРОЦЕС)
Циклизацията на алкани протича паралелно с дехидрогениране и процесът се означава като ароматизация – получават се ароматни въглеводороди. В химичната технология процесът се нарича риформинг (reforming). Риформингът протича в присъствие на катализатор платина (Pt).
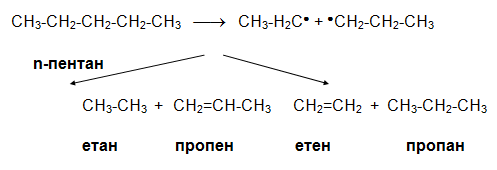
V.8. КАТАЛИТИЧЕН КРЕКИНГ (ПИРОЛИЗА)
Каталитичният крекинг т.н. пиролиза е процес, при който от висшите алкани при нагряване (450-650 оС) в присъствие на катализатори (природни алумосиликати, Al2O3, AlCl3, SiO2) чрез разкъсване на въглеродната верига се получава смес от по-нисши въглеводороди - алкани, които частично се дехидрогенират до алкени и алкини. Паралелно с каталитичния крекинг протичат и реакции на изомеризация, циклизация и др.
Крекинг-процесът се използва при обработката на тежки нефтени фракции, от които се получават леки фракции (смес от наситени и ненаситени по-нискомолекулни въглеводороди). Леките фракции след разделяне се използват като горива, продукти за органичния синтез и др.
VI. ПОЛУЧАВАНЕ НА АЛКАНИ

За получаване на алкани се използват природни източници - нефт и газ. Големи залежи на природен газ се намират в Русия и САЩ, а нeфт - в Близкия Изток, Иран, Ирак, Северно море, Казахстан, САЩ и др. Нефтът от различните находища има различен състав - в някои нефтени находища преобладават парафини и циклопарафини, а в други - ароматни въглеводороди. Разделянето на тези въглеводородни смеси се извършва чрез фракционна дестилация. Получафат се фракции, които представляват смеси от близко кипящи въглеводороди. Алканови въглеводороди се получават и по различни синтетични методи.
VI.1. СИНТЕЗ НА ВЮРЦ
Синтезът на Вюрц се базира на взаимодействие наалкилхалогениди (RX) с метален натрий при слабо загряване в среда от безводен етер и води до получаване на по-дълговерижни алкани.
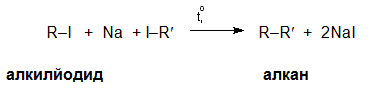
Чрез синтез на Вюрц се получават три реакционни продукта - един основен (R-R') и два странични (R-R и R'-R').
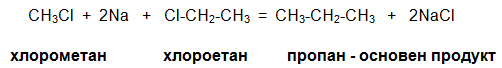
Странични продукти при последната реакция са CH3-CH3 (етан) и CH3CH2CH2CH3 (бутан). Чрез синтеза на Вюрц се получават странични продукти, когато броят на въглеродните атоми в алкиловия радикал Rе различен от този в радикала R¢. Синтезът наВюрц може да се извърши и с алкилхалогениди, съдържащи различни халогенни атоми (напр. хлор и бром). В този случай освен основния продукт се получават и две различни молекули натриев халогенид (напр. натриев хлорид и натриев бромид).
CH3Br + 2Na + Cl-CH2-CH3 = CH3-CH2-CH3 + NaCl + NaBr
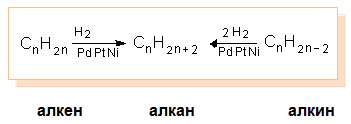
VI.2. КАТАЛИТИЧНО ХИДРОГЕНИРАНЕ НА АЛКЕНИ, АЛКИНИ
При каталитично хидрогениране на арени се получават циклоалкани т.н. при хидрогениране на бензен в присъствие на катализатор никел се получава циклохексан:
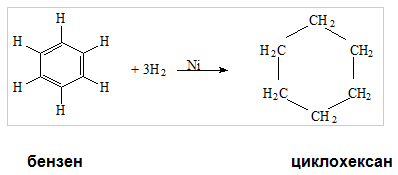
VI.3. РЕДУКЦИЯ НА АЛКИЛХАЛОГЕНИДИ
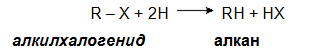
където Х е халогенен елемент - хлор, бром.
VI.4. ДЕКАРБОКСИЛИРАНЕ НА КАРБОКСИЛОВИ КИСЕЛИНИ ПРИ НАГРЯВАНЕ
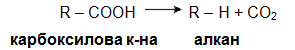
VI.5. РЕДУКЦИЯ НА АЛКОХОЛИ С ЙОДОВОДОРОД
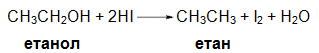
VII. ПРЕДСТАВИТЕЛИ

 Метан (СН4)Познати са различни методи за получаване на метан.
Метан (СН4)Познати са различни методи за получаване на метан.
- Получаване на метанпри хидриране на въглероден оксид (от воден газ), при температура 200-300 оС и катализатор никел (Ni) :
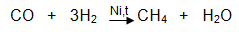
- Получаване на метанчрез директен синтез от въглерод и водород при температура около 500 оС и катализатор Ni. Този метод има само теоретично значение. За промишлени цели метан се добива от природен газ.
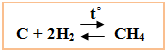
- Лабораторен метод за получаване на метан от алуминиев карбид (Al4C3) и вода:
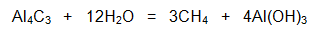
VIII. РАЗПРОСТРАНЕНИЕ И УПОТРЕБА


Алканите са разпространени в природата органични съединения.Те са съставна част на нефта и природния газ.
Нискомолекулните алкани (метан) са основна съставна част на земния газ. Метан има и в каменовъглените мини, а е открит и в атмосферата на планетата Сатурн. Газът СН4 се отделя и от блатата, където се получава при гниенето на растителни отпадъци в анайробни (отсъствие на кислород) условия, затова той се нарича още блатен газ. В състава на нефта има най-много течни алкани, но и газообразни и твърди, които са разтворени в течните алкани. За промишлените нижди от въглеводороди се използва нефт и газ. Големи залежи на природен газ се намират в Русия и САЩ, а нeфт - в Близкия Изток, Иран, Ирак, Северно море, Казахстан, САЩ и др.
Нефтът от различните находища е с различен състав. В едни нефтени находища преобладават парафини и циклопарафини, а в други – арени (ароматни въглеводороди). Тези въглеводороди се разделят чрез фракционна дестилация на смеси, които представляват фракции от близкокипящи въглеводороди.
- Алканите влизат в сътава на горивата - бензин, газьол и мазут.
- Алканите са изходна суровина за получаване на другите класове органични съединения като халогенопроизводни, алкохоли, алдехиди, карбоксилови киселини и др.
- Поради слабата си химическа реактивоспособност те не взаимодействат с алкални метали. Поради което последните се съхраняват под петрол, за да се предпазят от оксидация.
- Алкановите въглеводороди се използват за гориво на двигателите с вътрешно горене и за смазочни масла.
- Друго приложение алканите намират при производството на синтетични миещи средства, рзтворители и полупродукти на органичния синтез.
- Метанът се използва в химическата промишленост за получаване на ацитилен( етин, C2H2) и H2; синтезен газ (CO + H2) – изходна суровина за ценни органични съединения.
- Халогенопроизводни на алканите: етилхлорид (C2H5Cl) и трихлорометан (хлороформ) се използват в медицината и денталната медицина като упойки.
- Халогенопроизводните на метана се използват като фреони и органични разтворители.
КЛЮЧОВИ ПОНЯТИЯ
асиметричен (хирален) С-атом - въглероден атом, който е свързан с четири различни вида атоми или групи от атоми
въглеводороди - органичните съединения, изградени от въглеродни и водородни атоми свързани чрез прости σ С–С и σ С–Н връзки
изомери - химични съединения с еднакъв качествен и количествен състав, но различно разположение на атомите в молекулата; обикновено се различават по физични свойства, по някои химични свойства и по биологичната си активност
изомерия - явление, изразяващо се в съществуване на изомери
каталитичен крекинг - процес, при който от висшите алкани при нагряване (450-650оС) в присъствие на катализатори (природни алумосиликати, Al2O3, AlCl3, SiO2) чрез разкъсване на въглеродната верига се получава смес от по-нисши въглеводороди - алкани, които частично се дехидрогенират до алкени и алкини.
ПАВ - повърхностно активни вещества
парафини - наситените въглеводороди
пиролиза - виж каталитичен крекинг
реакция на Коновалов - реакция на нитриране на алкани с разредена (12%) HNO3, при нагряване и под налягане.
риформинг - процес на циклизация на алкани при катализатор Pt с паралелно дехидрогениране, при който се получават ароматни въглеводороди
свободни радикали - химически много реактивни частици, които съдържат един или повече несдвоени електрони
синтез на Вюрц - взаимодействие наалкилхалогениди (RX) с метален натрий при слабо загряване в среда от безводен етер, при което се получават по-дълговерижни алкани.
трансоидна (затормозена) конформация - конформация, при която Н-атоми са най-отдалечени един от друг, при което енергия на отблъскване между тях е минимална, конформерът е енергетично най-беден и следователно най-стабилен, тъй като в природата се предпочитат енергетично бедните състояния.
хомолитично разкъсване - симетрично разкъсване на химична връзка
хомология - явление, изразяващо се в съществуването нагрупа от органични химични съединения, които имат еднакъв качествен, но различен количествен състав, различават се помежду си с една или няколко метиленови групи, имат сходен строеж, сходни химични свойства, правилно изменящи се физични свойства и общ метод за получаване.
хомоложен ред - група от органични химични съединения, които имат еднакъв качествен, но различен количествен състав, различават се помежду си с една или няколко метиленови групи, имат сходен строеж, сходни химични свойства, правилно изменящи се физични свойства и общ метод за получаване. Отделните съединения се наричат хомолози, групи а явлението - хомология.
хомолози - отделнихимични съединения в един хомоложен ред.
цисоидална (засенчена) конформация - конформация, при която Н-атоми са възможно най-приближени един до друг, съществува енергия на отблъскване между тях, конформерът е енергетично богат и следователно нетраен.
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
- Общата молекулна формула на алканите е:
A. CnH2n
B. CnH2n+2
C. CnHn
D. CnH2n-2
Отговор
- Въглеродните атоми в молекулата на 2,2,4-триметилпентанът са:
A. 2 първични,1 вторичен,1 третичен и 1 четвъртичен
B. 3 първични,1 третичен и 1 четвъртичен
C. 5 първични,1 третичен и 1 четвъртичен
D. 5 първични,1 вторичен,1 третичен и 1 четвъртичен
Отговор
- От посочените съединения наситени халогенопроизводни са:
A. C6H12Br2;
B. C6H8Br2;
C. C6H13Br;
D. C6H9Br.
Отговор
- Напишете възможните изомери на:
А. хептан;
B. 2-бромобутан.
Отговор
- Посочете междинните и крайни продукти, които се получават при умерена оксидация на етан в присъствие на катализатор и температура около100-160оС. Напишете химичната реакция.
- Въглеводородът 2-етил-3,3-диметилхексан е изомер на въглеводорода с права верига:
Отговор
A. нонан
B. декан
C. октан
D. липсва верен отговор.
Отговор
- Изразете с химични уравнения следните взаимодействия:
А. хлориране на 2-метилбутан;
B. сулфониране на пропан;
С. дехидрогениране на пентан;
D. горене на етан.
Отговор
- При взаимодействие на смес от йодометан и 2-йодо-2-метилпропан с натрий се получава:
A. 2,2-диметилпропан
B. 2-метилбутан
C. етан, 2,2-диметилпропан, 2,2,3,3-тетраметилбутан
D. 2,3-диметибутан, етан, 2,2-диметилпропан
Отговор
- 2,3-Диметилбутан като единствен продукт може да се получи чрез синтеза на Вюрц от натрий и:
A. хлорометан и хлоропентан
B. 2-хлоропропан
C. 1-хлоропропан
D. 2-хлоропропан и 1-хлоропропан
Отговор
- Кои са продуктите, които се получават при каталитичен крекинг (Т 450-650оС; катализатори - Al2O3, AlCl3, SiO2) на хептан C7H16?
Отговор