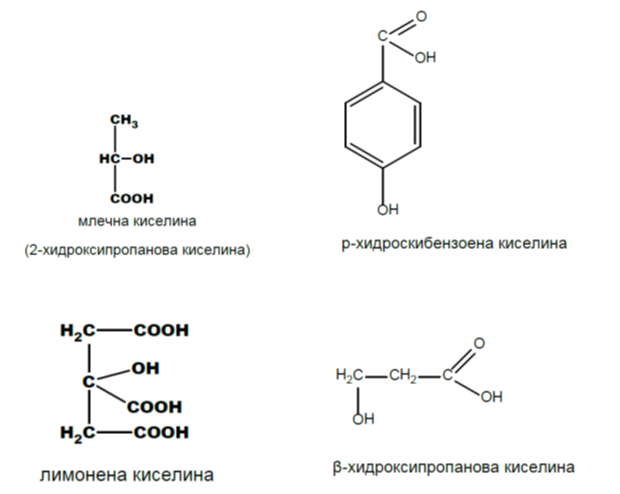
ХИДРОКСИKАРБОКСИЛОВИ КИСЕЛИНИ
I. ОПРЕДЕЛЕНИЕ, КЛАСИФИКАЦИЯ, НОМЕНКЛАТУРА

I.1. ОПРЕДЕЛЕНИЕ
I.2. КЛАСИФИКАЦИЯ
- В зависимост от вида на въглеводородния остатък, с който е свързана карбоксиловата група
- В зависимост от броя на -COOH и -ОН групите:
 алифатни (хидроксиалканови) - алифатни хидроксикарбоксилови киселини, в молекулите на които един или повече Н-атоми са заместени с ОН-групи:
алифатни (хидроксиалканови) - алифатни хидроксикарбоксилови киселини, в молекулите на които един или повече Н-атоми са заместени с ОН-групи:
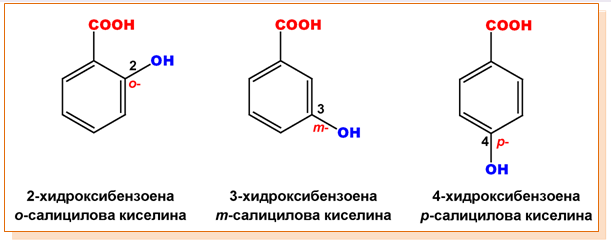
 ароматни (фенолни, хидроксиаренови) - ароматни хидроксикарбоксилови киселини, в молекулите на които един или повече Н-атоми от бензеновия пръстен са заместени с ОН-групи:
ароматни (фенолни, хидроксиаренови) - ароматни хидроксикарбоксилови киселини, в молекулите на които един или повече Н-атоми от бензеновия пръстен са заместени с ОН-групи:
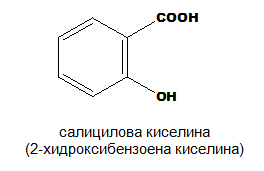
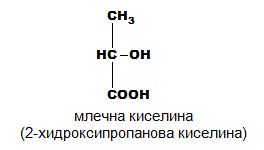
 монохидроксимонокарбоксилови: млечна киселина, салицилова киселина
монохидроксимонокарбоксилови: млечна киселина, салицилова киселина

 дихидроксимонокарбоксилови:
дихидроксимонокарбоксилови:
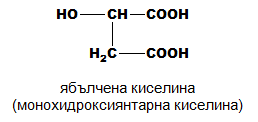
 монохидроксидикарбоксилови:
монохидроксидикарбоксилови:
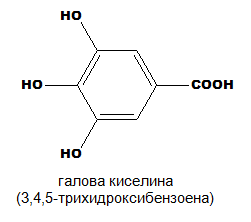
 трихидроксимонокарбоксилови:
трихидроксимонокарбоксилови:
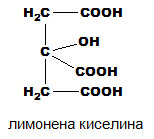
 монохидрокситрикарбоксилови:
монохидрокситрикарбоксилови:
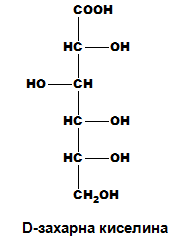
 полихидроксиполикарбоксилови:
полихидроксиполикарбоксилови:
I.3. НОМЕНКЛАТУРА
Наименованията на хидроксикиселините се образуват с представката хидрокси-. Мястото на OH−групата по отношение на карбоксиловата се отбелязва с цифра (по IUPAC) или с буква от гръцката азбука (при тривиалните наименования), като −COOH групата е “старша”, т.е C-атом от −COOH групата получава номер “1”.
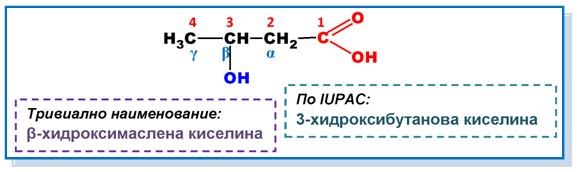
II. ИЗОМЕРИЯ

II.1. ПОЗИЦИОННА ИЗОМЕРИЯ
При хидроксикарбоксиловите киселини тя се дължи на различното взаимно разположение на −ОН и −COOH функционалните групи:
II.2. ОПТИЧНА ИЗОМЕРИЯ
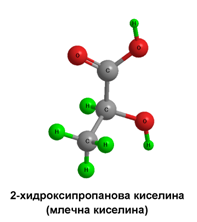
Молекулите на всички α-хидроксикарбоксилови киселини, освен гликоловата, съдържат асиметрични (хирални) въглеродни атоми (С*), което определя тяхната оптическа активност. Такива молекули могат да съществуват в две пространствено изомерни форми, наречени енантиомери, оптични изомери или оптични антиподи, които се отнасят една спрямо друга като предмет и огледалния му образ.
Например при млечната и ябълчената киселина, според D-/L-системата (правилата на Фишер), са възможни два оптични изомера:
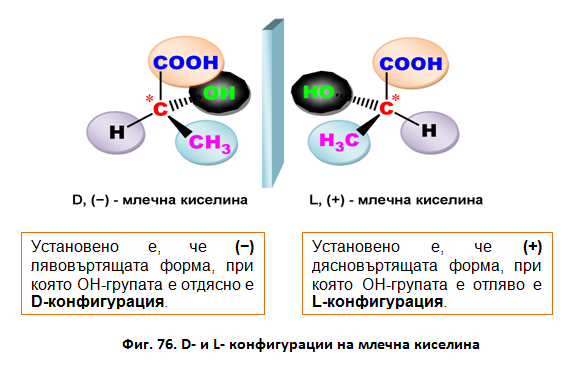
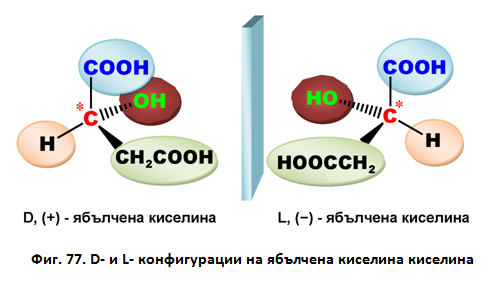
Според R-/S-системата (правила на Кан-Инголд-Прелог) енантиомерите на млечната киселина са съответно R-млечна киселина и S-млечна киселина. И двата оптични изомера представляват твърди вещества, а рацемичната смес е течност.
Фиг. 78. Енатиомери на млечна киселина
Редът на старшинство на заместителите при млечната киселина е следният:
OH > COOH > CH3 > H
III. МОЛЕКУЛЕН СТРОЕЖ

При хидроксикарбоксиловите киселини ОН-групата/ите привличат електроните от σ-връзката с въглеродния атом, с който са свързани, в резултат на което карбоксилатният анион става по-стабилен, а хидроксикарбоксиловата киселина по-силна от съответната карбоксилова киселина:
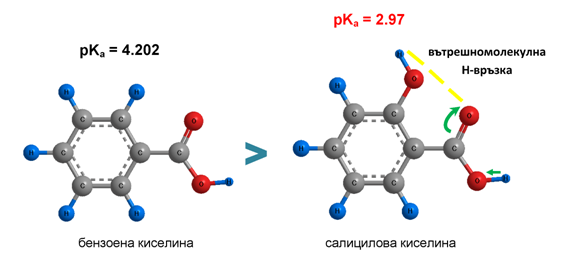
Салициловата киселина, която е ароматна хидроксикарбоксилова киселина, е по-силна от бензоената киселина, поради вътрешно молекулното взаимодействие на −COOH и разположената на о-място −OH група. Вътрешномолекулната Н-връзка ( Тема 4: Междумолекулни сили и връзки. Водородна връзка, т. II.1. Вътрешномолекулна водородна връзка) усилва поляризацията на връзката О−Н в −COOH група:
IV. ФИЗИЧНИ СВОЙСТВА

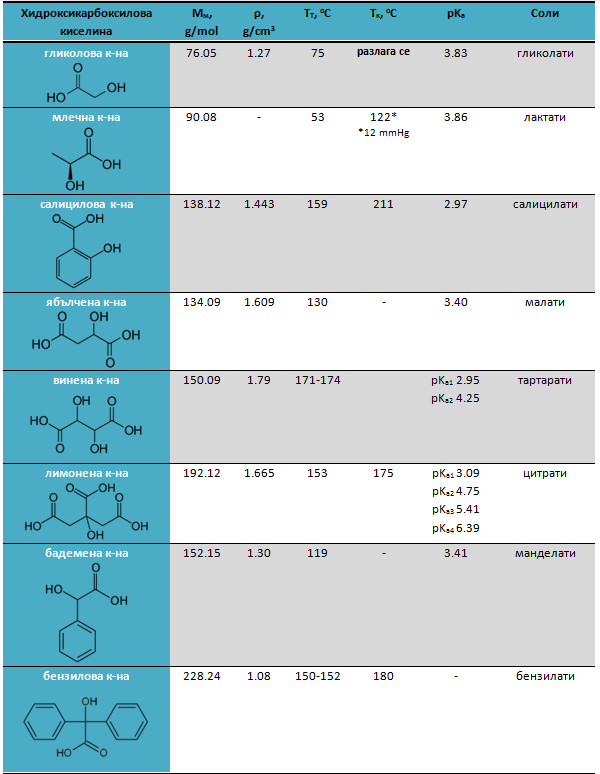
Таблица 11. Физикохимични свойства на хидроксикарбоксилови киселини
V. ХИМИЧНИ СВОЙСТВА

V.1. РЕАКЦИИ, ХАРАКТЕРНИ ЗА −COOH ГРУПАТА
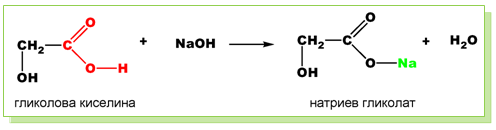
- Неутрализация - при взаимодействието на хидроксикарбоксиловите киселини с алкални хидроксиди се отделя вода и се получават соли:
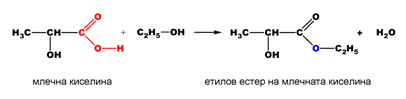
- стерификация
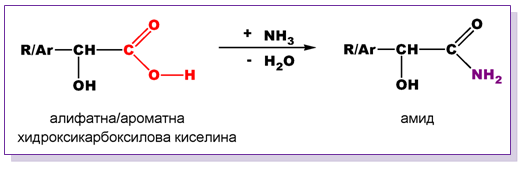
- Реакции с нуклеофилни реагенти
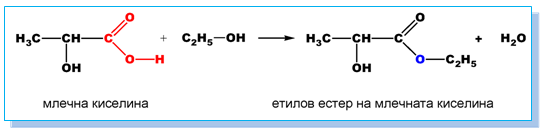
При взаимодействие на хидроксикарбоксилови киселини с NH3 се получават амиди и се отделя вода:

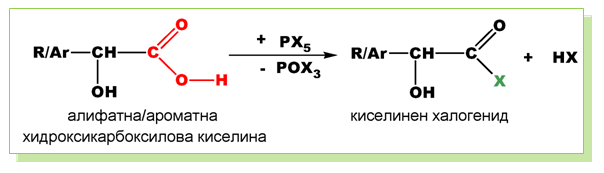
V.2. РЕАКЦИИ, ХАРАКТЕРНИ ЗА −OH ГРУПАТА
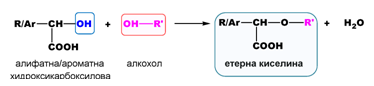
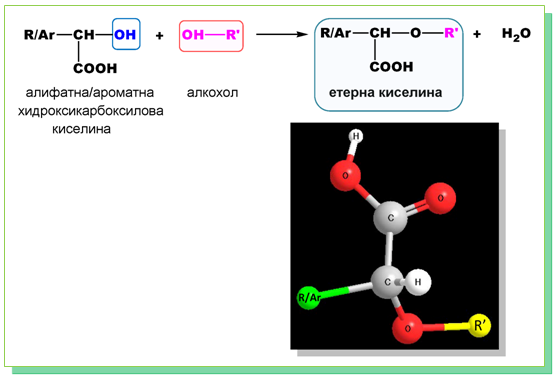
- Взаимодействие с алкохоли
- Взаимодействие с карбоксилови киселини
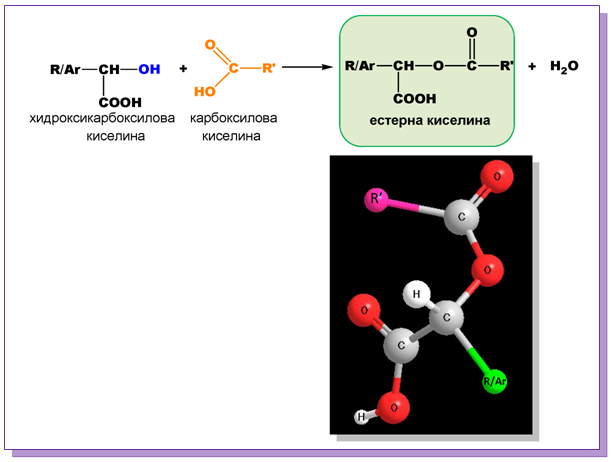
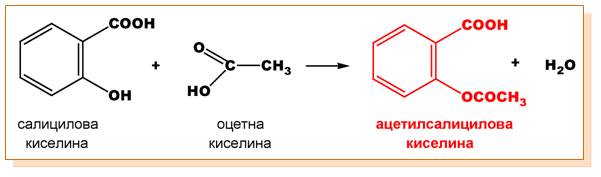
При естерификация на салицилова киселина с оцетна киселина се получава ацетилсалицилова киселина - аспирин:
На практика аспирин се синтезира чрез естерификация на салицилова киселина и оцетен анхидрид (или ацетилхлорид):

V.3. СПЕЦИФИЧНИ РЕАКЦИИ С ЕДНОВРЕМЕННОТО УЧАСТИЕ НА −COOH И −OH ГРУПИ
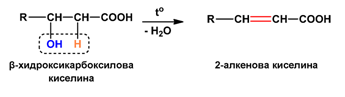
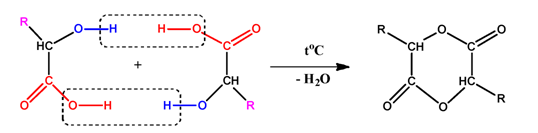
Хидроксикиселините се дехидратират при нагряване. В зависимост от взаимното разположение на −COOH и −OH функционалните групи се получават лактиди, лактони и α,β-ненаситени карбоксилови киселини.
- При α-хидроксикарбоксиловите киселини при нагряване в резултат на междумолекулно обезводняване се получават шестатомни циклични естери - лактиди:
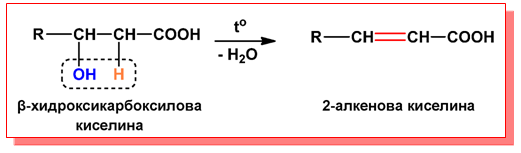
- При β-хидроксикарбоксиловите киселини при нагряване в резултат на вътрешномолекулно обезводняване се получават α,β-ненаситени карбоксилови киселини:
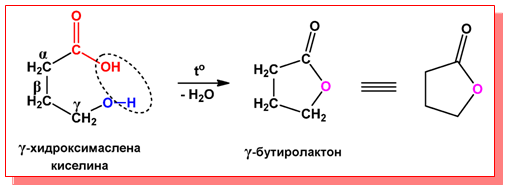
- При γ- и δ-хидроксикарбоксиловите киселини при нагряване в резултат на вътрешномолекулно обезводняване (още при обикновена температура) се получават трайни пет- и шестатомни циклични естери - лактони:
V.4. МЕЖДУМОЛЕКУЛНА КОНДЕНЗАЦИЯ НА АРОМАТНИ ХИДРОКСИКАРБОКСИЛОВИ КИСЕЛИНИ
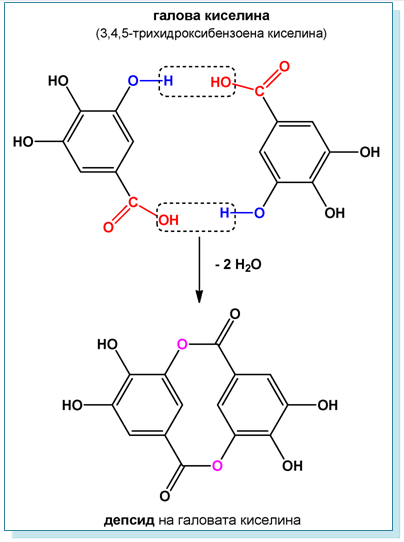
В резултат на междумолекулната кондензация на фенолни хидроксикарбоксилови киселини се получават съединения наречени депсиди, които са съставна част на танините.
Например в резултат на междумолекулна кондензация на две молекули галова киселина се получава депсид на галовата киселина, който под формата на елагова киселина влиза в състава на някои хидролизиращи се танини, характеризиращи се с кръвоспиращо действие.
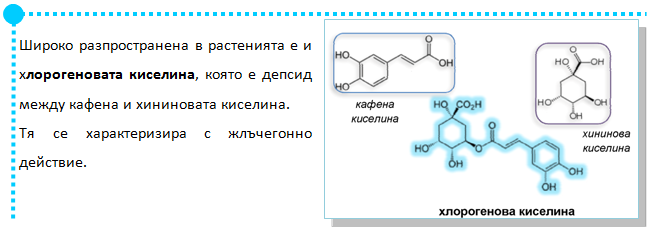

V.5. ПОЛИМЕРИЗАЦИОННИ РЕАКЦИИ
В резултат на полимеризацията на две хидроксикарбоксилови киселини - млечна и гликолова, се получава биоразградим полимер, известен под търговското наименование Lactomer.
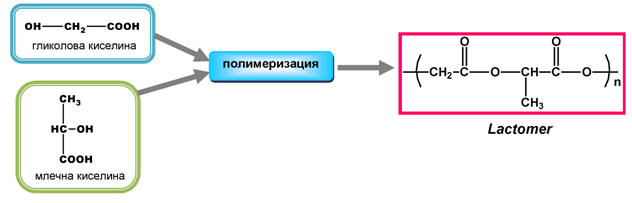
Този биополимер се използва за производството на хирургични скоби и други консумативи, които няколко седмици след поставянето започват да хидролизират до изходните киселини, които естествено се съдържат в човешкото тяло.
VI. БИОЛОГИЧНО ЗНАЧЕНИЕ НА ХИДРОКСИКАРБОКСИЛОВИТЕ КИСЕЛИНИ

- Млечна киселина - CH3-CH(OH)-COOH
- Салицилова киселина - C6H4(OH)-COOH
- Ябълчена киселина - HOOC-CH(OH)-CH2-COOH
- Винена киселина - HOOC-CH(OH)-CH(OH)-COOH
- Лимонената киселина (2-хидроксипропан-1,2,3-трикарбоксилова киселина)
- Бадемена киселина - C6H5-CH(OH)-COОH
Млечната киселина (2-хидроксипропанова киселина) е хидроксикарбоксилова киселина, която участва в някои биохимични процеси. Тя има два оптични изомера: L,(+)-млечна киселина или (S)-млечна киселина, и D,(-)-млечна киселина или (R)-млечна киселина. Биологически важният изомер е L,(+)-млечната киселина. L-лактат се получава от пируват чрез ензима лактат дехидрогеназа (ЛДХ) във ферментационен процес. Лактат се произвежда постоянно в процеса на нормалния метаболизъм и физическа активност. Ферментация на млечната киселина се извършва и от бактериите Lactobacillus. Те могат да действат в устата. Киселината, която произвеждат, е причина за увреждането на зъбите, наречено кариес. В медицината лактатът е една от главните състваки на рингеровия лактат. Тази интравенозна течност се състои от натриев йон, хлорид, калиев йон и лактат разтворени в дестилирана вода с такава концентрация, че да бъде изотоничен спрямо човешката кръв. Той се използва най-често за реанимация след загуба на кръв поради травма, хирургическа операция или изгаряне.

Салициловата киселина (2-хидроксибензоена киселина) е изолирана за пръв път от кората на върба (salyx alba), откъдето произлиза тривиалното ѝ наименование. От нея североамериканските индианци са правели лекарства срещу главоболие. Салициловата киселина има антисептични и бактерицидни свойства, предотвратява протичането на гнилостни процеси и затова се използва като консервант в хранителната промишленост и в домакинството. Нейните производни — естери, соли и други, намират широко приложение в медицината. Особено голямо е приложението на ацетилсалициловата киселина (аспирин) и фенилсалицилата (лекарството салол).
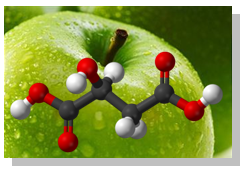
В свободно състояние, или под формата на соли (малати) ябълчената киселина (хидроксиянтарна киселина, 2-хидроксибутандиова киселина) се намира в ябълки, киселици, вишни, и други плодове. Като никотинова сол се съдържа в тютюна и махорката. В природата се среща L,(-)-изомерът, който придава приятния кисел вкус на неузрелите плодове. Малатът е междинен продукт в цикъла на Кребс и глиоксалатния цикъл при обмяната на веществата в организмите. Ябълчената киселина намира приложение в органичния синтез, в медицината и др. Използва се като хранителна добавка (Е296) при производството на безалкохолни напитки и сладкарски изделия.
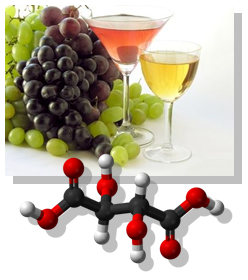
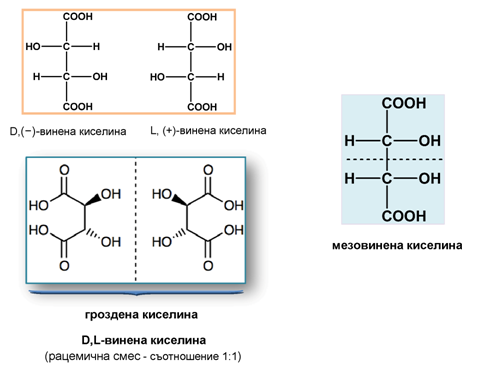
Винената киселина (2,3-дихидроксибутандиова киселина) съдържа в молекулата си два равностойни асиметрични С-атома, образува два оптични изомера: D,(−)- и L,(+)-винена киселина и две рацемични смеси: гроздена киселина и мезовинена киселина. Последната е оптично неактивна поради наличието на вътрешномолекулна симетрия. Винена киселина е получена за първи път от калиев тартарат, познат в древността като винен камък (още тригия, тартар), около 800 г. от персийския алхимик Джабир ибн Хаян. Тя се съдържа естествено в много растения, особено грозде и тамаринд, и е една от основните киселини във виното. Добавя се към други храни, за да им придаде кисел вкус и се използва като антиоксидант. Солите на винената киселина се наричат тартарати. В природата се среща L,(+)-винената киселина.

Лимонената киселина - COOH-CH3-C(OH)(COOH)-CH3-COOH, е монохидрокси-трикарбоксилова киселина, съдържаща се в цитрусовите плодове. Тя е естествен консервант и се използва също за придаване на кисел вкус на храни и напитки
В биохимията тя е важен посредник в цикъла на Кребс и поради това участва в метаболизма на почти всички живи същества. Използва се и като екологичен почистващ препарат и действа като антиоксидант. Намира приложение също така в медицината, текстилната промишленост и фотографията. Лимонената киселина се съдържа в много плодове и зеленчуци: в лимоните може да съставлява до 8% от сухото тегло на плода. в листата на тютюна съдържанието й е 3-14%. В животинските организми се среща в редица физиологични течности: мляко, урина, кръв и др. В медицината се използва при приготвяне на кръвна плазма („цитратна плазма”) при преливане на кръв. Киселинността на лимонената киселина се дължи на трите карбоксилови групи −COOH, всяка от които в разтвор може да се протонира и да се получи цитратен йон. Цитратите сe използват като буфери за регулиране на pH на киселинни разтвори. Цитратните йони образуват соли, наречени „цитрати“ с много метални йони. Сред тях е важен калциевият цитрат или „кисела сол“, който се използва широко за консервиране и овкусяване на храни. Освен това, цитратите могат да хелатират металните йони, което ги прави подходящи като консерванти и омекотители на вода. При стайна температура лимонената киселина е кристален прах. Тя може да съществува, както в безводна форма, така и като монохидрат, който съдържа по една молекула вода на всяка молекула лимонена киселина.

Бадемената киселина (2-хидрокси-2-фенилоцетна киселина) е ароматна алфа-хидрокси киселина. Тя е бяло кристално вещество, разтворимо във вода и полярни органични разтворители. Рацемичната й смес се нарича парабадемена киселина. В медицината се използва като антибактериален препарат, особено при лечение на инфекции на пикочните пътища. Тя се използва също като антибиотик и компонент на химически „пилинг за лице", заедно с други α-хидроксикиселини. Лекарствата cyclandelate и homatropine са естери на бадемената киселина.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
депсид - полифенолно съединение, съставено от две или повече моноциклични ароматни единици, свързани помежду си с естерни връзки
танин - група фенолни съединения с растителен произход, които съдържат голямо количество OH-групи
цикъл на Кребс - цикъл на лимонената киселина

ВЪПРОСИ И ЗАДАЧИ
- Напишете структурните формули на следните хидроксикарбоксилови киселини: млечна киселина; р-хидроксибензоена киселина; лимонена киселина; β-хидроксипропанова киселина.
Отговор
- Какви видове изомерия е характерна за 2-хидроксибутановата киселина? Напишете структурните формули и наименования на всички възможни изомери.
Отговор
- Сравнете по сила следните двойки киселини: α-хидроксипентанова - пентанова бензоена киселина - салицилова киселина. Каква е причината за разликите в силите на тези киселини?
Отговор
- Какви реакционни продукти е възможно да се получат в резултат на взаимодействието на 2-хидроксипропановата киселина (млечна киселина) с етилов алкохол? Напишете химичните реакции. По какво се различават те?
Отговор
- Посочете кое/и твърдения е/са коректнo/и: А. Аспирин се синтезира чрез естерификация на салицилова киселина и оцетен анхидрид. B. Аспирин се синтезира чрез взаимодействие между две молекули салицилова киселина. С. Aспирин се синтезира чрез естерификация на салицилова киселина и ацетилхлорид. D. Aспирин се синтезира чрез естерификация на салицилова киселина и оцетна киселина.
Отговор
- Довършете следната химична реакция. Посочете наименованията на изходния реактив и реакционния/ите продукти:
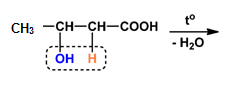
Отговор
- Допълнете изречението: В резултат на междумолекулната кондензация на фенолни хидроксикарбоксилови киселини се получават съединения наречени…………………….
Отговор
- Напишете систематичните наименования (по IUPAC) на следните хидроксикарбоксилови киселини:
лимонена киселина -
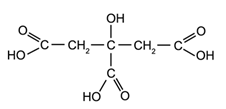
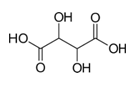
винена киселина -
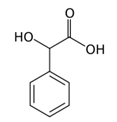
бадемена киселина -
Отговор
- Какви продукти се получават при вътрешномолекулното обезводняване на α-хидроксикарбоксиловите киселини при нагряване? Напишете една такава химична реакция.
Отговор
- Кое от посочените твърдения не е вярно:
А. Хидроксикарбоксиловите киселини участват в химични реакции, характерни за -OH групата.
В. Хидроксикарбоксиловите киселини участват в специфични химични реакции, в които участват едновременно -OH и -COOH групите.
С. Хидроксикарбоксиловите киселини участват в химични реакции, характерни за -COOH групата.
D. Хидроксикарбоксиловите киселини не участват в полимеризационни реакции.
E. Хидроксикарбоксиловите киселини участват в неутрализационни реакции.
Отговор


Проект „Развитие на център за електронни форми на дистанционно обучение в Тракийски университет“ BG051PO001-4.3.04-0026