МЕЖДУМОЛЕКУЛНИ СИЛИ И ВРЪЗКИ.
ВОДОРОДНА ВРЪЗКА
В темата се ацентира се върху същността и видовете междумолекулни връзки: ориентационни, индукционни и дисперсионни, като наред с това се прави и сравнителното им разглеждане с химичните връзки. Изяснява се ролята на вандервалсовите взаимодействия като фактор за протичане на редица процеси в организма. Специално внимание се отделя на водородната връзка - същност, междинно положение в системата от химични и междумолекулни връзки, видове водородни връзки и значението им за биологичните системи.
I. МЕЖДУМОЛЕКУЛНИ СИЛИ И ВРЪЗКИ

Както между атомите съществуват сили на взаимодействие, в резултат на които се образуват молекули, така и между молекулите съществуват сили на взаимодействие, с които се обяснява преминаването на веществата от едно агрегатно състояние в друго, например чрез солватация, асоциация и т.н.
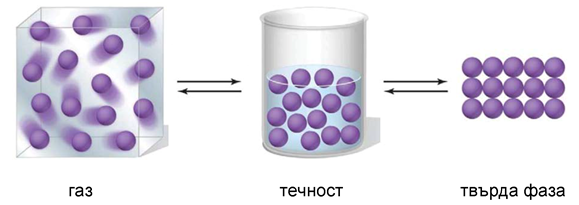
Фиг. 39. Пространствено разпределение на молекулите в газообразно, течно и твърдо агрегатно състояние
Междумолекулните сили възникват в резултат на взаимодействието на електронните обвивки на молекулите, т.е. те имат електростатичен характер. Поведението на неполярните и полярните молекули под действието на електрическо поле, обаче, е различно
При неполярните молекули При неполярните молекули центровете на тежестта на положителните и отрицателните товари съвпадат в една точка в пространството, когато те не се намират в електрическо поле. При постепенно навлизане на неполярни молекули в електрическо поле, обаче, започва процес на известно изместване и преразпределение на зарядите: положително натоварените ядра се ориентират към анода, а отрицателните електрони - към катода. Следователно в резултат на деформация и поляризация неполярната молекула получава диполен момент (μ≠0) и тя се превръща в индуциран дипол.
При попадане на полярните молекули (диполи)в електрическо поле протичат последователно процеси на ориентация и деформация, които водят до допълнителна поляризация. Ориентацията е толкова по-пълна, колкото полярната молекула е с по-голям диполен момент, а деформацията зависи предимно от силата на полето.
Силите на взаимодействие между неполярни, полярни-неполярни и между полярни молекули се обединяват под названието вандерваалсови сили. Ако те възникват между еднакви молекули се наричат кохезионни, а явлението - кохезия. Междумолекулни сили, възникнали между разнородни молекули се наричат адхезионни, а явлението - адхезия.
Енергията на междумолекулно взаимодействие има потенциален характер и се определя от вида на силите, действащи между молекулите. Силата на привличане е отрицателна и намалява по големина с увеличаване на разстоянието между молекулите, а силата на отблъскване е положителна и намалява много по-бързо с увеличаване на разстоянието между молекулите.
I.1. ОРИЕНТАЦИОННИ МЕЖДУМОЛЕКУЛНИ СИЛИ (ДИПОЛНИ СИЛИ)
В резултат на възникнали ориентационни междумолекулни сили между полярни молекули се формират молекулни групировки, наречени асоциати. Ориентационни сили могат да възникнат, както между еднакви, така и между различни молекули.

Фиг. 40. Ориентационни сили
Според теорията на Кесом (1921), средната потенциална енергия на взаимно привличане на две еднакви полярни молекули с постоянен диполен момент може да се изчисли по формулата:
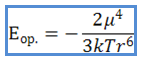
където μ е диполният момент, k - константата на Болцман, Т - абсолютната температура, r - разстояние между диполните центрове.
I.2. ИНДУКЦИОННИ МЕЖДУМОЛЕКУЛНИ СИЛИ (ДИПОЛ-ИНДУЦИРАНИ СИЛИ)
При наличие на диполни и неполярни молекули, под действие на електрическите си полета полярните молекули предизвикват появата на индуцирани диполи в неполярните молекули, които също се превръщат в полярни. На следващия етап двете полярни молекули си взаимодействат чрез ориентационни междумолекулни сили.
Фиг. 41. Възникване на индукционни междумолекулни сили чрез диполни водни молекули
Енергията на междумолекулно привличане между диполна молекула с постоянен диполен момент и диполна молекула с индуциран диполен момент, обусловена от индукционния ефект, не зависи от температурата и се определя от формулата:
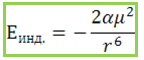
където α е поляризуемост на молекулите.
I.3. ДИСПЕРСИОННИ (ЛОНДОНОВИ) МЕЖДУМОЛЕКУЛНИ СИЛИ
Известно е, че неполярните молекули имат диполен момент μ = 0, т.е. те не създават електрично поле. От друга страна, обаче, между тях действат сили, които се разглеждат като електрични. Това противоречие се обяснява от квантовата механика чрез разглеждане на движението на вътрешноатомните части (Лондон, 1930). Доказано е, че неполярната молекула представлява сложна 3D подвижна система от непрекъснато движещи се електрически товари, предизвикващи неравномерно разпределение на електронната плътност. В резултат на което в неполярните молекули възникват моментни микродиполи. Индуцираните микродиполи се ориентират един спрямо друг чрез ориентационни сили и между тях започват да действат сили на привличане известни като дисперсионни (лондонови) сили.
Фиг. 42. Дисперсионни сили
Средната потенциална енергия на дисперсионно взаимодействие между две неполярни молекули се изчислява по формулата:
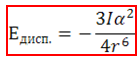
където I е йонизационната енергия.
Дисперсионните сили са универсални, тъй като те са характерни за всички молекули, независимо от структурата им, и адитивни- една единствена молекула взаимодейства дисперсионно с всички обкръжаващи я молекули, намиращи се на достатъчно близко разстояние до нея. Големината на дисперсионните сили нараства с увеличаване на молекулната маса, тъй като по-големите атоми имат по-големи електронни облаци, които по-лесно се поляризират.
Тя зависи също и от молекулната геометрия. Например, въпреки, че 2-метилпропана (изобутан) и n-бутана са верижни изомери, т.е. те имат еднаква молекулна маса (Мм 58 g/mol), техните молекули се различават по форма. Молекулата на n-бутана има почти цилиндрична форма, а тази на изобутана се доближава до сферична. Следователно, по голямата контактна повърхност между молекулите на n-бутана определя образуването на по-здрави дисперсионни връзки между тях, което обяснява и по високата температура на кипене на съединението (0оС) в сравнение с Тк на изобутана (-12оС)
Фиг. 43. Влияние на геометрията на молекулата върху големината на дисперсионните сили
Въз основа на казаното дотук може да се обобщят основните характеристики на вандерваалсовите сили:
Въпреки, че по електростатичната си природа те приличат на химичните връзки, вандерваалсовите връзки са по-слаби и действат на по-големи разстояния (на около 1 nm от центъра на молекулата). Възможно е, обаче, въз основа на тях тези сили да се образуват доста трайни връзки между еднакви молекули - например асоциати от NO2, и между различни молекули (разтворител-разтворено вещество), т.нар. солвати.
Вандерваалсовите сили представляват предимно сили на привличане, въпреки че при разполагане на едноименните заряди на молекулите на много близко разстояние започват да действат и сили на отблъскване.
Вандерваалсовите взаимодействия в повечето случаи се увеличават при увеличаване на молекулната маса.
Най-значими са междумолекулните сили при твърдите вещества с молекулно-кристална решетка. При твърди вещества с йонна или метална кристална решетка не действат такъв тип сили, тъй като те не са изградени от молекули.
Разгледаните междумолекулни сили и връзки оказват влияние върху определени свойства на веществата, например: скорост на разтваряне, скорост на кристализация, скорост на химичните реакции, механическа устойчивост на някои материали (пластмаси, лакови покрития) и т.н.
II. ВОДОРОДНА ВРЪЗКА


|
Възникването на водородна връзка в състава на дадено химично съединение е възможно само ако са налице следните условия:
|
Н-атом и атома на електроотрицателния елемент да са свързани с ковалентна химична връзка.

|
Водородната връзка се характеризира като най-здравата междумолекулна и най-слабата химична връзка. |
В зависимост от мястото, където възникват - в една и съща молекула или между отделни молекули водородни връзки се класифицират на:
кохезионна междумолекулна Н-връзка- възниква между хомогенни молекули и води до получаване на димери или агрегати от голям брой еднакви молекули: водни молекули в лед, между молекулите на халогеноводородите (HF, HCl, HI), циановодородната киселина, алкохоли и др.
Фиг. 44. Водородни връзки в лед и вода
Фиг. 45. Кохезионни Н-връзки в димер на бензоената киселина
адхезионна междумолекулна Н-връзка- възниква между хетерогенни молекули: H2O − NH3, C2H5OH − H2O и др.
Фиг. 46. Адхезионни Н-връзки между молекули на H2O − NH3, C2H5OH − H2O
Наличието на този тип Н-връзки обуславят голямата разтворимост на амоняка и етанола във вода.
II.2. ВЪТРЕШНОМОЛЕКУЛНА Н-ВРЪЗКА
Вътрешномолекулната Н-връзка се образува между атоми на една и съща молекула. Например вътрешномолекулната водородна връзка в молекулата на ацетилацетона спомага за стабилизацията на енолния тавтомер.
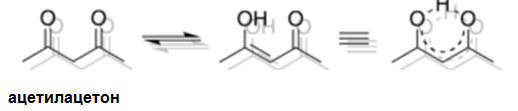
Вътрешномолекулните Н-връзки в молекулите на 2-нитрофенола, 2,4-динитрофенола, о-хлорофенола, салициловия алдехид и др., са причина за някои специфични химични свойства на тези съединения и техни изомери.
III. БИОЛОГИЧНО ЗНАЧЕНИЕ НА ВОДОРОДНАТА ВРЪЗКА

Молекулата на ДНК се състои от две полинуклеотидни вериги, а всяка от тях е изградена от свързани помежду си нуклеотиди. Двете полинуклеотидни вериги се свързват помежду си чрез водородни връзки, образуващи се между азотните бази от нуклеотидите на едната верига с азотните бази от нуклеотидите на другата верига. Свързването между двете вериги е комплементарно, т.е. всяка база се свързва с точно определена база от другата верига. Чрез образуването на множество водородни връзки в молекулата на ДНК се определя стабилността на молекулата и в съхранението на наследствената информация:
Фиг. 47. Водородни връзки между азотните бази ( Тема 17:
Азотсъдържащи органични съединения. Аминопроизводни на въглеводородите
(Aмини), т.VI. Хетероциклени амини, т.VI.3. Имидазол, индол, пиримидин и пурин) от нуклеотидите на едната верига с азотните бази от нуклеотидите на другата верига в ДНК молекулите
Водородните връзки са характерни също и за протеините, където те се формират между молекулите на отделните аминокиселини.
Фиг. 48. Водородни връзки между аминокиселините в структурата на протеините
Наличието на водородни връзки в структурата на някои полимери също определя редица техни специфични свойства.
Фиг. 49. Водородни връзки в полимери
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
адхезия- (лат. adhaesio — прилепване) е физично свойство на материята, сила на междумолекулно привличане между разнородни частици
димер- химично обединение, съставено от два структурно подобни мономера, свързани чрез силни или слаби ковалентни или междумолекулни връзки
ДНК- дезоксирибонуклеинова киселина
константа на Болцман (k)- фундаментална физична константа, равна на газовата константа R разделена на числото на Авогадро Na, k = R/Na
кохезия- (лат. cohaerere - слепвам, стоя заедно) е физично свойство на материята, сила на междумолекулно привличане между подобни частици нуклеотид - органична молекула, състояща се от азотсъдържащо хетероциклично производно (обикновено на пурина или пиримидина), означавани често като "азотна база", монозахариден остатък (обикновено на пентозите дезоксирибоза в ДНК или рибоза в РНК), и фосфатна или полифосфатна група
полимери- високомолекулни съединения, молекулите на които се състоят от голям брой повтарящи се атомни групи, свързани помежду си с ковалентни химични връзки
солватация- взаимодействие между частиците на разтвореното вещество и молекулите на разтворителя, при което се получават съединения – солвати
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
1. Кое от посоченият твърдения е некоректно:
A. Междумолекулните сили имат електростатичен характер.
B. Под действието на електрическо поле неполярните и полярните молекули имат различно поведение.
С. Ориентационните сили могат да възникнат между полярни и неполярни молекули.
D. Индукционните сили са по-слаби от ориентационните.
Обосновете отговора си.
Отговор
2. Посочете за кой вид междумолекулни сили (ориентационни, индукционни, дисперсионни) се отнася всяка една от следните характеристики:
А. Големината на тези сили зависи от молекулната маса и молекулната геометрия.
В. Големината на тези сили зависи от големината на диполния момент.
С. Големината на тези сили не зависи от температурата.
D. Тези сили са универсални.
E. Тези сили възникват само между полярни молекули.
Отговор
3. Кои са задължителните условия, които трябва да бъдат спазени, за да е възможно образуване на Н-връзка?
Отговор
4. Какви видове Н-връзки познавате? Подкрепете отговора си с конкретни примери.
Отговор
5. Обяснете на какво се дължи факта, че ледът остава на повърхността на водата, а не потъва?
Отговор
6. Възможно ли е образуването на Н-връзки между молекули етанол и маслена киселина?
Отговор
7. Какви видове Н-връзки са характерни за молекулите на салициловата (2-хидроксибензоената киселина) и р-хидроксибензоената киселина? Обосновете отговора си.
Отговор
8. За кои биологични макромолекули са характерни Н-връзки и какво е значението им?
Отговор
9. Сравнете силата на Н-връзки с тази на останалите видове междумолекулни връзки и с химичните връзки.
Отговор
10. Образуването на кой тип сили изобразява следната фигура? Обяснете всеки един от етапите a, b и c.
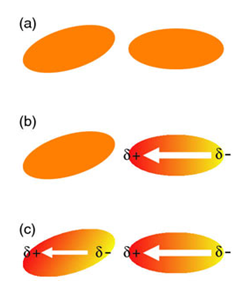
Отговор





