Ключови думи: ензими, активен център, активираща енергия, коензим, простетична група, рибозими, ензим-субстратен комплекс, холоензим, оксидоредуктази, трансферази, хидролази, лиази, изомерази, синтетази
Цели:
- Да се изясни химичния състав и структурата на ензимите.
- Да се обясни структурата и ролята на активния център.
- Да се изясни механизма на ензимната катализа.
- Да се разгледа ензимната кинетика.
- Да се изясни ензимната класификация.
- Да получат знания за основните класове ензими.
Въведение
Биохимичните реакции протичат задължително с участие на специфични биологични катализатори - ензими. Ензимите са протеини или протеинови комплекси, които катализират химически реакции в организма. Ензимите са катализатори, които не само ускоряват биохимичните реакции, но осигуряват подреденост и съгласуваност във времето и пространството в съответствие с нуждите на клетката. Те осъществяват бързо и фино настройване на метаболизма в отговор на сигналите, постъпващи от вътрешната и външната среда. За тях са валидни всички общи свойства на катализаторите, но се характеризират с изключително висока ефективност, специфичност (субстратна и реакционна), възможност за регулация на активността и синтезата им.
Повечето ензими са глобуларни белтъци - еднокомпонентни (изградени само от белтъчна част) и двукомпонентни (съдържат белтъчна и небелтъчна част). Ако връзката между двете съставни части е слаба, небелтъчната част се нарича коензим, ако връзката между двете части е здрава, ковалентна – небелтъчната част се определя като простетична група.
Съществуват биокатализатори изградени от РНК, наречени рибозими.
Броят на участващите в метаболизма ензими надвишава 3000, разпределени в шест главни групи:
- І.Оксидоредуктази;
- ІІ. Трансферази;
- ІІІ. Хидролази;
- ІV. Лиази;
- V. Изомерази;
- VІ. Синтетази.
5.1. Същност на ензимната катализа
5.1.1. Енергетична бариера или активираща енергия на реакцията
Биохимичните реакции в биологичните системи почти винаги протичат в присъствие на катализатори, наречени ензими. Известно е, че за да се осъществи дадена химична реакция, реагиращите вещества трябва да имат сумарна енергия по-висока от т.нар. енергетичен праг. За охарактеризиране на тази величина Арениус е въвел понятието активираща енергия (Еа*). Преодоляването на активиращата енергия се постига чрез увеличение на енергията на взаимодействащите молекули, например чрез нагряване, или чрез налягане, или чрез намаляване на активиращата енергия с помощта на катализатор.
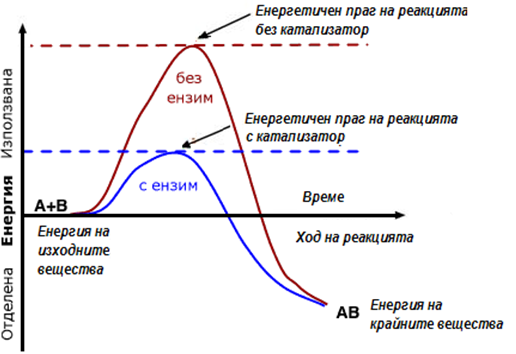
Фигура 43. Енергетичен праг на реакция без катализатор и катализирана реакция
Ензимите ускоряват реакциите над 1000 пъти. Те провеждат реакцията по път с по-ниски енергетични изисквания (активираща енергия - Еа*), като образуват т.н. ензим-субстратен комплекс (междинни активни комплекси), формира се междинно съединение между изходното вещество (субстрат) и ензима (фиг.44).
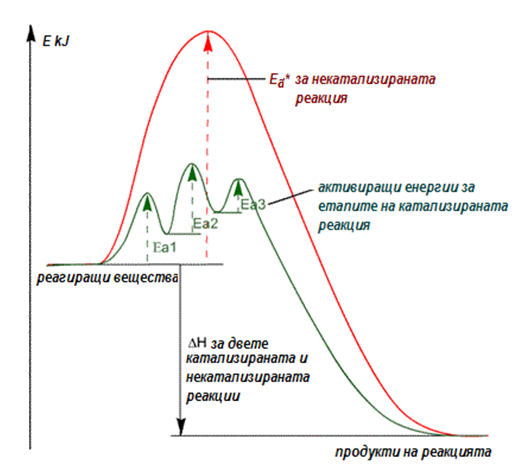
Фигура 44. Стойности на активиращата енергия (Еа*) на реакция без катализатор и катализирана реакция
Катализаторът променя скоростта на процеса, като изменя реакционния път, при което променя и активиращата му енергия. Независимо колко междинни съединения се образуват (междинни фази), активиращата им енергия е винаги по-ниска от тази за некатализираната реакция.
5.1.2. Основни свойства на ензимите като биокатализатори
По своите функции ензимите са биологични катализатори и катализират биохимични реакции. Ензимите подобно на катализаторите в неживата природа активират реагиращите вещества и разбиват реакцията на няколко стадия, при които енергетичния праг на всяка една от тях е по-нисък от общия за реакцията (фиг.44). С тяхна помощ се извършва синтез и разграждане на органичните вещества, редуциране, окисление, обмяна на веществата между организмите и околната среда.
Подобно на неорганичните катализаторите, ензимите:
- катализират само енергетично възможни реакции;
- не изменят посоката на реакцията;
- ускоряват настъпването на химичното равновесие, но не го изместват;
- не се изразходват в процеса на реакцията.
Подобно на химичните катализатори ензимите действат по механизма на междинните продукти като снижават енергетичния праг на реакцията. Това, което отличава ензимите от неорганичните катализатори е:
- изключително високата скорост на ензимните реакции;
- изключително високата ефективност;
- висока специфичност (субстратна и реакционна);
- възможност за регулация на активността и синтезата им;
- меки условия на протичане на ензимната реакция;
- скоростта на ензимната реакция е пропорционална на количеството на ензима.
Ензимите в сравнение с химичните катализатори са много активни и увеличават скоростта на биохимичната реакция понякога милион пъти.
Ензимите като катализатори се отличават с много голяма специфичност по отношение на субстрата и ускоряват строго определени химични реакции. Предполага се, че в човешкия организъм съществуват 20 000 – 30 000 различни ензима, при това всеки от тях има толкова специфична структура, че може да катализира само дадена отделна реакция.
Ензимите действат в условията на живия организъм – температура около 37˚С и рН≈7, което е присъщо само на малко катализатори от небиологичен произход. Обикновено при повишаване на температурата до 50-60˚С, настъпва денатурация, т.е. нарушаване на нативната структура на белтъка и ензима загубва каталитичната си способност. Такава денатурация на ензимите се наблюдава обикновено при повишаване на температурата до 50 - 60˚С, а в други случаи и при понижаването и под 10-15˚С.
При обикновените каталитични процеси катализаторите остават непроменени в края на реакцията. Биокатализаторите обаче се дезактивират след протичане на каталитичния процес, поради което непрекъснато се синтезират нови количества активни ензими.
Ензимите са сложни органични съединения. Синтезират се в живите организми и представляват високомолекулни белтъци или комплекси от белтък и съединение с небелтъчна природа. Според химичната си природа и структура се разделят на:
- еднокомпонентни (съдържащи само белтъчна част);
- двукомпонентни (съдържащи белтъчна и небелтъчна част).
Повечето от ензимите са белтъци, предимно глобуларни. Нарушаването на нативната структура на белтъка, води до загубва на каталитичната способност на ензима, преди да са се разрушили ковалентните връзки, изграждащи полипептидните вериги. Допуска се, че дезактивирането настъпва при разрушаване на вторичната, третичната и четвъртичната структура на белтъка.
Небелтъчната част, при двукомпонентните ензими, се нарича – коензим или простетична група, а белтъчната част – апоензим, целия комплекс – холоензим. Ако връзката между двете съставни части на двукомпонентните ензими е слаба, небелтъчната част се нарича коензим. При здрава връзката между двете части, т.е. наличие на ковалентна връзка – небелтъчната част се определя като простетична група.
Роля на простетични групи изпълняват малки органични съединения (тиамин-пирофосфат), както и метални катиони. Коензимите са също малки органични съединения (флавин, НАД, хем) или неорганични метални йони. Коензимите не са здраво свързани с ензима, но са необходими за функционирането му. Те се асоциират в момента на самата реакция, тъй като присъстват в големи количества в средата.
Отскоро се знае, че една малка част ензими са изградени от РНК и са наречени рибозими.
5.1.3. Механизъм на ензимната катализа
Ензимната катализа се осъществява чрез биологични катализатори, наречени ензими, протича при меки условия (условията на клетъчната среда) и с много висока специфичност (субстратна и реакционна). Каталитичното действие се осъществява в резултат на междинни химични взаимодействия на реакционните продукти с катализатора (фиг.44). Междинните стъпала се изразяват схематично така:

- 1) Ензимите (Е) се свързват с реагиращите вещества, които в случая се наричат субстрати (S).
- 2) Образува се ензимно-субстратен комплекс (ЕS), който се преобразува в няколко преходни комплекса (EZ).
- 3) В този комплекс (EZ) субстратът претърпява промени и се превръща в продукт (Р). Превръщането на ЕS в ЕР може да бъде многостъпален процес.
- 4) В края на реакцията образуваният продукт се отделя и ензимът се възстановява непроменен (фиг.45).
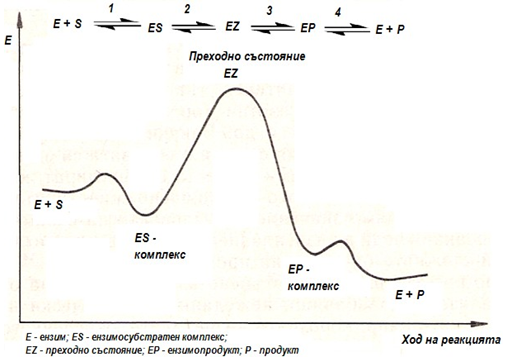
Фигура 45. Обща схема на ензимната катализа
Ензимите, както и другите катализатори, снижават активиращата енергия, защото провеждат реакцията по друг път с по-ниски енергетични изисквания (фиг.44). Характерно е образуването на междинно съединение между изходното вещество (субстрат) и ензима, което се нарича ензим-субстратен комплекс. Възможно е да се образуват няколко междинни съединения. Независимо колко са междинните фази, активиращата им енергия е винаги по-ниска от тази за некатализираната реакция.
Ензимите са глобуларни белтъци и изпълняват биологичната си функция (каталитичната) чрез активен център (фиг.46). Активният (каталитичен) център е мястото на осъществяване на самата каталитична реакция и пряката връзка със субстрата. Субстратната молекула не се свързва с цялата ензимна молекула, а с активния център. Често това са малко на брой аминокиселини приближени пространствено при нагъването на полипептидната верига. Между субстратната молекула и аминокиселинните остатъци в активния център на ензима възникват различни видове химични връзки, много често нековалентни. Така се образува ензимно-субстратният комплекс. В него протича химичната реакция и субстратът се преобръща в продукт. В близост до активния участък е разположен т.нар. свързващ
участък, област на допълнителна връзка между субстрата и самата ензимна молекула, като изпълнява обикновено поддържаща функция. Ензимната молекула съдържа и регулаторен участък, който е незадължителен, но могат да бъдат и няколко. Това са области от белтъка, където взаимодейства с други регулаторни молекули, които променят конформацията на ензима и влияят върху неговото ензимно действие.
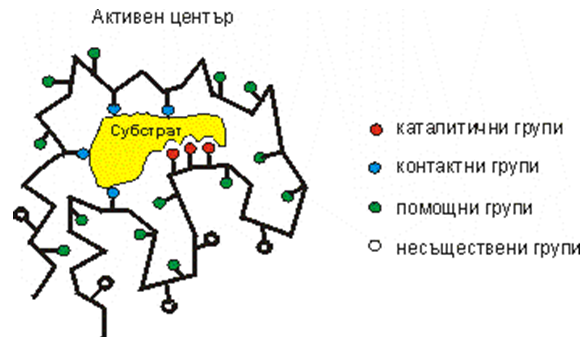
Фигура 46. Структура на активния център: каталитични групи - червен цвят; контактни - син; конформационни групи извън активния център - зелен цвят; несъществени за ензимната активност групи - неоцветени.
В еднокомпонентните ензими активният център се състои от няколко аминокиселинни остатъка, които са отдалечени по протежение на полипептидната верига, но са близко разположени в пространството поради формиране на третична структура на белтъка. В двукомпонентните ензими за формиране на активния център групи предоставя и небелтъчната съставка. Тя предлага най-често каталитични групи, оставяйки за апоензима контактната функция.
От химична гледна точка групите в активния център могат да бъдат най- различни -SH, -NH2, -ОН, имидазолово ядро и пр. От функционална гледна точка според Кошланд се различават 2 вида групи, участващи в активния център:
- каталитични (вземат пряко участие в реакциите на превръщане на субстрата в продукт).
- контактни (прикрепват субстрата към активния център, така че атакуемата от ензима връзка да попадне в обсега на действие на каталитичните групи).
В случаите, когато катализираната реакция изисква включването на две или повече различни субстратни молекули, контактните групи ги довеждат до най-благоприятна за реагиране позиция. Така контактните групи съдействат най-много за високата скорост на ензимно катализираните реакции.
Блокирането на каталитични или контактни групи води до загуба на ензимната активност.
Конформационните или помощни групи са извън активния център, но именно те фиксират определена пространствена конформация на ензимната молекула. Атакуването на връзки между тези групи при денатурация води до загуба на биологичната активност. В огромната ензимна молекула има и групи, които не са от значение за ензимната активност. Модифицирането им не променя активността. Те обаче могат да са от значение за регулиране на ензимната активност под действие на различни фактори.
Ензимната активност е по-широко понятие от количеството ензим. Тя отчита преди всичко резултата от реакцията, а именно добива от субстрата или натрупването на продукта от катализираната реакция. При определянето на ензимната активност се отчитат следните фактори: масата на получения
продукт или изразходения субстрат, време на протичане на реакцията; количеството биологичен материал съдържащ ензима.
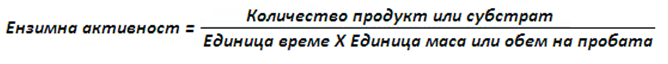
- - за единица количество се използва – мол (mmol, µmol), грам (кг, гр);
- - за единица време – минута или lчас, секунда;
- - за единица маса или обем – грам (кг, гр), литър (мл).
За ензимна активност, често се използва катал (mol/sec), международна единица активност (МЕ, Unit), което съответства на µmol/min.
За да могат да се сравняват резултатите от различни лаборатории, активността на ензимите се сравнява при сродни условия, т.нар стандартни условия – оптимално рН, фиксирана температура – 25ºС или 37 ºС, спазване на времето на инкубация на субстрата с ензима. Друго условие е наличие на излишък от субстрата, за да могат да участват всички молекули на ензима в реакцията.
Представата за механизма на ензимно-субстратното взаимодействие чрез активния център на ензима обяснява добре защо ензимите са най- специфичните катализатори в сравнение с всички останали катализатори.
Специфичността, реакционна и субстратна, е едно от най-съществените свойства на ензимите. Ензимите проявяват висока избирателност на действие, която се основава на комплементарността (съответствието, т.е. взаимното допълване) в структурата на субстрата и активния център на ензима. За обяснение на наличието на специфичност по отношение на различни възможни изходни вещества, първоначално била прилагана хипотезата на Емил Фишер, за т.нар. структурно съответствие тип „ключ- ключалка“. Тя постулирала пълно структурно съответствие между субстрата и ензима, като субстрата буквално прилепва в активния център на ензима (фиг.47). Хипотезата обяснява добре абсолютната специфичност, но не може да обясни груповата.
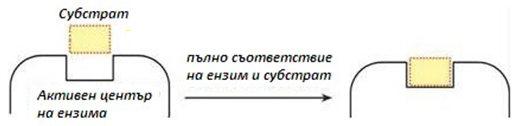
Фигура 47. Структурно съответствие тип „ключ-ключалка“ (теория на Фишер)
Груповата специфичност е катализ на субстрати, които имат общи структурни особености, например, наличие на определени химични връзки (пептидни, естерни и т.н.) или химични групи (-ОН, -СООН и т.н.). При тази специфичност могат да се катализират около 7000 субстрата от един ензим. Тази специфичност се обяснява добре от теорията на Кошланд, т.е. модел на „индуцираното структурно съответствие“, тип „ръка-ръкавица“, при което активния център притежава определена гъвкавост. Присъединяването на субстрата към контактния център на ензима води до изменение на конфигурацията на каталитичния център, по такъв начин, че неговата форма да съответства на формата на субстрата (фиг.48).
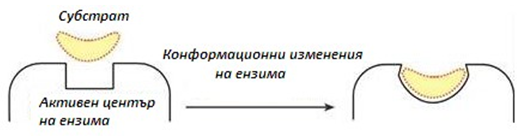
Фигура 48. Индуцирано структурно съответствие тип „ръка-ръкавица“ (теория на Кошланд)
Ензимите, проявяват и стереоспецифичност, при субстрати, които са оптично активни вещества. Стереоспецифичността се обяснява от Огстон с множество точки на свързване на субстрата към активния център (най-малко три, фиг.49).
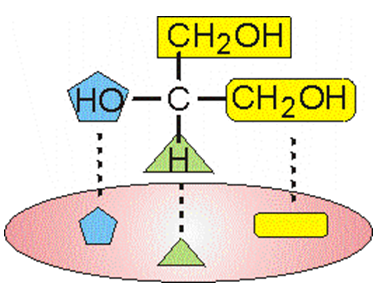
Фигура 49. Стереоспецифичност, множество точки на свързване на субстрата към активния център
Ако само една група трябваше да се свърже с активния център, то много съединения биха подхождали. Но комбинацията от три групи рязко намалява броя на възможните съединения. Това обяснява и защо химически напълно еднакви съединения, различаващи се само по положение на една група, се разпознават от ензима.
Катализираната реакция може да протече по два механизма:
- Киселинно-основен катализ – в активния център на ензима се намират специфични аминокиселинни остатъци, които се явяват донори или акцептори на протони. Такива групи са мощни катализатори за много органични реакции. Групи донори са: – СООН, -NH3+, -SH, акцептори са групите: –СОО-, -NH2, -S-.
- Ковалентен катализ – ензимите реагират със своя субстрат, при което с помощта на ковалентни връзки образуват нестабилни ензимо- субстратни комплекси, в които чрез вътрешномолекулярни преобразувания се формират продуктите на реакцията.
Типове ензимни реакции:
- Тип „пинг-понг“ – ензима отначало взаимодейства със субстрат А, подбирайки от него определени химични групи и образувайки продукт. След това ензима се присъединява към субстрат В, на когото предава тези химични групи. Пример за този тип ензимна реакция е трансаминирането на аминокиселините – преноса на групи от аминокиселината към кетокиселината.
- Тип на последователните реакции – към ензима последователно се присъединяват субстрати А и В, образува се троен комплекс, осъществява се катализ. Продуктите на реакцията също се отделят последователно от ензима.
- Тип на случайните взаимодействия – субстратите А и В се присъединяват към ензима по случаен ред, след катализа също така се отделят.
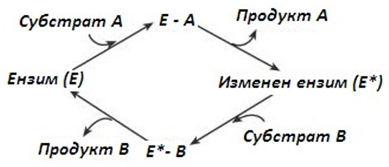
Фигура 50. Взаимодействие ензим-субстрат, тип „пинг-понг“
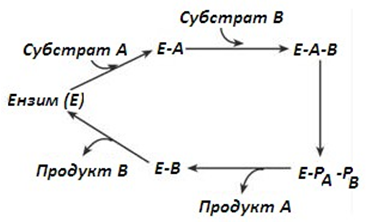
Фигура 51. Последователно ензим-субстрат взаимодействие
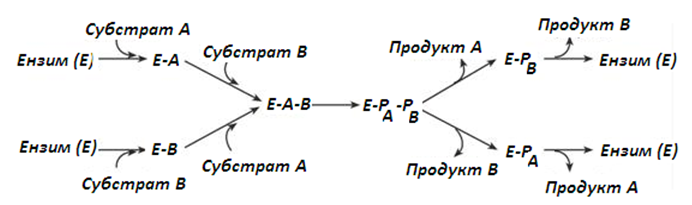
Фигура 52. Случайни ензим-субстрат взаимодействия
5.1.4. Кинетика на ензимните реакции
Ензимната кинетика си поставя за цел да изследва как ензимите се свързват с техните субстрати и ги превръщат в продукти, както и да определи скоростта на това превръщане.
Общата скорост на ензимно катализираната реакция зависи от много фактори като температура, pH на средата, концентрации на реагентите, присъствието на инхибитори и др. Ензимната кинетика изучава промените в скоростта на ензимните реакции под влияние на тези фактори.
От практически съображения са въведени няколко показателя за кинетичното характеризиране на дадена реакция:
- Максимална скорост (Vmax) - постига се при пълно насищане на ензима, отсъствие на свободни ензимни молекули. Тогава концентрацията на ензим-субстратния комплекс е числено равна на началната концентрация на ензима. При разглеждането на кинетичните уравнения при такива условия, лесно се изчислява и константата на Михаелис-Ментен (числено равна на субстратната концентрация, необходима за достигане на 1/2 от максималната скорост).;
- Начална скорост (V0) - проблем за измерване, тъй като концентрацията на субстрат се променя в течение на реакцията. За определянето и се използват значителни концентрации на субстрат, надвишаващи тези на ензима. При това условие, промяната на концентрацията на субстрат в първите няколко секунди от реакцията е незначителна и с подходящ математически апарат, може да се определи началната скорост на реакцията.;
- Константа на Михаелис-Ментен (Km) - показател за сродството на ензима към неговия субстрат в рамките на ензим-субстратния комплекс - колкото по-голяма е тя, толкова по-лесно ензима се освобождава от своя субстрат;
- Оборотно число - кинетичния смисъл е максималния брой субстратни молекули, които могат да се преработят от един активен център за една секунда. Това е просто скоростната константа на превръщането на ензим- субстратния комплекс в продукт и неговото освобождаване.;
- Константа на специфичност - кинетичния смисъл е максималния брой на субстратни молекули превърнати за единица време от един активен център при еднакви условия на афинитет към субстрата. Константата на специфичност е отношението между оборотното число и константата на Михаелис-Ментен.;
Зависимост на скоростта на реакцията от концентрацията на субстрата:
При увеличение на концентрацията на субстрата скоростта на реакцията отначало нараства, в реакцията се включват нови молекули ензим. След известно време се наблюдава ефект на насищане, когато всички молекули от ензима взаимодействат с молекулите на субстрата. При продължаване на увеличението на концентрацията на субстрата между молекулите възниква конкуренция за активния център на ензима и скоростта на реакцията намалява (фиг.53).
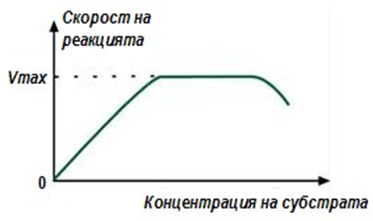
Фигура 53. Зависимост на скоростта на реакцията от концентрацията на субстрата
Зависимост на скоростта на реакцията от концентрацията на ензима:
При увеличаване количеството на ензима, скоростта на реакцията нараства право пропорционално (фиг.54).
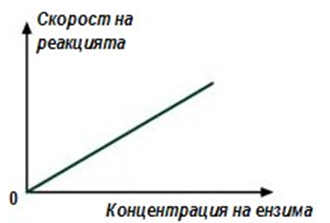
Фигура 54. Зависимост на скоростта на реакцията от концентрацията на ензима
Зависимост на скоростта на реакцията от температурата:
Зависимостта на активността на фермента (скоростта на реакцията) от температурата се описва с камбановидна крива, с максимум скорост при оптималните температури на дадения ензим (фиг.55). Закона за повишаване на скоростта на ензимната реакция 2-3 пъти с повишаване температурата с 10°С е валиден, но до пределите на 55-60°С, т.е. до температурата на денатурация на белтъците. За повечето ензими, температури над 55-60°С, водят до нарушаване на техните пространствени структури и прекратяване на ензимния процес.
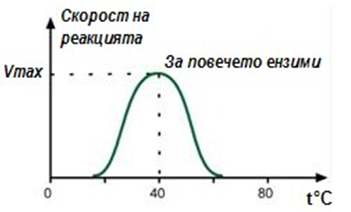
Фигура 55. Зависимост на скоростта на реакцията от температурата
Зависимост на скоростта на реакцията от рН:
Тази зависимост също се описва с камбановидна крива, с максимална скорост оптималните стойности за съответния ензим (фиг.56).
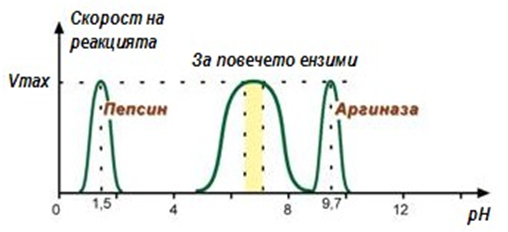
Фигура 56. Зависимост на скоростта на реакцията от рН
За повечето ензими съществува тесен интервал за рН на средата, при която проявява максимална активност. Например, оптималното рН за пепсина е 1,5-2,5; за амилазата 7,2; за аргиназата 9,7 и т.н.
Константа на Михаелис-Ментен:
В основата на анализа, изследователите поставят образуването на междинен ензим-субстратен комплекс (ES). Михаелис и Ментен са разгледали случая на едносубстратна еднопосочна реакция, протичаща в два етапа със скоростни константи k+1, k-1 и k+2:
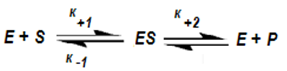
Анализират математическата зависимост на скорост на образуване (V) и разграждане на ензим-субстратния комплекс от концентрацията на субстрата [S]. Извеждат теоретично уравнение, отразяващо експериментално установената правоъгълна хипербола (фиг.57). За разлика от химичните реакции, където скоростта нараства пропорционално на концентрацията на реагиращите вещества, тук скоростта нараства линейно само при ниски субстратни концентрации.
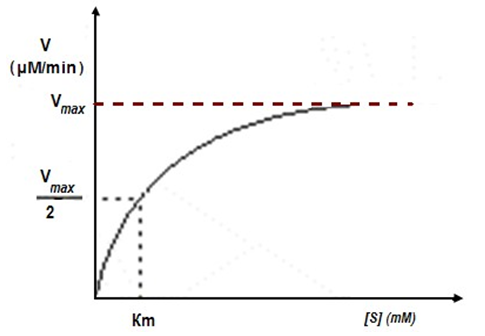
Фигура 57. Експериментална крива - правоъгълна хипербола, описваща зависимостта на скоростта на ензимната реакция от концентрацията на субстрата
Извеждането на уравнението на Михаелис и Ментен се основава на допусканията, че:
- 1) k+2< << k-1 , k+2<< k+1;
- 2) [S] >> [E0],
Тогава общата скорост на процеса V ще се определя от най-бавния етап(разграждането на ЕS до ензим и продукт), т.е. V = k+2 [ES].
Концентрацията на ЕS остава постоянна (стационарна), тъй като
Vобразуване на ES = Vразграждане на ES
или съгласно закона за действие на масите:
k+1([E0] - [ES]) [S] = k-1 [ES] + k+2 [ES]
k+1 [E] [S] - k+1 [ES][S] = (k-1 + k+2)[ES]
k+1 [E] [S] = k+1 [ES][S] + (k-1 + k+2)[ES]
k+1 [E] [S] = (k+1[S] + k-1 + k+2)[ES]
След решение спрямо [ES] се получава:
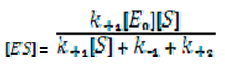
Разделяме числителя и знаменателя на k+1 и получаваме:
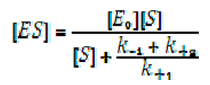 (1)
(1)
Началната скорост може да се изрази като скорост на разпадането на
[ES], която има скоростна константа k+2, т.е.
V0= k+2[ES]
Заместваме в уравнение (1), [ES] с неговото равно и получаваме:
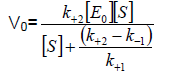 (2)
(2)
Ако означим с 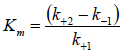 изразим като k+2.E0, то уравнението придобива следния вид:
изразим като k+2.E0, то уравнението придобива следния вид:
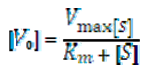 (3)
(3)
Това е уравнение на Михаелис-Ментен за скоростта на едносубстратни ензимни реакции, отразява количественото съотношение между началната скорост на реакцията, максималната скорост и изходната концентрация на субстрата.
Регулация на ензимната активност
Поради непрекъснатата промяна на околната среда, реакциите на метаболизма трябва да бъдат подложени на фин контрол, за да могат да осигуряват поддържането на постоянни параметри във вътреклетъчната среда на организма — състояние, известно като хомеостаза. Възможността за ускоряване или намаляване (премахване и задържане) на каталитичното действие, или възможността за потискане на активността или премахване на подтискащите активността на ензимите фактори, се нарича регулиране на ензимното действие.
В клетката съществуват няколко механизма за регулация активността на ензимите:
Достъпност на субстрата или кофермента – тук е в сила закона за действие на масите, при постоянна температура скоростта на химичната реакция е пропорционална на произведението на концентрациите на реагиращите вещества. Например, в ЦТК такова вещество (субстрат), което регулира ензимната активност е оксалацетат – наличието му стартира реакциите на цикъла.;
Компартментализация – съсредоточение на субстратите и ензимите в един и същи компартмент (един органел) – ендоплазматичен ретикулум, митохондрии и т.н.;
Изменение на количеството на ензима – може да настъпи в резултат на повишаване или намаляване синтеза. Изменението на скоростта на синтез на ензима настъпва в резултат от изменение количеството на хормон или субстрат.
Частичен протеолизис на проензими – много ензими се синтезират като проензими, които за да се активират претърпяват частичен протеолизис. Например, активирането на протеолитичните ензими от храносмилателния тракт – трипсиноген и пепсиноген.;
Алостерична регулация – тези ензими са изградени от две и повече субединици. Едните субединици съдържат активния център, а другите алостеричния център, който се явява регулаторен. Присъединяването на ефектора към алостеричния център изменя конформацията на белтъка и съответно неговата активност. Алостеричните ензими в повечето случаи стоят в началото на метаболитните пътища и тяхната активност определя протичането на следващите реакции. Тези ензими се наричат ключови ензими.
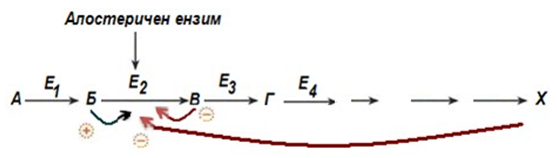
Фигура 58. Обща схема на алостерична ензимна регулация
В качество на отрицателен регулатор може да бъде крайния метаболит на реакционния път или продукта на дадената реакция, т.е. включва се механизма за обратна отрицателна връзка. Ако регулатор се явява първия метаболит или субстрата на реакцията, говорим за пряка регулация, тя може да бъде положителна и отрицателна. Регулатори могат да бъдат и метаболити от други биохимични пътища, които се явяват свързани по някакъв начин с реакцията.
Белтък-белтъчно взаимодействие – регулатор е не метаболит от биохимичните процеси, а специфични белтъци. Механизма е сходен с този на алостеричния център, след въздействие на фактор върху специфични белтъци, се изменя активността на тези белтъци и те на свой ред изменят въздействието на необходимия ензим. Например, ензима аденилатциклаза е чувствителен към въздействието на мембранния белтък G, който се активира при въздействие на някои вещества върху клетката (например адреналин или глюкагон).
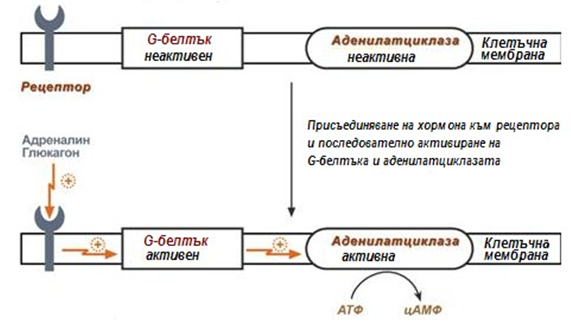
Фигура 59. Регулация на ензимната активност чрез белтък-белтъчно взаимодействие
Ковалентна (химическа) модификация – обратимо присъединяване или отделяне на група, при което се изменя активността на ензима. Тази често група е фосфорна киселина, по-рядко метилова или ацетилна група.
Регулацията на метаболизма позволява на организмите да реагират адекватно на сигналите и да взаимодействат според потребностите си със заобикалящата ги среда. За осъществяването на нужната регулация са необходими две важни условия:
- първо регулация на ензимната активност, т.е. как активността на ензима се повлиява в отговор на постъпващи сигнали;
- второ контрола на ензима, включва влиянието върху скоростта на целия метаболитен път, при манипулиране активността на даден ензим.
Например, даден ензим може да бъде високо регулиран, т.е. да търпи голяма промяна в ензимната активност, но като цяло това да променя малко интензитета на метаболитния път, т.е. този ензим се явява неподходящ за регулация на метаболитния път. Регулирането на ензимното действие става чрез:
- 1) промени в абсолютното количество ензим, като се индуцира или репресира неговата синтеза, или скоростта на разграждане на ензимната молекула.;
- 2) промени в активността на налични ензими - посредством ефектори (инхибитори и активатори) и чрез обратимо ковалентно модифициране, най- често фосфорилиране-дефосфорилиране.
Активатори на ензимната активност. Активатори са вещества, които повишават скоростта на катализираната реакция, могат да бъдат ензими, метаболити, метални йони. Някои метални йони (калциеви, магнезиеви, натриеви, манганови, медни и др.) увеличават ензимната активност, трудно да се разграничи точно дали йонът действа като активатор или като кофактор. Тук спадат случаите на алостерично активиране и на превръщане на неактивни ензимни предшественици (преензими или проензими) в активни ензими.
Инхибирането е процес на прекъсване или задържане на ензимното действие. Инхибиторите са вещества, които в резултат на химична реакция се свързват с ензимите в т. нар. ензимно-инхибиторни комплекси. Тяхното образуване е свързано с намаляване или изчезване на активността. Подобен ефект върху ензимите имат температури над 60oС и крайните стойности на рН. Въпреки, че тези фактори водят до загуба на активността на ензимите, те не се отнасят към ензимните инхибитори. Според начина на свързване на инхибиторите с ензимите се различават два типа инхибитори:
- необратими инхибитори – свързват се здраво с функционални групи от активния център на ензима, предоставена от апоензима или коензима, чрез здрави химични връзки и блокират трайно каталитичното му действие. Повечето от тях са силно действащи отрови.;
- обратими инхибитори - свързват се обратимо с ензима, като при това се конкурират със субстрата.
Необратимо инхибиране. При това инхибиране, не се наблюдава селективност на действието, блокират се голяма група ензими имащи еднакви функционални групи. Такава функционална група може да бъде сулфхидрилната SH-група, която се съдържа в апоензима на голям брой ензими, или хидроксилната (-ОН). Най-често необратимите инхибитори са отрови, съдържащи йони на тежките метали - сребро, живак, арсен и др., които се свързват с тиоловите групи на ензима, в резултат на което следва неговото денатуриране и утаяване. Инхибитори, които водят до блокиране на хидроксилната група са нервнопаралитичните газове на бойните отровни вещества зарин, зоман, табун както и повечето средства за растителна защита - паратион.
Обратимо инхибиране – може да бъде конкурентно и неконкурентно.
Обратимо конкурентно инхибиране - ензимът е принуден да избира с кого да се свърже измежду конкуриращите се субстрат (S) и инхибитор (I). Поради това тези инхибитори се наричат още конкурентни, в повечето случаи това са структурни аналози на субстратите. Ензимът не може да взаимодейства със субстрата, защото активния му център е зает от структурния двойник, наречен структурен аналог на субстрата.
Обратимо неконкурентно инхибиране - инхибиторът и субстратът не се конкурират за активния център. Инхибиторът се свързва специфично и обратимо с други участъци от ензимната молекула, извън нейния активен център. Такива центрове се наричат алостерични (гр.алос -, друг; гр.стерос - пространство). Те са многобройни и свързвайки се с ензима деформират пространствена структура на полипептидната верига. В други случаи обаче, активността на ензимите се повишава, защото активният център пасва по- добре на субстрата - алостерично активиране.
5.2. Класификация на ензимите - основни принципи. Класове и подкласове.
Международният съюз по биохимия и молекулярна биология (IUBMB) е приел система за ензимна номенклатура, която позволява трайна и недвусмислена класификация, така че всеки новооткрит ензим да намира мястото в нея:
- 1) Реакциите и ензимите, които ги катализират, се разделят на 6 големи групи, всяка от които съдържа от 4 до 13 подгрупи.
- 2) Ензимното име има 2 части. Например за ензима малат дехидрогеназа, първата част съобщава името на субстрата (в случая малат). Втората част, окончаваща на -аза (в случая дехидрогеназа), посочва типа на катализираната реакция.
- 3) Всеки ензим има кодов номер, състоящ се от 4 числа. Първото дава типа на реакцията (главната група); второто определя подгрупата, третото - подподгрупата и четвъртото е индивидуалният номер на ензима.
Например, алкохолдехидрогеназата има кодов номер ЕС.1.1.1.1 (Съкращението ЕС идва от Enzyme Commission): 1 - оксидоредуктаза; 1 – действа на ОН – групата като донор; 1 - с НАД като акцептор; 1 - първи ензим в подподгрупа 1.
За да се даде наименование на ензимите, съществуват два начина:
- Систематично название – съгласно съвременната класификация http://www.chem.qmul.ac.uk/iubmb/enzyme/. Често това название е дълго и сложно, затова при много ензими съществува и т.нар. работна название;
- Тривиално наименование – название, което ензима е получил във входа на неговото откриване и проучване. Независимо от това, тези ензими също притежават систематично наименование.
Броят на ензимите, участващи в осъществяване на метаболизма на клетката надвишава 3000. Те са разпределени в шест главни групи:
- І.Оксидоредуктази;
- ІІ. Трансферази;
- ІІІ. Хидролази;
- ІV. Лиази;
- V. Изомерази;
- VІ. Синтетази.
5.2.1. Оксидоредуктази
Ензимите от този клас катализират окислително-редукционни реакции, лежащи в основата на биологичното окисление. Този клас притежава 22 подкласа. Коферменти на този клас са НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоева киселина.
Най-разпространените работни названия на оксидоредуктазите са следните:
- Дехидрогенази – оксидоредуктази, които отделят 2 атома водород от различни субстрати, в качество на акцептор използват различни молекули, но не и кислород.
- Редуктази – ако преноса на водорода от молекулата на донора е трудно доказуем, то оксидоредуктазата се нарича редуктаза.
- Оксидази – оксидоредуктази, които катализират окисление на субстрата с молекулярен кислород в качество на акцептор на електроните, без да се включва кислород в молекулата на субстрата.
- Монооксигенази – оксидоредуктази, които катализират внедряване на един атом кислород в молекулата на субстрата, с молекулен кислород в качеството на донор на кислород.
- Диоксигенази – оксидоредуктази, които катализират внедряване на два атома кислород в молекулата на субстрата, с молекулен кислород в качеството на донор на кислород.
- Пероксидази – оксидоредуктази, които катализират реакции с водороден прекис в качество на акцептор на електрони.
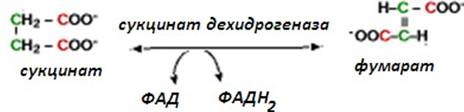
Систематичното название се образува по схемата:
донор на електрони : акцептор на електрони – оксидоредуктаза.
| Систематично название: | алкохол : НАД-оксидоредуктаза; |
| Тривиално име: | алкохолдехидрогеназа; |
| Клас: | 1. Оксидоредуктази; |
| Подклас: | 1.1. действащи на СН-ОН-групата (донор); |
| Подподклас: | 1.1.1. с НАД+ или НАДФ+ като акцептор; |
| Класификационен номер: | ЕС 1.1.1.1. |
| Кофактори: | НАД. Желязо или цинк. |
5.2.2. Трансферази
Трансферазите катализират реакции на прехвърляне на различни групи от един субстрат (донор) до друг (акцептор), участват в реакции на взаимнопревръщане на различни вещества, обезвреждат природни и чужди съединения. Коферменти са пиридоксалфосфат, тетрахидрофолиева киселина, коензим А, метилкобаламин. Класът се подразделя на 9 подкласа в зависимост от строежа на преносимата група.
Често работното име на трансферазите е кинази. Това са трансферази, катализиращи пренос на фосфат от АТФ на субстрат (монозахариди, белтъци и др.), т.е. фосфотрансферази.
Даден е пример за фосфотрансферазата фосфофруктокиназа, която пренася фосфатна група от АТФ върху фруктозо-6-фосфат.
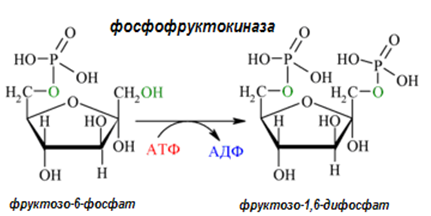
| Систематично название: | АТФ:фруктозо-6-фосфат - фосфотрасфераза; |
| Тривиално име: | фосфофруктокиназа; |
| Клас: | 2.Трансферази; |
| Подклас: | 2.7. Пренасят фосфосъдържащи групи; |
| Подподклас: | 2.7.1. с алкохолна група като акцептор; |
| Класификационен номер: | ЕС 2.7.1.11. |
Прехвърлят се разнообразни групи съдържащи 1 въглероден атом (метилова, хидроксиметилова, формилова групи), ацилни радикали, гликозилни групи, амино-групи, фосфатни групи и др.
5.2.3. Хидролази
В присъствие на вода, те катализират реакции на хидролиза. Хидролазите осъществяват вътрешномолекулен разрив на химичните връзки в субстрата (с изкл. на С-С връзките), чрез присъединяване на Н2О, подразделят се на 13 подкласа. Коферменти нямат. Хидролазите са широко представени като ензими от стомашно-чревния тракт (пепсин, трипсин, липаза, амилаза и др.), разграждат макромолекулите до лесно абсорбируеми мономолекули.
Названието на хидролазите се образува от названието на субстрата с окончание „-аза“ – колагеназа, амилаза, липаза, ДНК-аза. Най-често се срещат следните работни названия:
- Естерази – хидролизират естери;
- Липази – хидролизират неутрални мазнини (триацилглицероли);
- Фосфатази – хидролизират моноестери на фосфорната киселина;
- Гликозидази – хидролизират О- и S-гликозидни връзки;
- Протеази, пептидази – хидролизират белтъци и пептиди;
- Нуклеази – хидролизират нуклеинови киселини.
Систематичното название се образува:
Хидролизуем субстрат : отделяна група при хидролиза.
Даден е пример за хидролазата триацилглицерол липаза, която хидролизира триацилглицероли до глицерол и висши мастни киселини.
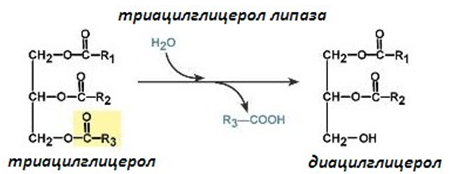
| Систематично название: | триацилглицерол : ацилхидролаза; |
| Тривиално име: | триацилглицерол липаза; |
| Клас: | 3. Хидролази; |
| Подклас: | 3.1. Действащи на сложни естери; |
| Подподклас: | 3.1.1. Хидролази на карбоновите киселини; |
| Класификационен номер: | ЕС 3.1.1.3. |
Хидролизират се различни типове ковалентни връзки - естерни, киселинноамидни, пептидни, гликозидни, етерни, киселинно-анхидридни и др.
5.2.4. Лиази
Лиазите катализират разкъсване на С-О, С-С, С-N и други връзки, а също така обратими реакции на откъсване на различни групи по нехидролитичен начин. Разделят се на 7 подкласа. Тези реакции се съпровождат с образуване на двойни връзки или присъединяване на група към мястото на двойната връзка. Лиазите са сложни ензими. Коферменти са пиридоксалфосфат, тиаминдифосфат, участват магнезий, кобалт.
Систематичното название се образува:
Разграждания субстрат : отделяна група-лиаза
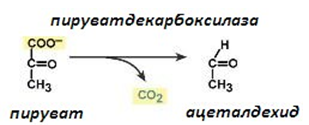
| Систематично название: | 2-оксокиселина:карбокси-лиаза; |
| Тривиално име: | пируватдекарбоксилаза; |
| Клас: | 4. Лиази; |
| Подклас: | 4.1. Въглерод-въглерод-лиази; |
| Подподклас: | 4.1.1. Карбокси-лиази; |
| Класификационен номер: | ЕС 4.1.1.1. |
| Кофактори: | Тиаминдифосфат. |
5.2.5. Изомерази
Изомеразите катализират изомерни превръщания в рамките на една молекула. Те са сложни ензими. Коферменти са пиридоксалфосфат, дезоксиаденозилкобаламин, глутатион, фосфатни монозахариди и др. Разделят се на 6 подкласа в зависимост от типа на реакцията. Например, в първи подклас са рацемазите (обратимо превръщане на L- и D- стереоизомерите) и епимеразите (превръщане на изомери, имащи повече от един център на асиметрия, например, α-D-глюкоза в β-D-глюкоза). Изомеразните реакции могат да протичат като цис-транс-превръщане, вътрешномолекулна оксидоредукция, вътрешномолекулно пренасяне на групи и пр.
Систематичното название се образува:
Субстрат – [ ] – реакция, където [ ] – посочва същността на реакцията, например, „номер на изменения С атом“, изменение „цис-транс“, изменение „кето-енол“, изменение „алдозо-кетозо“.
Даден е пример за триозофосфатизомеразата, която превръща дихидроксиацетонфосфата в глицералдехид-3-фосфат.
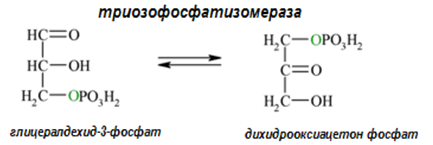
| Систематично название: | D-глицералдехид-3-фосфат–алдозо-кетозо-изомераза; |
| Тривиално име: | триозофосфат-изомеразата; |
| Клас: | 5. Изомерази; |
| Подклас: | 5.3. Вътрешномолекулни оксидоредуктази; |
| Подподклас: | 5.3.1. Катализиращи взаимнопревръщане на алдози в кетози; |
| Класификационен номер: | ЕС 5.3.1.1. |
5.2.6. Лигази (Синтетази)
Лигазите катализират реакции на присъединяване на две молекули една към друга с използване на енергия от макроергична връзка на АТФ (или други макроергични съединения). Лигазите са сложни ензими. Те съдържат нуклеотидни (УТФ), биотинови (витамин Н), фолиеви коферменти. Разделят се на 6 подкласа.
Систематичното название се образува:
Субстрат 1 : субстрат 2 – лигаза

| Систематично название: | пируват : карбокси–лигаза (АДФ-образуваща); |
| Тривиално име: | пируваткарбоксилаза; |
| Клас: | 6. Лигази; |
| Подклас: | 6.4. Образуващи връзка С-С; |
| Подподклас: | 6.4.1. Образуващи връзка С-С; |
| Класификационен номер: | ЕС 6.4.1.1. |
| Кофактор: | Биотин. Магнезий. Цинк. |
Забележка: Разликата между синтази и синтетази е, че само синтетазите изискват енергия, най-често под форма на АТФ.
Терминологичен речник
- #Енергетичен праг на химична реакция - за да се осъществи дадена химична реакция, реагиращите вещества трябва да имат сумарна енергия по-висока от т.нар. енергетична бариера или енергетичен праг.
- #Активираща енергия (Еа*) – минимума енергия, която веществата трябва да притежават, за да бъдат техните удари ефективни при сблъсък и да формират активен комплекс, в който се разрушават старите връзки и се формират нови. Арениус е въвел понятието, което охарактеризира величината енергетичен праг на химичната реакция.
- #Активен (каталитичен) център - мястото на осъществяване на самата каталитична реакция и пряката връзка със субстрата. Субстратната молекула се свързва с активния център, който е изграден от малко на брой аминокиселини приближени пространствено при нагъването на полипептидната верига.
- #Оксидоредуктази - катализират окислително-редукционни реакции, лежащи в основата на биологичното окисление. Този клас притежава 22 подкласа. Коферменти на този клас са НАД, НАДФ, ФАД, ФМН, убихинон, глутатион, липоева киселина.
- #Редуктази – ако преноса на водорода от молекулата на донора е трудно доказуем, то оксидоредуктазата се нарича редуктаза.
- #Оксидази – оксидоредуктази, които катализират окисление на субстрата с молекулярен кислород в качество на акцептор на електроните, без да се включва кислород в молекулата на субстрата.
- #Дехидрогенази – оксидоредуктази, които отделят 2 атома водород от различни субстрати, в качество на акцептор използват различни молекули, но не и кислород.
- #Монооксигенази – оксидоредуктази, които катализират внедряване на един атом кислород в молекулата на субстрата, с молекулен кислород в качеството на донор на кислород.
- #Диоксигенази – оксидоредуктази, които катализират внедряване на два атома кислород в молекулата на субстрата, с молекулен кислород в качеството на донор на кислород.
- #Пероксидази – оксидоредуктази, които катализират реакции с водороден прекис в качество на акцептор на електрони.
- #Трансферази - катализират реакции на прехвърляне на различни групи от един субстрат (донор) до друг (акцептор), участват в реакции на взаимнопревръщане на различни вещества, обезвреждат природни и чужди съединения. Коферменти са пиридоксалфосфат, тетрахидрофолиева киселина, коензим А, метилкобаламин. Класът се подразделя на 9 подкласа в зависимост от строежа на преносимата група.
- #Хидролази - в присъствие на вода, катализират реакции на хидролиза. Хидролазите са широко представени като ензими от жлъчно-чревния тракт(пепсин, трипсин, липаза, амилаза и др.), разграждат макромолекулите до лесно абсорбируеми мономолекули.
- #Лиази - катализират разкъсване на С-О, С-С, С-N и други връзки, а също така обратими реакции на откъсване на различни групи по нехидролитичен начин. Разделят се на 7 подкласа. Тези реакции се съпровождат с образуване на двойни връзки или присъединяване на група към мястото на двойната връзка. Лиазите са сложни ензими. Коферменти са пиридоксалфосфат, тиаминдифосфат, участват магнезий, кобалт.
- #Изомерази - катализират изомерни превръщания в рамките на една молекула. Те са сложни ензими. Коферменти са пиридоксалфосфат, дезоксиаденозилкобаламин, глутатион, фосфатни монозахариди и др. Разделят се на 6 подкласа в зависимост от типа на реакцията.
- #Лигази - катализират реакции на присъединяване на две молекули една към друга с използване на енергия от макроергична връзка на АТФ (или други макроергични съединения). Лигазите са сложни ензими. Те съдържат нуклеотидни (УТФ), биотинови (витамин Н), фолиеви коферменти. Разделят се на 6 подкласа.
- # Максимална скорост (Vmax) - постига се при пълно насищане на ензима и отсъствие на свободни ензимни молекули. Тогава концентрацията на ензим- субстратния комплекс е числено равна на началната концентрация на ензима.
- #Начална скорост (V0) - за определянето и се използват значителни концентрации на субстрат, надвишаващи тези на ензима. При това условие, промяната на концентрацията на субстрат в първите няколко секунди от реакцията е незначителна и с подходящ математически апарат, може да се определи началната скорост на реакцията.;
- #Константа на Михаелис-Ментен (Km) - показател за сродството на ензима към неговия субстрат в рамките на ензим-субстратния комплекс - колкото по- голяма е тя, толкова по-лесно ензима се освобождава от своя субстрат;
- #Оборотно число - кинетичния смисъл е максималния брой субстратни молекули, които могат да се преработят от един активен център за една секунда.
- #Константа на специфичност - кинетичния смисъл е максималния брой на субстратни молекули превърнати за единица време от един активен център при еднакви условия на афинитет към субстрата.




