НЕНАСИТЕНИ АЛИФАТНИ ВЪГЛЕВОДОРОДИ
АЛКИНИ
I. ОПРЕДЕЛЕНИЕ, ХОМОЛОЖЕН РЕД И НОМЕНКЛАТУРА

Алкините са ненаситени въглеводороди с тройна въглерод – въглеродна връзка в молекулата си. Алкините образуват хомоложен ред с обща формула СnH2n-2 (n ≥ 2).
Алкините съдържат в молекулата си два Н атома по-малко от съответните алкени и четири по-малко от съответните алкани със същия брой С атоми.
Zapaze aftorski prava
Според номенклатурата IUPAC наименованията на алкините се образуват от наименованията на алканите със същия брой С атоми, като наставката –ан се заменя с –ин и с арабска цифра се означи мястото на тройната връзка.
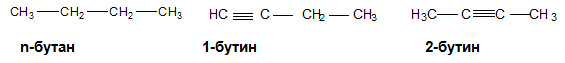
При образуване на наименованието на алкини с по-сложен строеж е необходимо да се спазват следните правила:
- За главна се избира най-дългата права верига, която съдържа тройната връзка;
- Номерирането на главната верига започва от този край, до който е най-близо тройната връзка;
- Положението на тройната връзка се означава, като пред основното наименование се прибави арабската цифра, с която е означен С атом, от който започва тройната връзка;
- Наименованиеята на заместителите към главната верига се поставя пред основното наименование по азбучен ред, заедно с цифрата, показваща мястото на заместителите в главната верига.
II. ИЗОМЕРИЯ

Подобно на алкените, за алкините с повече от три въглеродни атома също е характерна верижна и позиционна изомерия.

При пентина също са възможни верижни и позиционни изомерии. Позиционни изомери са 1-пентин и 2-пентин, а 1-пентин и 3-метил-1-бутин са верижни изомери.
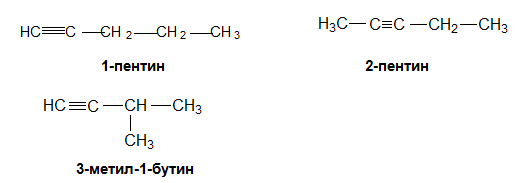
III. МОЛЕКУЛЕН СТРОЕЖ

Въглеродните атоми в молекулите на алкините, които са свързани с тройна връзка са в sp-хибридно състояние т.е. в хибридизацията участват един s- и един p- електрон. При в sp С атом остават два нехибридизирани py и pz-електронни облака.
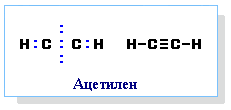
В молекулата на етина при припокриването на sp- с sp-хибридизирани орбитали се образува една σ-връзка С–С, а при припокриването на sp- с s-орбиталите на двата Н атома - две С–Н σ-връзки. Всички σ-връзки образуващи σ-скелета на етина лежат в една равнина под ъгъл 180ο – линейна структура. При sp С атоми остават по две нехибридизирани орбитали - py и pz. Те се препокриват две по две странично под и над равнината на σ-връзките и образуват две π-връзки, коитолежат в равнини перпендикулярни на равнинната на σ-връзките и взаимно перпендикулярни (фиг. 62). Образуваните π-орбитали са по-отдалечени от ядрата на sp С атоми, π-електроните по-слабо се привличат от тях, което определя значителната им подвижност, по-малката здравина на π-връзката и по-лесната ѝ поляризация от σ-връзката. Тройните връзки в молекулите на алкените са изградена от една C–C σ- връзка (sp-sp) и две C–C π-връзки (py–py и pz–pz). Според стерeохимичната теория, тройната връзка между sp С атоми се реализира чрез обща стена на тетраедрите.
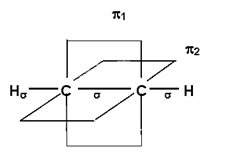
Фиг. 62. Молекулен строеж на етин
В молекулата на етина тройна връзка е с дължина 1,2 Å = 0,120 nm, т.е. тя е по-къса от тази при етена и етана. В sp-хибридно състояние C атом проявява максимална електроотрицателност, спрямо sp2- и sp3-хибридните състояния. Връзката между sp-хибриден С-атом и Н атом е по-силно полярна, спрямо тази при алканите и алкените, което определя способността на алкините, освен към присъединителни и към заместителни реакции, въпреки ненаситения им характер.

електроотрицателност на С атом
IV. ФИЗИЧНИ СВОЙСТВА

Физичните свойства на алкините не се различават съществено от съответните на алкани и алкени. Първите членове на хомоложния ред на алкините са газообразни, средните – течни, а висшите са твърди вещества. С увеличаване на молекулната им маса постепенно нарастват физичните им константи. Разтворимостта им във вода е ниска, но е по-висока в сравнение с тази на алканите и алкените, което се дължи на по- голямата възможност за поляризиране на тройната връзка в присъствието на водните диполи. Етинът е безцветен газ, без миризма, малко по – лек от въздуха. Във вода е малко разтворим, но по-добре разтворим от етана и етена.
V. ХИМИЧНИ СВОЙСТВА

V.1. ПРИСЪЕДИНИТЕЛНИ РЕАКЦИИ
Алкините са високо реактивоспособни съединения. За тях са характерни присъединителни реакции (по електрофилен механизъм). От друга страна, подобно на етина алкините с тройна връзка в края на С-верига проявяват киселинни свойства и могат да взаимодействат с активни метали. Реакциите на присъединяване протичат на два етапа, чрез последователно разкъсване на двете π-връзки.
V.1.1. Халогениране
Алкините присъединяват халогенни елементи (хлор, бром), като на първия етап се разкъсва едната π-връзка и се получава халогеноалкен:
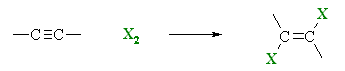
Подобно на алкените, алкините обезцветяват бромна вода (качествена реакция за сложна връзка), като се разкъсват и двете π-връзки и се получава 1,1,2,2-тетрабромоалкани.

Механизъм на реакция на присъединяване на Br2 към бутин-2:
V.1.2. Хидрохалогениране (присъединяване на халогеноводород)
Присъединяването на халогеноводород към алкини протича на два етапа по механизъм на електрофилно присъединяване. Реактивността на халогеноводородите следва реда: HI > HB r> HCl > HF. При присъединяване на халогеноводород (бромоводород, хлороводород) към симетричен алкин на първия етап на реакцията се получава халогенопроизводно на съответния алкен със същия брой С атоми. На втория етап -втората молекула халогеноводород се присъединява при спазване правилото на Марковников (виж алкени!) и като краен реакционен продукт се получава дихалогено- производно на алканите, при което и двата халогенни атома са свързани при един и същ С атом.
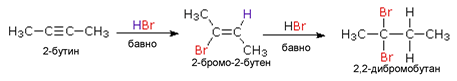
Присъединяването на халогеноводород към несиметрични алкини е реакция, при която се спазва правилото на Марковников. Присъединяването на бромоводород към пропин води до получаване на основен междинен продукт 2-бромопропан и малки количества на 1-бромопропан (страничен продукт), но като краен реакционен продукт на втория етап се получава 2,2-дибромопропан.

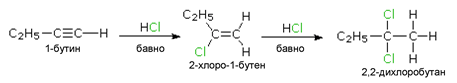
Реакцията на присъединявне на хлороводород към 1-бутин (несиметричен алкин) също спазва правилото на Марковников (линк Тема: Ненаситени алифатни въглеводороди - Алкени, V.1.3. Електрофилно присъединяване на халогеноводород (NH3) към алкени).
Присъединяването на халогеноводород към алкини може да спре до получаване на алкенхалогенопроизводно, т. нап. при присъединявнето на хлороводород към етин се получава винилхлорид, който е изходна суровина за производството на поливенилхлорид.
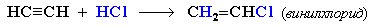
V.1.3. Хидрогениране
Каталитичното присъединяване на водород към алкини протича на два етапа. На първият етап на реакцията се получават алкени, на втория - алкани. Хидрогенирането на алкини може да се стопира до реакционен продукт алкен, ако се използва по-слабо активен катализатор (частично дезактивиран Pd).
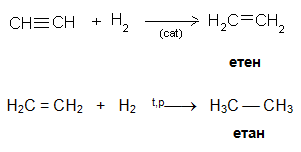
Алкините се редуцират до транс алкени в присъствие на Na в NH3 среда.
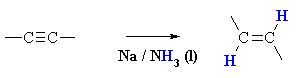
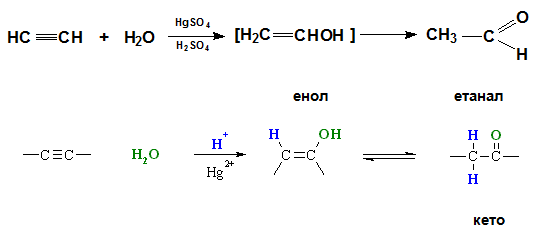
V.1.4. Хидратиране
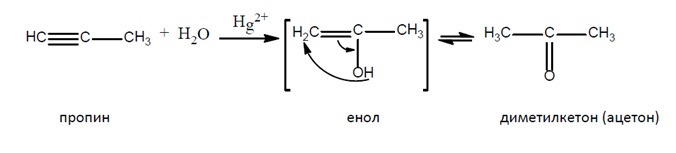
Хидратацията на алкини в присъствие на катализатор живачни соли (Hg2+) е известна като реакция на Кучеров.Етинът присъединява вода в присъствие на Hg2+, при което се получава нетраен междинен продукт – енол, който се стабилизира чрез кето-енолна тавтомерия до ацеталдехид.
Присъединяването на вода към хомолози на алкините също води до получаване на нестабилни еноли, които се стабилизират в резултат на кето-енолна тафтомерия до кетони:
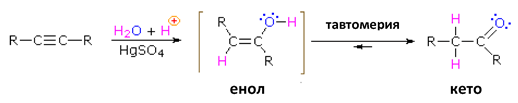
При хидратиране на несиметрични алкини се спазва правилото на Марковников като се получават кетони:
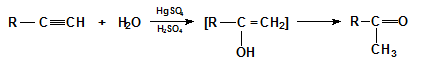
Механизъм на реакцията на Кучеров:
V.1.5. Присъединяване на циановодород
Присъединяване на циановодород към етин е реакция, която има промишлено значение, тъй като полученият акрилонитрил е изходна суровина за производството на синтетичното влакно полиакрилонитрил (ПАН).
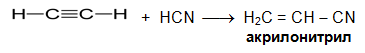
V.1.6. Полимеризация
Нискомолекулните алкини при нагряване тримеризират до ароматни въглеводороди, например етинът при нагряване и катализатор (въглерод) тримеризира до бензен (реакция на Зелински):
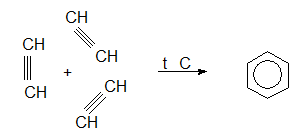
При същите условия хомолозите на етина тримеризират до получаване на алкилбензени.
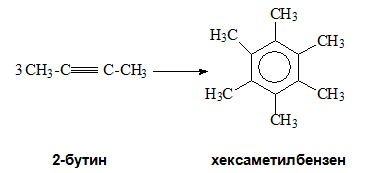
V.2. ЗАМЕСТИТЕЛНИ РЕАКЦИИ
Полярният характер връзката между sp-хибридизирания С атом и Н атом е причина последният да може да се замества с алкален или алкалоземен метал. Получените съединения имат йонен характер и се наричат алкинилиди (етинилиди) или карбиди.
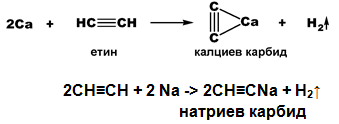
V.3. ОКСИДАЦИЯ (ОКИСЛЯВАНЕ)
-
Горене
Алкините на въздуха изгарят до въглероден диоксид и вода. В молекулите на алкините се съдържат по-малко водородни атоми от алканите и алкените затова изгарянето им става сравнително по-трудно и горят с пушлив пламък.
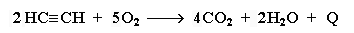
- Енергична оксидация
При енергична оксидация във воден разтвор тройната връзка в молекулите на алкините се разкъсва и се получава смес от карбоксилови киселини.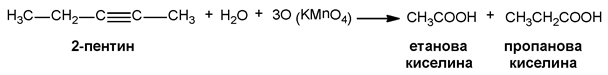
Реакциите на обезцветяване на разтворите на KMnO4 или бромна вода, са реакции за качествено доказване на сложна връзка.
VI. ПОЛУЧАВАНЕ НА АЛКИНИ

Алкините не се срещат в природата и се получават чрез синтетични методи.
VI.1. ДИРЕКТЕН СИНТЕЗ НА ЕТИН
Етин се получава като се пропуска водород през волтова дъга между графитови (въглеродни) електроди:
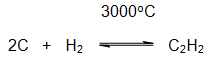
VI.2. ПИРОЛИЗ НА МЕТАН – ПОЛУЧАВА СЕ ЕТИН
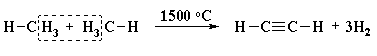
VI.3. ЛАБОРАТОРЕН МЕТОД
Лабораторно етин се получава от калциев карбид (СаС2) и вода. Този метод се използва в практиката за получаване на етин в оксиженови горелки.
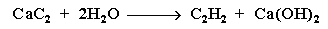
VI.4. РЕАКЦИЯ НА ДВОЙНО ЕЛИМИНИРАНЕ НА 1,2-ДИХАЛОГЕННИ АЛКАНИ
(вицинални, съседни)
При взаимодействие на 1,2-дихалoгеноалкани или 1,1-дихалoгеноалкани и натриев амид (или алкохолен разтвор на KOH) се получават алкини.
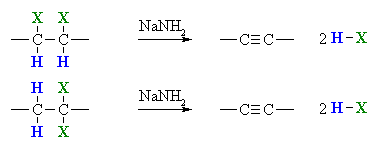
VI.5. ПОЛУЧАНАНЕ НА ЕТИН ОТ МЕТАН
За промишлени нужди етин се получава от природен газ богат на метан. Методът изисква висока температура, която се постига чрез частично изгаряне на природен газ с добавен към него кислород или чрез електрическа дъга.
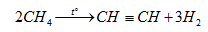
VI.6. УДЪЛЖАВАНЕ НА ВЪГЛЕРОДНАТА ВЕРИГА НА АЛКИНИ – вариант на синтеза на Вюрц
Методът е приложим само, ако тройната връзка е в началото на въглеродната верига на алкина (полярна С-Н при тройната връзка) тогава Н-атом може да се замести с метал и да се получи алкинид, който реагира с метилйодид до получаване на алкин с по-дълга въглеродна верига.
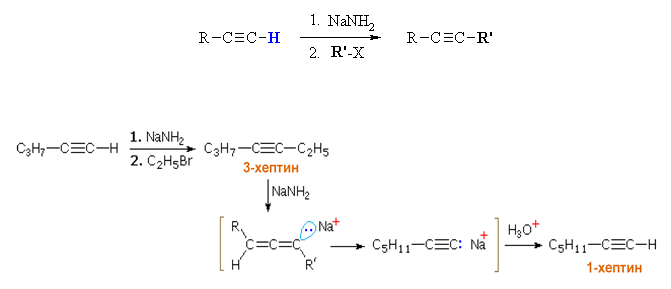
VI.7. ДЕХИДРОГЕНИРАНЕ НА АЛКАНИ
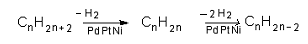
При дехидрогениране на етан се получава етин:
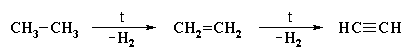
VII. ПРЕДСТАВИТЕЛИ

VII.1. ЕТИН (АЦЕТИЛЕН)
Етинът е гориво за ацетиленовите горелки, които се използват за рязане на метали. Тои е изходна суровина за получаване на оцетна (етанова) киселина, етилов алкохол, разтворители, лекарства, поливинилхлорид и др.
VII.2. ПРОПИН
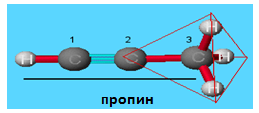
Пропинът е безцветен газ с неприятна миризма. Той се използва за производство на синтетичен каучук и като ракетно гориво.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
алкинид - органично химично съединение производно на 1-алкин, в молекулата на който Н-атом, свързан за С-атом от тройната връзка, е заместен с метален йон
вицинален -функционални групи, свързани за два съседни С-атома
реакция на Зелински - тримеризация на нискомолекулните алкини до ароматни въглеводороди при нагряване катализатор
реакция на Кучеров - хидратация на алкини в присъствие на катализатор живачни соли (Hg2+)
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
- Алкините могат да се различат от алкани с (възможен е повече от един верен отговор):
А. разтвор на основа
B. разтвор на киселина
C. бромна вода
D. KMnO4
E. всички посочени реактиви
F. нито един от реактивите.
Обосновете отговора си.
Отговор
- Кой от посочените въглеводороди образува соли с алкални метали:
А. 2-бутен
B. пропан
C. бутадиен
D. пропин.
Отговор
- Въглеродни атоми в sp3 и sp хибридизация има в молекулите на:
A. С6Н12
B. С6Н14
C. С5Н8
D. С7Н14
Отговор
- Колко третични С-атоми в sp хибридизация има в молекулата на 4,5-диетил-6-метил-2-хептин:
А. 0
B. 2
C. 1
D. 3.
Обосновете отговора си.
Отговор
- При тримеризация на ацетилен се получава:
А. толуен
B. циклохексен
C. бензен
D. циклохексан.
Напишете химичната реакция.
Отговор
- Допишете следния преход:
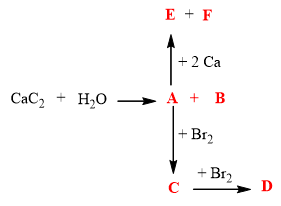
Отговор
- Напишете химичната реакция на хидратация на пропин.
Отговор
- Кои са възможните видове изомерия за алкина 4-метил-2-хексин:
А. верижна изомерия
B. позиционна изомерия
C. оптична изомерия
D. геометрична изомерия.
Напишете структурните формули на всички възможни изомери.
Отговор
- В молекулата на кой въглеводород се съдържат въглеродни атоми с най-голяма електроотрицателност:
А. етан
B. бензен
C. етин
D. метан
Участие в какъв тип реакции обуславя тази висока електроотрицателност?
Отговор
- При присъединяване на 2 mol HI към 1-пентин се получава:
A. 1,1-дийодопентан
B. 1,2-дийодопентан
C. 2,2-дийодопентан
D. липсва верен отговор.
Напишете химичната реакция.
Отговор