ДИКАРБОКСИЛОВИ И ПОЛИКАРБОКСИЛОВИ КИСЕЛИНИ
I. ОПРЕДЕЛЕНИЕ, КЛАСИФИКАЦИЯ, НОМЕНКЛАТУРА, ХОМОЛОЖЕН РЕД

I.1. ОПРЕДЕЛЕНИЕ
Те могат да се разгледат и като производни на въглеводородите, в чиито молекули два или повече Н-атоми са заместени с −COOH групи.
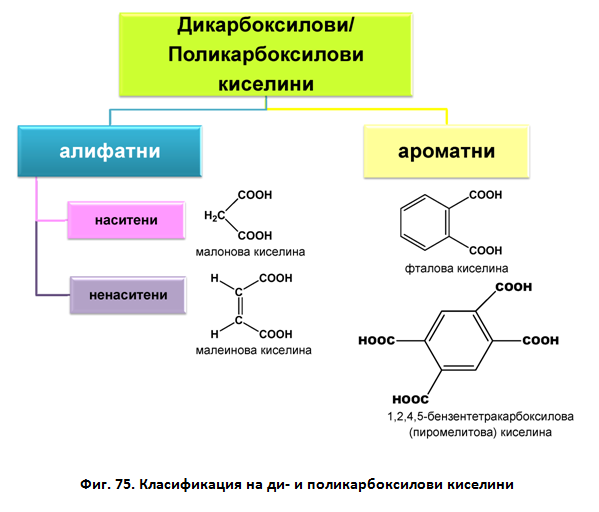
I.2. КЛАСИФИКАЦИЯ
I.3. НОМЕНКЛАТУРА
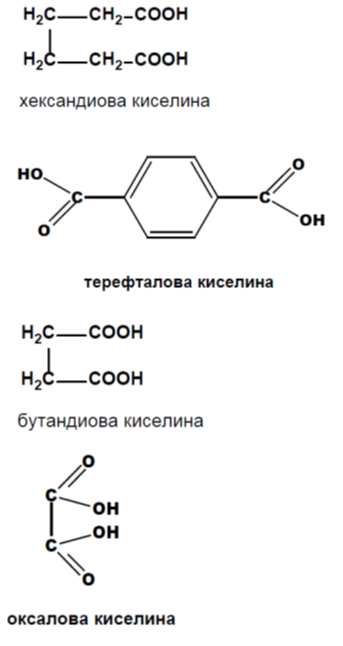
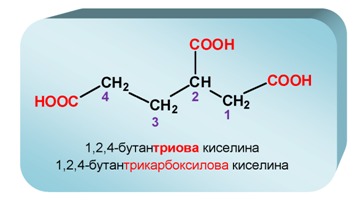
Наименованията на ди-, три- и поликарбоксиловите киселини по IUPAC се образуват като към наименованието на съответния въглеводород със същия брой C-атоми се прибави окончанието „-диова”, „-триова” и т.н. в зависимост от броя на карбоксиловите групи, и думата „киселина”.
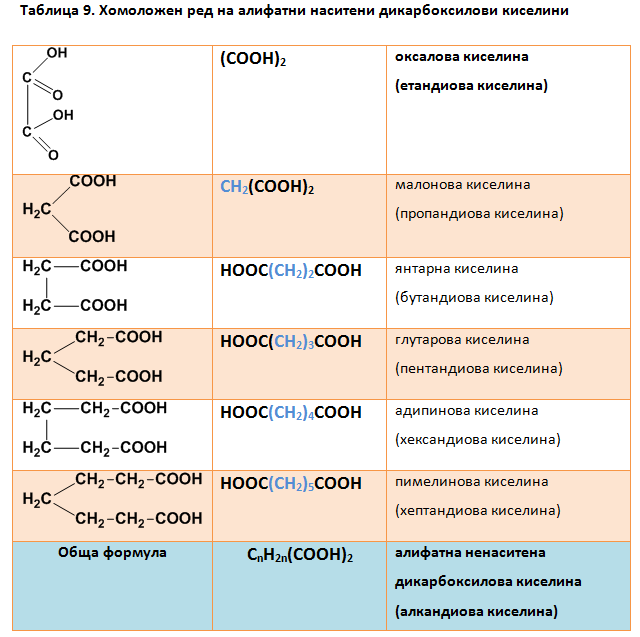
I.4. ХОМОЛОЖЕН РЕД НА АЛИФАТНИ НАСИТЕНИ ДИКАРБОКСИЛОВИ КИСЕЛИНИ
II. ИЗОМЕРИЯ

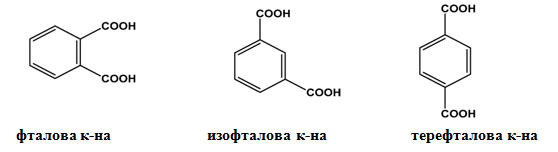
II.1. ПОЗИЦИОННА ИЗОМЕРИЯ
Позиционна изомерия се наблюдава, например, при най-простата ароматна дикарбоксилова киселина - бензен-1,2-дикарбоксиловата киселина. Трите позиционни изомера се различават по взаимното разположение на двете −COOH групи в бензеновото ядро:
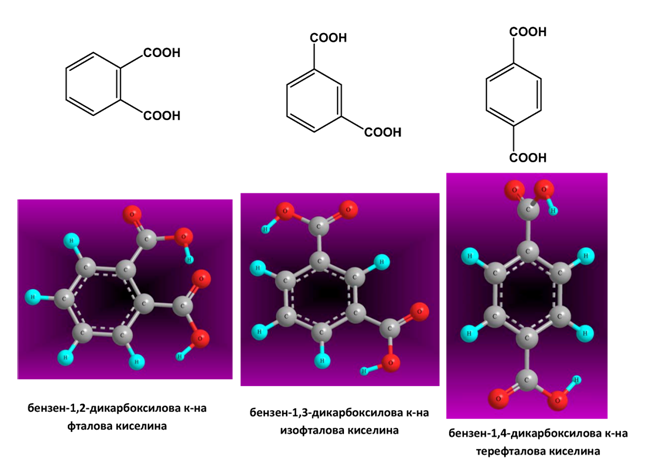
II.2. ГЕОМЕТРИЧНА ИЗОМЕРИЯ
Геометрична изомерия се наблюдава при ненаситените дикарбоксилови киселини. Ако еднаквите заместители при C-атоми от двойната връзка се намират от една и съща страна на равнината на двойната връзка, то конфигурацията се нарича цис-, а когато заместителите са от двете различни страни на тази равнина - транс-. Например, ЦИС-ТРАНС изомерите на 1,2-етилендикарбоксиловата киселина (бутендиова киселина) са съответно малеинова и фумарова киселина:
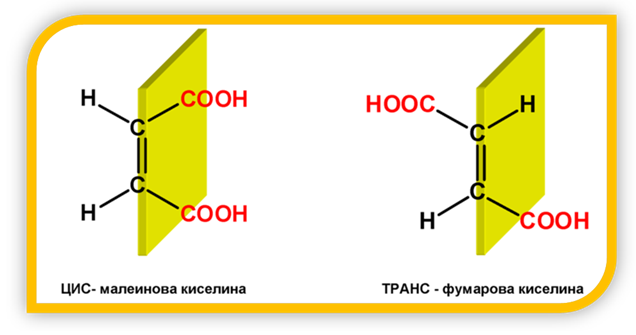
III. МОЛЕКУЛЕН СТРОЕЖ


|
Дикарбоксиловите киселини са по-силни от съответните моно-карбоксилови. |
При дикарбоксиловите киселини електронно-акцепторното влияние на едната −COOH група повишава дисоциационната константа на другата −COOH група (Ка1). Образуваният монокарбоксилатен анион понижава киселинността на недисоциираната −COOH група поради влиянието на неговия (+I)-ефект, т.е. Ка2 < Ка1.
Стойностите на рКа1 на оксаловата киселина (рКа1 1.19) и малоновата киселина (рКа1 2.83) са значително по-ниски от тези на монокарбоксиловите киселини, което показва, че тези дикарбоксилови киселини се дисоциират до монокарбоксилатен анион по-лесно. Тази по-висока степен на йонизация се дължи на способността на втората недисоциирана −COOH група да стабилизира отрицателния заряд на спрегнатата основа чрез образуването на вътрешно-молекулна Н-връзка ( Темa 4: Междумолекулни сили и връзки. Водородна връзка, т.II.2. Вътрешномолекулна водородна връзка). Освен това стойностите на рКа2 на двете дикарбоксилови киселини (рКа2 4.21 за оксалова киселина; рКа2 5.69 за малонова киселина) са значително по-високи от тези на монокарбоксиловите, което също се дължи на наличието на водородна връзка между моно-йонизирания комплекс и Н-атом на втората −COOH група:
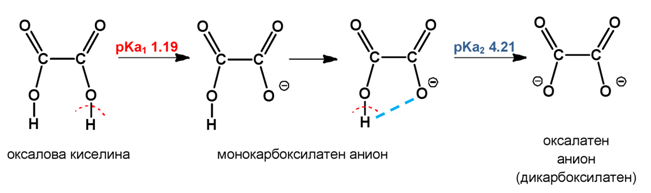
При янтарната (рКа1 4.2; рКа2 5.6) и глутаровата киселини (рКа1 4.4; рКа2 5.4), обаче стойностите на рКа1 са по-високи от тези на оксаловата и малоновата.
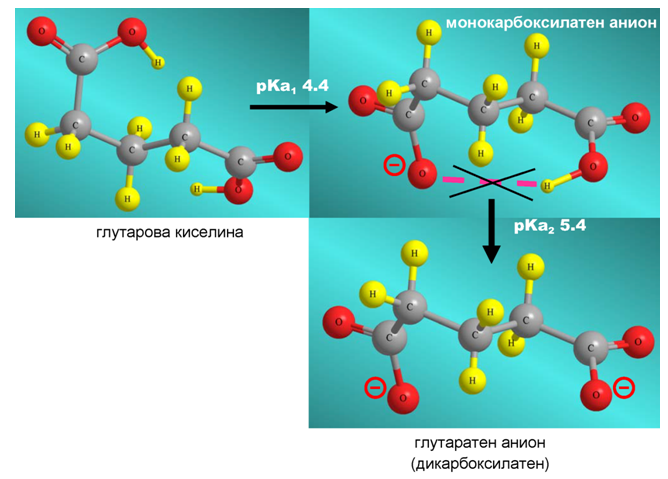
Тази разлика в молекулните им свойства се дължи на пространствено по-раздалечените −COOH групи в молекулите на двете киселини и невъзможността за образуване на вътрешномолекулна Н-връзка ( Тема 4: Междумолекулни сили и връзки. Водородна връзка, т. II.2. Вътрешномолекулна водородна връзка), която да стабилизира монокарбоксилатния анион.
IV. ФИЗИЧНИ СВОЙСТВА

V. ХИМИЧНИ СВОЙСТВА

- Дикарбоксиловите киселини имат свойства аналогични на монокарбоксиловите ( Тема 13: Монокарбоксилови киселини, т.V. Химични свойства) - образуват соли, амиди, естери.
- Специфични свойства
Дикарбоксиловите киселини имат и някои специфични свойства, които се дължат на взаимното разположение и влияние на двете −COOH групи.
При нагряване:
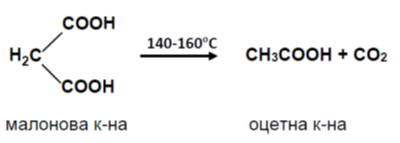
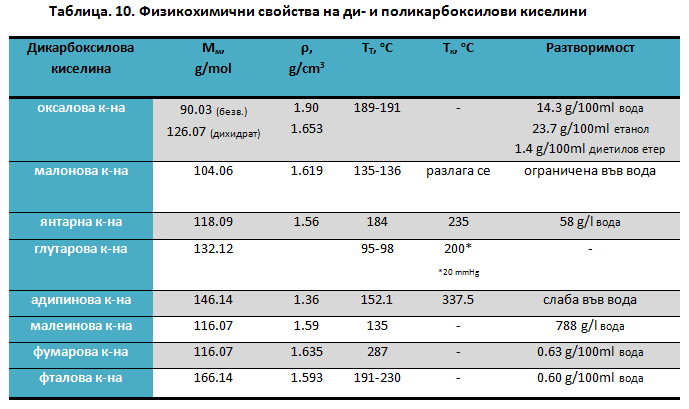
 При температури 140 - 160оС оксаловата и малоновата киселини се декарбоксилират, като продукти на реакциите са съответните монокарбоксилови киселини:
При температури 140 - 160оС оксаловата и малоновата киселини се декарбоксилират, като продукти на реакциите са съответните монокарбоксилови киселини:
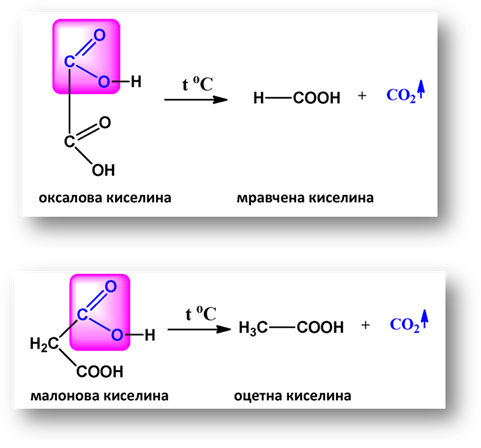
 Янтарната и глутаровата киселини при същите условия се обезводняват вътрешномолекулно, при което се получават пръстенни анхидриди със стабилни пет- и шест-атомни пръстени:
Янтарната и глутаровата киселини при същите условия се обезводняват вътрешномолекулно, при което се получават пръстенни анхидриди със стабилни пет- и шест-атомни пръстени:
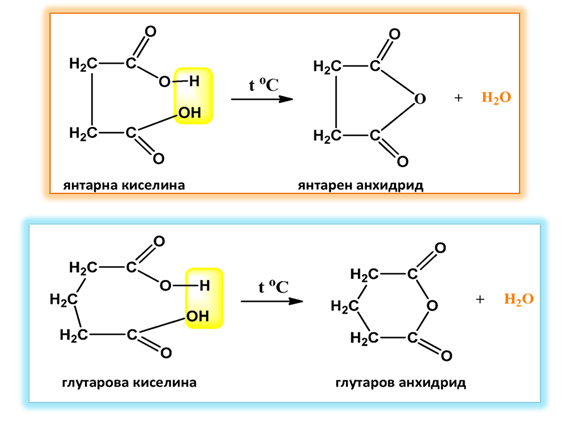
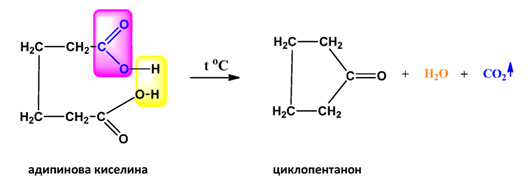
 Адипиновата и пимелиновата киселини претърпяват едновременно вътрешномолекулно обезводняване и декарбоксилиране, при което се получават циклични кетони с пет- и шест-атомни пръстени:
Адипиновата и пимелиновата киселини претърпяват едновременно вътрешномолекулно обезводняване и декарбоксилиране, при което се получават циклични кетони с пет- и шест-атомни пръстени:
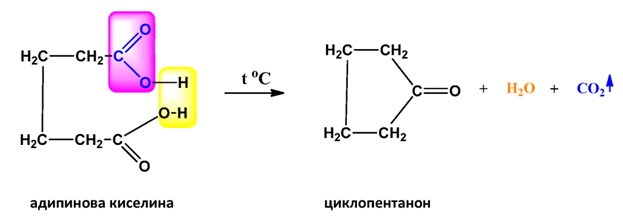
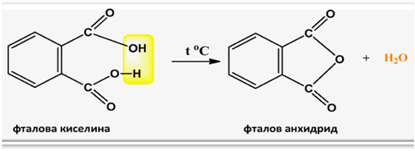
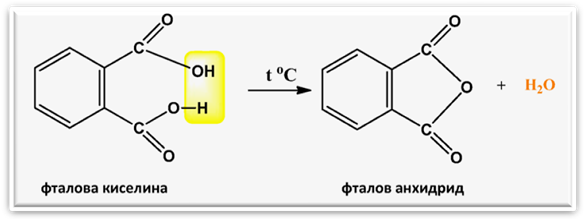
 Фталовата киселина лесно претърпява вътрешно-молекулно обезводняване при температури близки до температурата й на топене, при което се получава фталов анхидрид:
Фталовата киселина лесно претърпява вътрешно-молекулно обезводняване при температури близки до температурата й на топене, при което се получава фталов анхидрид:
VI. БИОЛОГИЧНО ЗНАЧЕНИЕ НА ДИ- И ПОЛИКАРБОКСИЛОВИТЕ КИСЕЛИНИ

- Оксалова киселина - Н2С2О4
- Малонова киселина - HOOC(CH2)COOH
- Янтарна киселина - HOOC(CH2)2COOH
- Фумарова киселина - HOOC-(CH=CH)-COOH
- Малеинова киселина - HOOC-(CH=CH)-COOH

Оксаловата (1,2-етандиова) киселина кристализира из водни разтвори, като големи безцветни призматични кристали, които съдържат две молекули вода. Тя е отровна и предизвиква парализа на нервната система. Разтваря се във вода и етанол, слабо в етер. При загряване с глицерин образува мравчена киселина. Среща се в свободно състояние в листата на цвекло и като калиев хидрогеноксалат в киселец и ревен. Калиевият и амониевият оксалат са разтворими във вода, а калциевият е неразтворим. Използва се за почистване на метали и като междинен продукт при химични синтези. Поради избелващото си действие се използва в текстилната и кожухарската промишленост. В бита намира приложение за почистване на петна от ръжда или кръв върху бели тъкани (за предпочитане памучни). Оксаловата киселина се използва за борба с вароатозата по пчелите. Оксаловата киселина не е полезна за организма, защото намалява Ca в него, като образува калциеви съединения, неразтворими във вода. Това води до появата на камъни в бъбреците. Леталната доза при хора (орален прием) е 600mg/kg.
Йонизираната форма, естерите и солите на малоновата (пропандиова) киселина се наричат малонати. Калциевата й сол се среща във високи концентрации в захарното цвекло и житните растения. Малонова киселина е класически пример за конкурентен инхибитор: действа срещу сукцинат дехидрогеназа (комплекс II) в дихателната верига на електронния транспорт. Тя се характеризира с повишена СН-киселинност на α-водородните атоми от метиленовата група, което определя нейната приложимост и тази на малоновия естер в органичния синтез.
Янтарната киселина (бутандиова киселина), е дикарбоксилова киселина, която представлява безцветни кристали, а солите й се наричат сукцинати. Разтворима е във вода и етанол. Среща се в кехлибара, някои водорасли, захарната тръстика. Получава се при ферментацията на захар под влиянието на дрожди и плесени. Може да се получи от малеинова киселина чрез каталитична реакция. Използва се за производството на янтарен анхидрид и за производство на полиестери. Тя е също и компонент на някои алкидни смоли. В хранително-вкусовата и фармацевтичната промишлености намира приложение най-вече като регулатор на киселинността. Янтарната киселина участва в цикъла на Кребс, характерен за всички аеробни организми и в електротранспортната верига на митохондриите.
Фумаровата киселина (транс-бутендиова киселина) е бяло кристално вещество. Тя има вкус на плодове. Солите и естерите й се наричат фумарати. Фумаровата киселина се съдържа в растението фумария (Fumaria Officinalis), някои видове гъби и лишеи. Фумаратът е междинен продукт в цикъла на лимонената киселина, която се използва от клетките за производство на енергия под формата на аденозин трифосфат (АТФ). Тя се формира от окисляването на сукцинат от ензима сукцинат дехидрогеназа. Фумаратът се конвертира от ензима фумараза до малат. Човешката кожа произвежда по естествен път фумарова киселина, когато е изложена на слънчева светлина. Под формата на хранителна добавка, тя се използва като регулатор на киселинността и се означава с Е номер E297 - при производството на напитки и бакпулвер, като заместител на винена киселина и лимонената киселини. Използва се и в производството на полиестерни смоли и полиалкохоли и като фиксиращо средство за бои. Диметил фумаратът значително намалява прогресията на инвалидността при множествена склероза.
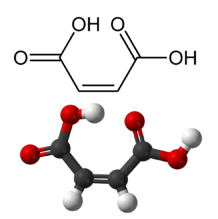
Малеиновата киселина (цис-бутендиова киселина) е по-нестабилна и по-разтворима във вода от фумаровата киселина. Солите и естерите й се наричат малеати. В промишлеността малеинова киселина се получава чрез хидролиза на малеинов анхидрид чрез окисление на бензен или бутан. Тя се използва като суровина при производството на глиоксилова киселина чрез озонолиза. Малеатният йон в биохимията е инхибитор на трансаминазните реакции.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
дисоциационна константа (Ка, Кb, Kd) - равновесна константа, характеризираща склонността на химичните съединения да се дисоциират

ВЪПРОСИ И ЗАДАЧИ
1. Напишете структурните формули на следните карбоксилови киселини: хександиова киселина, терефталова киселина, бутендиова киселина, оксалова киселина.
Отговор
2. Напишете структурните формули и наименования на позиционните изомери на бензен-1,2-дикарбоксиловата киселина.
Отговор
3. Възможна ли е геометрична изомерия при ди- и поликарбоксиловите киселини? Обосновете отговора си.
Отговор
4. Довършете следната химична реакция. Напишете наименованията на изходния реактив и реакционните продукти.
Отговор
5. Сравнете силата на оксаловата и оцетната киселина. Обосновете отговора си.
Отговор
6. Напишете общата молекулна формула на алифатните дикарбоксилови ненаситени киселини.
Отговор
7. Каква химична реакция ще протече при нагряване на малоновата киселина (пропандиова киселина) до 140 - 160оС. Напишете уравнението на химичната реакция и наименованията на продуктите.
Отговор
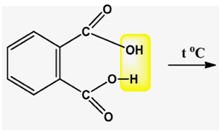
8. Довършете следната химична реакция:
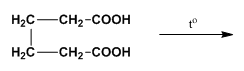
Напишете наименованията на участващите в нея органични и неорганични химични съединения.
Отговор
9. По кои химични свойства дикарбоксиловите киселини си приличат и по кои се различават от съответните монокарбоксилови киселини? Коя е причината за различията, ако има такива?
Отговор
10. Кое от твърденията е вярно за ди- и поликарбоксиловите киселини? (възможен е повече от един верен отговор)
А. В молекулата на янтарната киселина 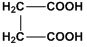 има условия за образуване на вътрешномолекулна Н-връзка.
има условия за образуване на вътрешномолекулна Н-връзка.
В. Дикарбоксиловите киселини могат да се естерифицират.
С.При нагряване на всички дикарбоксилови киселини протича вътрешномолекулно обезводняване.
D. За дикарбоксиловите киселини е характерна оптична изомерия.
Отговор