Валентност. Степен на окисление
В темата е представена детайлна дефиниция на основните химични понятия валентност и степен на окисление. Специално внимание е отделено на причините за съществуването на постоянна и променлива валентност от гледна точка на спецификата на електронната конфигурация във външните електронни слоеве на атомите на химичните елементи в основно и възбудено състояние. Акцентира се и върху алгоритъма и правилата, които трябва да се спазват при определянето на степента на окисление на елементите в дадено химично съединение.
Темата е онагледена с детайлни фигури, анимации и конкретни примери с цел по-доброто усвояване на представения теоретичен материал от студентите.
I. Валентност

Поредният номер (Z) на химичните елементи в периодичната система (Приложение 1. Периодична система) представлява броя на протоните, съставящи атомните им ядра и броя на електроните в електронните обвивки на атомите им
Електроните от електронните обвивки на атомите се класифицират в две групи в зависимост от способността на атомите да образуват химични връзки:
√ електрони, които са свързани с ядрата в устойчиви групировки и за откъсването на които е необходима енергия, по-голяма от тази, която се освобождава при обикновена химична реакция;
√ електрони от най-външните (предпоследни, последни), незапълнени електронни слоеве - валентни електрони, които са по-слабо свързани с атомните ядра и участват в образуването на химични връзки. Например, при s-елементите валентните електрони са от s- атомните орбитали (s-АО), а при р-елементите - от s-АО и p-AO. Следователно, в тези случаи валентните електрони се намират в най-външния електронен слой - това са т. нар. типични елементи. При преходните елементи - d-елементите, валентните електрони са от s-AO и d-AO, т.e. те се намират в най-външния слой и в d-подслоя на втория отвън навътре електронен слой.
 |
Броят на химичните връзки, които даден елемент образува с друг елемент или броят на единичните (несдвоени) електрони, които участват в образуването на химични връзки се нарича валентност. Валентността е винаги цяло положително число. |
В зависимост от това дали при преминаване на даден химичен елемент от основно във възбудено състояние се наблюдава увеличаване на броя на валентните електрони, химичните елементи се класифицират в две групи: елементи с постоянна и елементи с променлива валентност.
I.1. Постоянна валентност
Постоянна химична валентност проявяват химични елементи (напр. H, O, Na, Al, N (Приложение 1. Периодична система), при които преминаването на атомите им от основно във възбудено състояние не е свързано с повишаване на броя на валентните електрони в p- и d-поднивата на последните и предпоследни енергетични нива, в резултат на разединяване на готови електронни двойки.

Фиг. 1. Воород (Н) – постоянна валентност
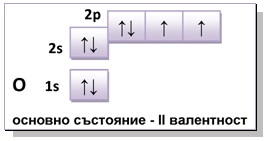
Фиг. 2. Кислород (О) – постоянна валентност
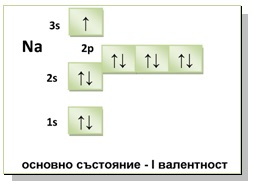
Фиг. 3. Натрий (Na) – постоянна валентност
Фиг. 4. Азот (N) – постоянна валентност
I.2. Променлива валентност
Постоянна химична валентност проявяват химични елементи (напр. Cl, S, C, B) (Приложение 1. Периодична система), при които преминаването от основно във възбудено състояние е свързано с разединяване на електронни двойки и повишаване на броя на валентните електрони във външните електронни слоеве (p-, d-поднивата). В резултат на това валентността на химичните елементи се повишава и те могат да имат по няколко валентни състояния.
Фиг. 5. Въглерод (С) – променлива валентност
Фиг. 6. Сяра (S) – променлива валентност
Фиг. 7. Хлор (Cl) – променлива валентност
II. Степен на окисление (оксидация)

Величината степен на окисление има условен характер и характеризира състоянието на атомите на химичните елементи в химичните съединения.
 |
Степента на окисление (окислително число) на химичните елементи в съединения с ковалентна химична връзка се изразява с условния заряд, който атомите биха получили, ако химичното съединение се разглежда като йонно. |
 |
Степента на окисление на химичните елементи в йонните съединения съвпада със заряда на йоните. |
 |
Степента на окисление може да бъде цяло или дробно, положително или отрицателно число, или нула. |
В молекулите на простите вещества (H2, Cl2, I2 и др.) (Приложение 1. Периодична система) общата електронна двойка принадлежи в еднаква степен на двата атома. Следователно степента на окисление на химичните елементи е равна на нула. Това се отнася и за свободните атоми (Na, K, S, C (Приложение 1. Периодична система).
При съединенията с полярна ковалентна химична връзка (Тема 3: Видове химични връзки в неорганичните и органични съединения т. I.2. Ковалентна полярна връзка), например HCl (Hδ+Clδ-), степените на окисление на H и Cl съвпадат със заряда, който те биха получили, ако полярната връзка се превърне в йонна, т.е. H+1, Cl-1.
При съединенията с йонна химична връзка ( Тема 3: Видове химични връзки в неорганичните и органични съединения т. II. Йонна връзка), например NaCl, степента на окислениее равна на заряда на йоните: Na+1, Cl-1.
При определяне на степента на окисление на елементите в дадено химично съединение могат да се спазват следните основни правила:
 Елементите с метален химичен характер се характеризират само с положително окислително число - Na+1OH, Ca+2CO3;
Елементите с метален химичен характер се характеризират само с положително окислително число - Na+1OH, Ca+2CO3;
 Елементите от IA група (Приложение 1. Периодична система) имат степен на окисление +1; от IIA група - +2, и от IIIA група - +3.
Елементите от IA група (Приложение 1. Периодична система) имат степен на окисление +1; от IIA група - +2, и от IIIA група - +3.
 Висшата положителна степен на окисление на повечето елементи е равна на номера на групата от периодичната система, в която те се намират:
Висшата положителна степен на окисление на повечето елементи е равна на номера на групата от периодичната система, в която те се намират:
хлор, Cl - VII група (Приложение 1. Периодична система) →Висшата степен на окисление +7;
сяра, S - VI група (Приложение 1. Периодична система) →Висшата степен на окисление +6.
 Във всички химични съединения H има степен на окисление +1, с изключение на алкалните и алкалоземни хидриди: NaH-1, CaH2-1.
Във всички химични съединения H има степен на окисление +1, с изключение на алкалните и алкалоземни хидриди: NaH-1, CaH2-1.
 В оксидите кислородът е от -2 степен на окисление, с изключение на F2O+2 и пероксидите H+12O-12..
В оксидите кислородът е от -2 степен на окисление, с изключение на F2O+2 и пероксидите H+12O-12..
 Алгебричната сума от степените на окисление на всички атоми в едно химично съединение е равна на нула:
Алгебричната сума от степените на окисление на всички атоми в едно химично съединение е равна на нула:
Например ако трябва да се определи степента на окисление на S в натриевия тиосулфат, то:
Na2+1S2XO3-2
2.(+1)+2.X+3.(-2) = 0
Следователно x = +2, т.е. степента на окисление на S е +2.
Ключови понятия и съкращения
АО - атомна орбитала - едно-електронна вълнова функция в сферически симетричното електрично поле на атомното ядро, зададена от главното n, орбиталното l и магнитното m квантови числа
валентни електрони - електрони от най-външните (предпоследни, последни) незапълнени електронни слоеве
валентност - броят на химичните връзки, които даден елемент образува с друг елемент или броят на единичните електрони, които участват в образуването на химични връзки
пореден номер - броят на протоните, съставящи атомните ядра на химичните елементи и броя на електроните в електронните обвивки на атомите им;
степен на окисление (окислително число) - изразява се с условния заряд, който атомите биха получили, ако химичното съединение се разглежда като йонно
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
- С постоянна или променлива валентност се характеризира химичният елемент Cl? Обосновете отговора си като изобразите електронните му конфигурации в основно и възбудено състояние.
- Определете степените на окисление на елементите в съединенията: K2CrO4, KMnO4, H2C2O4, NaNO3, BaSO4..
- В кои от следните вещества: SO3, H2, Na2S, HBr, N2, NO, Na, степента на окисление на елементите е равна на нула? Обосновете отговора си и определете степените на окисление на елементите в другите съединения.
- Кое от посочените твърдения не е вярно:
Отговор
Отговор
Отговор
А. Висшата положителна степен на окисление на повечето елементи е равна на номера на групата от периодичната система, в която те се намират.
B. Алгебричната сума от степените на окисление на всички атоми в едно химично съединение е равна на нула
C. Елементите с метален химичен характер се характеризират само с положително окислително число;
D. В оксидите кислородът винаги е от -2 степен на окисление.
Отговор


Проект „Развитие на център за електронни форми на дистанционно обучение в Тракийски университет“ BG051PO001-4.3.04-0026



