Съвременно схващане за химична връзка
Темата е своеобразен теоретичен фундамент, върху който се основават всички следващи теми, разглеждащи строежа, структурата, физичните свойства и химични отнасяния на различните класове органични съединения. Изяснени са съвременните квантово-механични представи за химичната връзка, а именно метода на валентните връзки, метода на молекулните орбитали и метода на граничните орбитали. С цел по-доброто възприемане и усвояване на представения теоретичен материал, темата е онагледена с графики и диаграми.
I. Квантово-механични представи/теории за химичната връзка

Съгласно квантовата механика, състоянието на електрона в атома може да се опише с цял набор от вълнови функции (орбитали), които се получават като решения на уравнението на Шрьодингер (1926). При решаването му, наред със собствените функции, се получават и т.нар. собствени стойности на енергията – това е енергията на електрона, когато той заема съответната орбитала. Познаването на стойностите на енергията на орбиталите позволява предвиждането на последователността в заемането на орбиталите от електрони. Най-общо енергията на орбиталите нараства със стойността на главното квантово число (n). Съвременното тълкуване на химичните връзки и механизма на тяхното образуване се основава на три теории: метод на валентните връзки (МВВ), метод на молекулните орбитали (ММО)и метод на граничните орбитали (МГО).
II. Метод на валентните връзки (МВВ)

Теорията на Люис (1916) се основава на взаимодействието между разнотипни или еднотипни атоми, притежаващи електрони с антипаралелен спин, които при приближаване на атомите на достатъчно близко разстояние, се свързват помежду си в обща електронна двойка. През 1927 г. е била формулирана теорията на Хайтлер-Лондон, която за първи път предлага решение на уравнението на Шрьодингер за вълновите функции при образуването на ковалентна връзка Н−Н ( Тема 3: Видове химични връзки в неорганичните и органични съединения, т. I. Ковалентна връзка) във Н2 молекула.
По-късно, Полинг обединява допусканията на Люис и Хайтлер-Лондон и развива нова теория, наречена „ модерна теория на валентните връзки”, която обеднява концепциите за резонансаи хибридизацията.
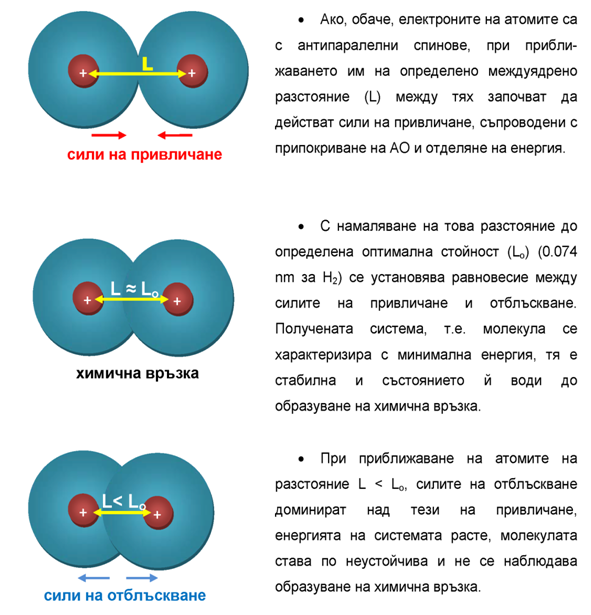
Според МВВ при приближаването на два атома (например Н), притежаващи електрони с паралелен спин настъпва момент, в който започват да им действат сили на отблъскване и за да се свържат помежду си, трябва да се изразходва определено количество енергия за преодоляване на отблъскването.
Фиг. 8. Криви на енергия на взаимодействие между атоми, имащи електрони с паралелни и антипаралелни спинове и зависимост от междуядреното разстояние

III. Метод на молекулните орбитали (MMO)

Методът на молекулните орбитали (ММО), разработен първоначално от Хунд и Мъликан (1927-1929), се основава на вълновите характеристики на електроните при формирането на химичните връзки. ММО позволява да се прогнозира разпределението на електроните в молекулата, което на свой ред може да помогне да се предскажат молекулни свойства като форма, магнетизъм и кратност на химичната връзка.
Молекулата се разглежда като цялостна система, в която валентните електрони, образуващи химична връзка, се припокриват и формират молекулни орбитали (МО). Според някои от приближените решения на уравнението на Шрьодингер, МО се представят като линейни комбинации от атомни орбитали (АО). По този начин при взаимодействието на n AO се образуват n MO.
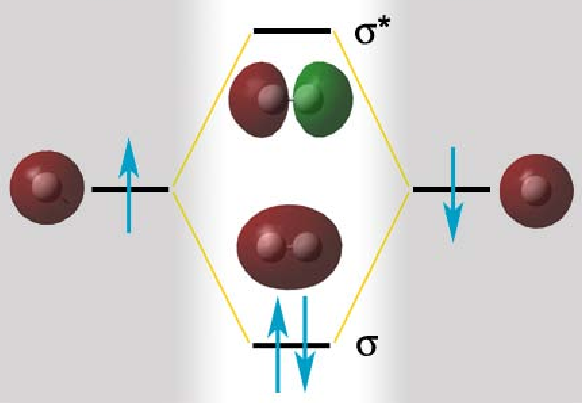
При водородната молекула: при комбинацията на две 1s AO се получават две МО. Едната от тях има енергия по-ниска от енергията на 1s AO и се нарича свързваща МО (σ), а другата, с енергия по-висока от тази на 1s AO, се нарича антисвързваща МО (σ*):
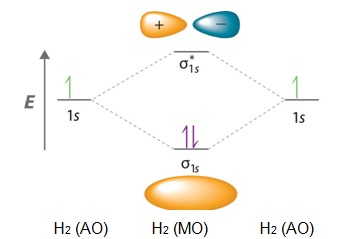
Фиг. 9. Образуване на свързваща и антисвързваща МО в молекулата на H2
При свързващата МО електронната двойка се намира почти изцяло в пространството между двете ядра. Силата на привличане между ядрата и електронната двойка е значителна, а сила на отблъскване почти не действа, което определя минималната енергия на σ-МО. Електронната плътност между ядрата на антисвързващата МО е равна на нула. Следователно ако електронната двойка попадне на σ*-МО, тя няма да се разположи в пространството между двете ядра, което определя по-високата й енергия. Освен това наличието на електрони върху σ*-МО намалява здравината на химичната връзка и може да доведе до разрушаването й. От друга страна тези електрони са причина за по-голямата реактивоспособност на молекулите.
Преходът на електрон от 1sАО на σ-МО е съпроводен с освобождаване на енергия:
ΔЕ = ЕАО - ЕМО ,
където ЕАО е енергията на 1sAO, a EMO - енергията на σ-МО
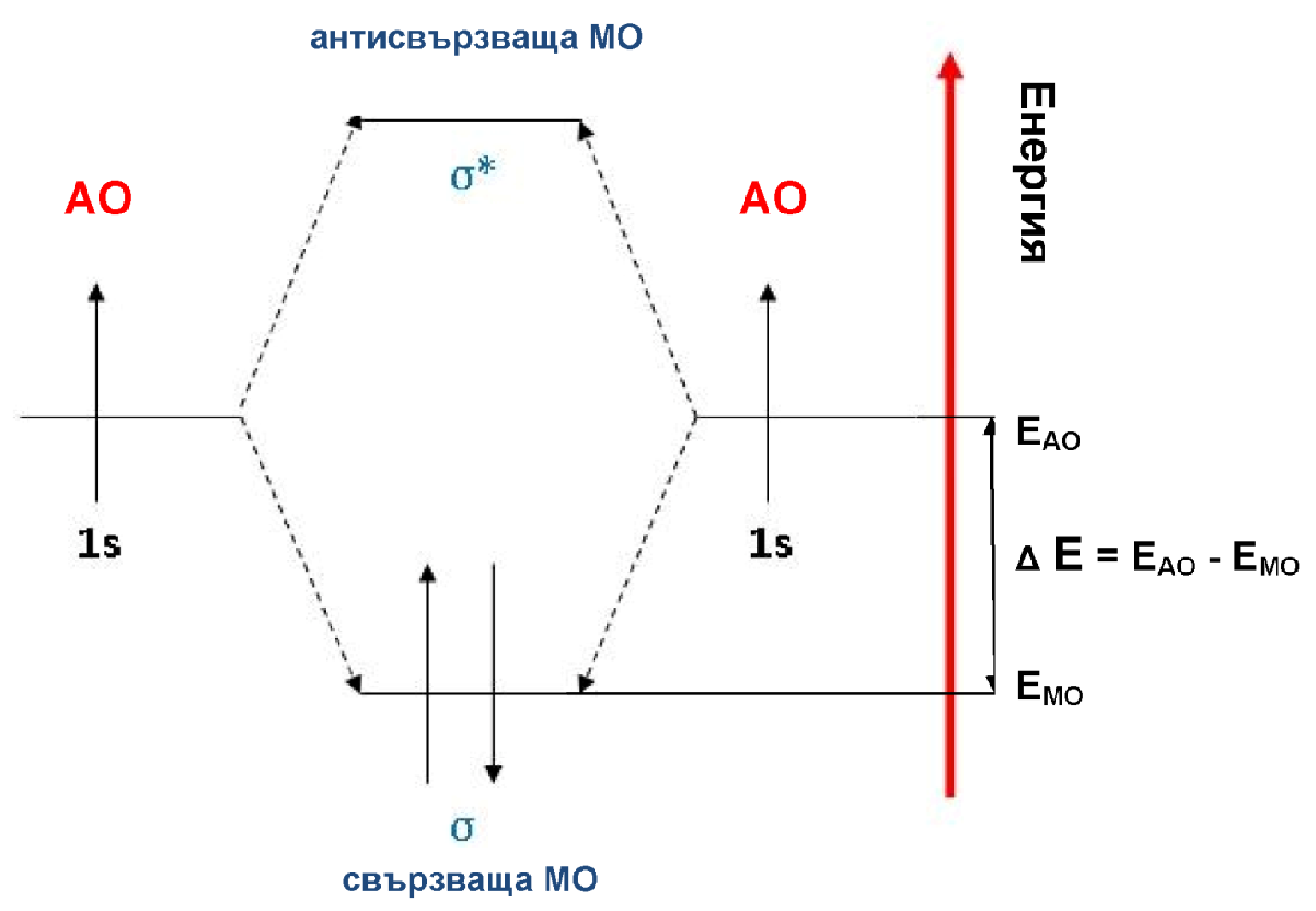
Фиг. 10. Енергетична диаграма на образуване на H2 молекула
От енергетичната диаграма на образуване на H2 молекула представена на фиг. 10 е видно, че за разкъсването на връзката Н−Н в молекулата на Н2 ще е необходимо да се изразходва енергия равна на 2 ΔЕ.
Влиянието на свързващите и антисвързващите електрони върху здравината на химичната връзка може да се изследва чрез въвеждането на величината порядък на химичната връзка, която характеризира електронната плътност на връзката.
Образуването на химична връзка при ММО може да бъде представено по следните начина:
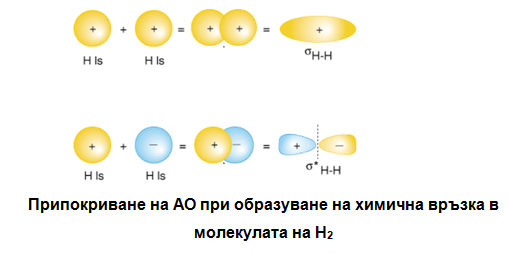
✓ чрез припокриващи се АО:
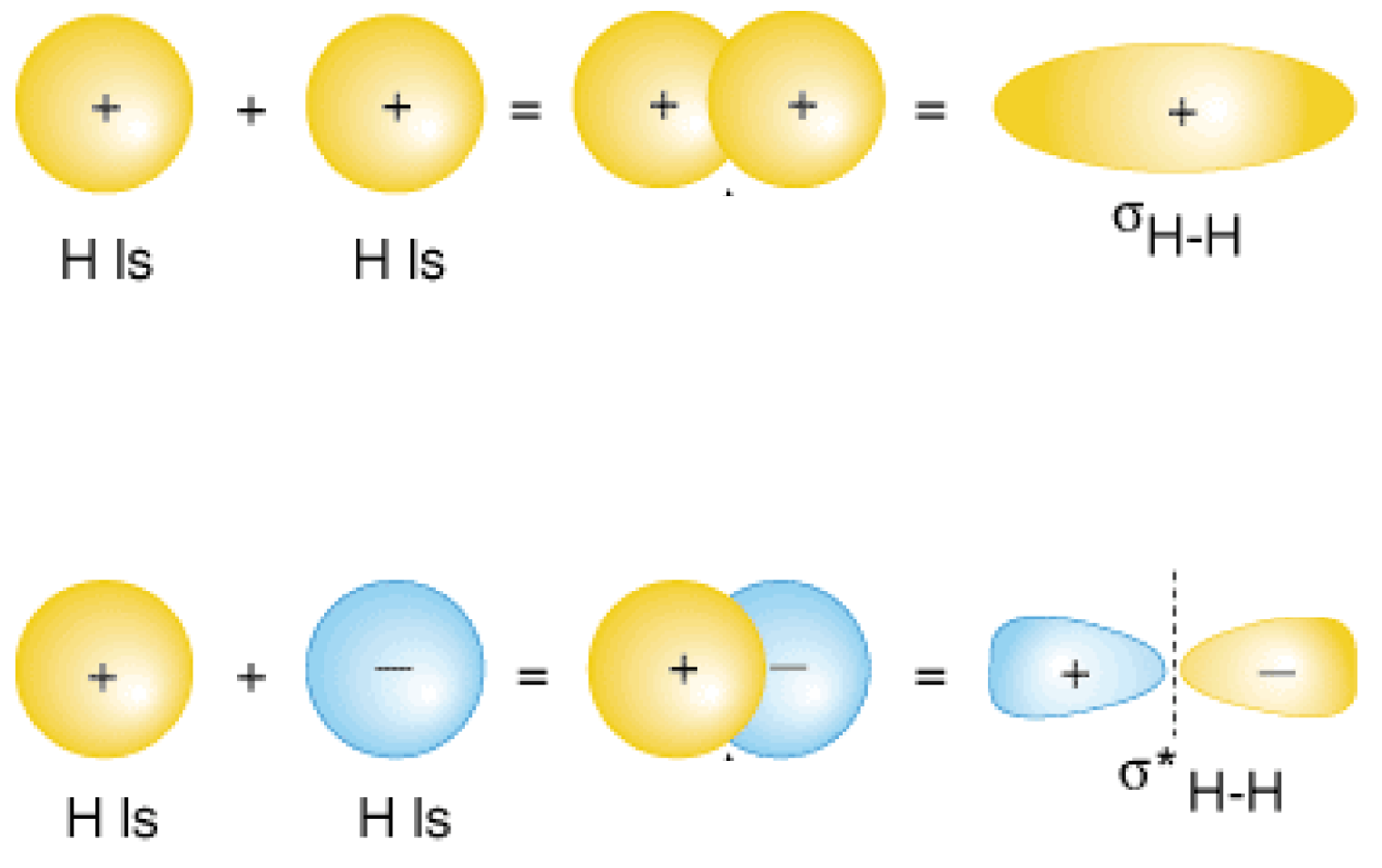
Фиг. 11. Припокриване на АО при образуване на химична връзка в молекулата на Н2
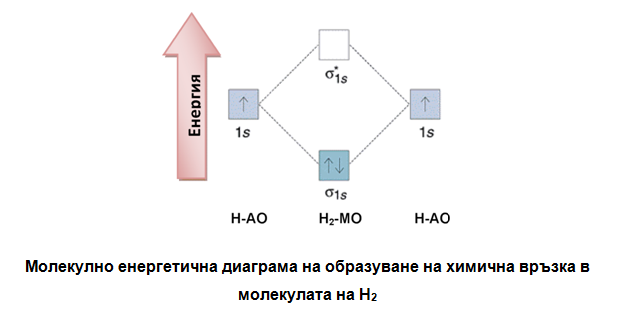
✓ чрез молекулно енергетични диаграми:
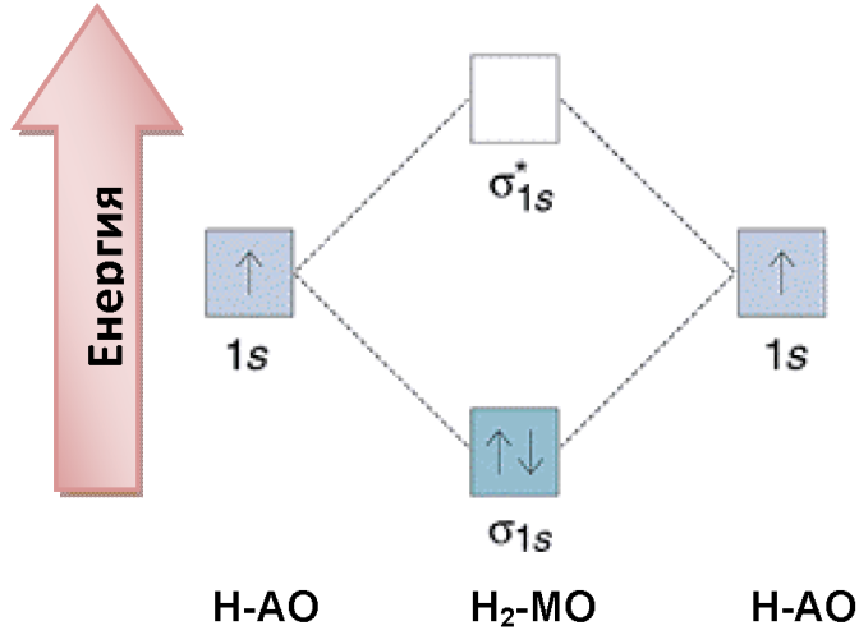
Фиг. 12. Молекулно енергетична диаграма на образуване на химична връзка в молекулата на Н2
✓ чрез квантови клетки - Изобразяване на образуването на химични връзки в молекулата на N2:
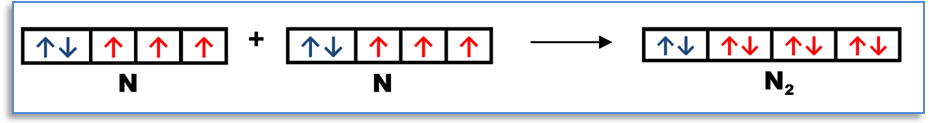
✓ чрез Люисови символи - изобразяване на образуването на химична връзки в молекулата на Cl2:

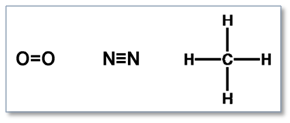
✓ чрез валентни черти - изобразяване на образуването на химични връзки в молекулите на О2, N2 и CH4:
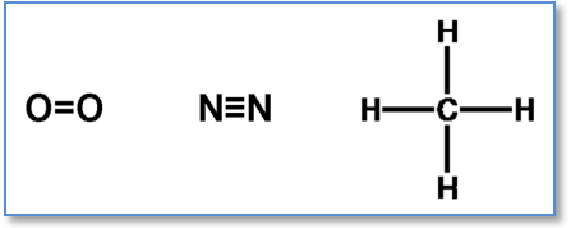
IV. Метод на граничните орбитали (MГО)

През 1952, Кеничи Фукуи публикува статия, озаглавена "Молекулна теория на реактивността в ароматни въглеводороди". Макар и широко критикувана по това време, той по-късно споделя Нобеловата награда за химия с Роалд Хофман за работата им върху реакционните механизми. Хофман публикува статия върху създаването на набор от четири перициклични реакции в органичната химия, базирани на орбиталната симетрия, в която той е съавтор с Робърт Бърнс Уудуърд, озаглавена "Опазване на орбиталната симетрия". Фукуи осъзнава, че може да се намери добро приближение за реактивност на граничните орбитали и методът на граничните орбитали да се превърне в мощен практически модел за описване на химическата реактивност.
Основни предпоставки на МГО при взаимодействие между две молекули:
· Заетите орбитали на двете молекули се отблъскват;
· Положителните заряди на едната молекула привличат отрицателните на другата;
· Заетите орбитали на едната молекула и незаетите на другата си взаимодействат чрез сили на привличане.
Най-важният аспект от теорията е фокусирането върху най-високите заети (HOMO) и най-ниските незаети (LUMO) молекулни орбитали:

Фиг. 13. Енергитична диаграма за НОМО и LUMO
Вместо да се разглежда общата електронна плътност в нуклеофилите, се отчита локализирането на HOMO, защото електроните от тази МО са най-свободни да участват в химични реакции. Фигурите показват разпределението на HOMO и LUMO в молекулите на водорода, нитробензена и етена.
Фиг. 14. Разпределение на HOMO и LUMO при молекулата на водорода
Методът на граничните орбитали предсказва, че мястото, където се локализира LUMO, е добър електрофилен център. Теорията първоначално е била използвана за обясняване на електрофилното заместване в молекулата на нафталина, но постепенно става ясно, че обхватът на тази теория е много по-широк. Например, концепцията за гранични орбитални симетрии била успешно използвана за рационализиране на резултатите от циклоприсъединителни и други перициклични реакции.
- Ограничения и недостатъци на МГО:
✓ прилагането на теорията изисква сложни изчисления за определяне на енергията на орбиталите и разположението им;
✓ при молекули с няколко функционални групи или делокализирана електронна плътност HOMO и LUMO не са строго локализирани и често обхващат голяма част от молекула, което затруднява тълкуването; тълкуването по-трудно;
✓ в много случаи реактивността не се контролира от граничните орбитали. Например, ако HOMO участва в ароматната система, е по-малко вероятно тя да реагират като нуклеофил или основа, защото това ще доведе до загуба на резонанса стабилизация. В други случаи, реактивността се определя от силни електростатични сили, а не от граничните орбитали.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
HOMO- highest occupied molecular orbital - най-високата заета молекулна орбитала
LUMO- lowest unoccupied molecular orbital - най-ниската незаета молекулна орбитала
вълнова функция- функция на пространството, описваща възможните състояния на системата чрез използване на комплексни числа
главно квантово число(n) - едно от четирите квантови числа (орбитално квантово число - l, магнитно квантово число - m и спин - s), обозначаващо енергийните нива на водород-подобни атоми.
МВВ- метод на валентните връзки
МГО - метод на граничните орбитали(Frontier molecular orbital theory, FMO)
ММО- метод на молекулните орбитали
МО- молекулна орбитала
спин- собственият момент на импулса на елементарни частици с квантова природа
уравнение на Шрьодингер- частно диференциално уравнение от втори ред за еволюцията на вълновата функция
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
1. Посочете начините по които може да бъде представено образуването на химична връзка при ММО.
Отговор
2. На какво се основава МГО в случай на взаимодействие между две молекули?
Отговор
3. Какви са възможните последствия, произтичащи от наличието на електрони върху антисвързваща σ*-МО?
Отговор
4. Какво се случва при приближаване на атоми на химични елементи, притежаващи валентни електрони:
- с антипаралелни спинове;
- с паралелни спинове
според МВВ?
Отговор
5. Какво характеризира величината порядък на химичната връзка?
Отговор
6. Дефинирайте и обяснете терминологичните съкращения LUMO и HOMO. Според коя от съвременните квантово-механични теории за химичната връзка са въведени те?
Отговор
7. Кои са основните ограничения на МГО?
Отговор
8. На коя от трите съвременни теории за строежа на химичната връзка (МВВ, ММО, МГО) съответства всяко едно от следните допускания:
А. Молекулата се разглежда като цялостна система, в която валентните електрони, образуващи химична връзка, се припокриват и формират молекулни орбитали.
B. При приближаване на атоми, притежаващи електрони с антипаралелен спин, на достатъчно близко разстояние, те се свързват помежду си чрез обща електронна двойка.
C. Заетите с електрони орбитали на една молекула и незаетите на друга молекула биха могли да си взаимодействат чрез сили на привличане.
D. Теорията се основава на вълновите характеристики на електроните при формирането на химичните връзки.
Отговор
9. Какво изобразява следната фигура:
Отговор
10. Попълнете липсващите думи/изрази:
Според ММО: „Молекулата се разглежда като ……………., в която валентните електрони, образуващи химична връзка, се ……………… и формират ………………………..”.
Отговор