НЕНАСИТЕНИ АЛИФАТНИ ВЪГЛЕВОДОРОДИ
АЛКЕНИ
I. ОПРЕДЕЛЕНИЕ, ХОМОЛОЖЕН РЕД, НАИМЕНОВАНИЯ

Алкените се наричат и олефини - наименованието е дадено им от холандския химик Гутри, а етенът е бил наречен маслороден газ (gaz olefiant на латински език).
Молекулите на алкените съдържат два водородни атома по-малко, спрямо алканите със същия брой въглеродни атоми.Първият член на хомоложния ред на алкените е етенът (С2Н4).
Наименованията на въглеводородните радикали получени при отнемане на един Н атом от молекулите на алкените, се образува като се прибави окончание „ил“ към наименованието на алкена. Използват се и тривиалните наименования за едновалентните алкенилови радикали, например винилов вместо етенил радикал, алил – вместо пропенил и т.н.
СН2=СН– етенил
СН2=СН–СН2– пропенил
:
:
CnH2n-1 алкенил радикалПри образуване на наименованието на алкени с по-сложен молекулен строеж е необходимо да се спазват следните правила:
- За главна се избира най – дългата верига, която съдържа двойната >С=С < връзка.
- Номерирането на главната верига започва от този край, до който е най – близо до двойната връзка.
- Положението на двойната връзка се означава, като пред основното наименование се прибави цифрата, с която е означен С атом, от който започва двойната връзка.
- Наименованията на заместителите към главната верига се поставят пред основното наименование по азбучен ред, заедно с цифрата, показваща мястото на заместителите в главната верига.
II. ИЗОМЕРИЯ

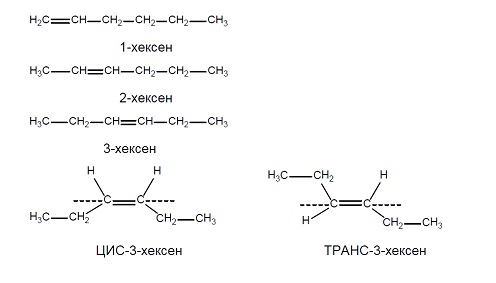
При алкените са възможни верижна, позиционна и геометрична изомерии. Верижна изомеря е възможна при алкени с права въглеродна верига, а позиционната изомерия - след третия член от хомоложния им ред. Позиционните изомери при алкените се различават по мястото на двойната връзка във въглеродната верига. Позиционни изомери са 1-бутен и 2- бутен, а 2-метилпропена е верижен изомер на 1-бутен.
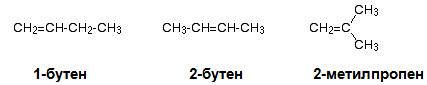
Бутена има два позиционни изомера:
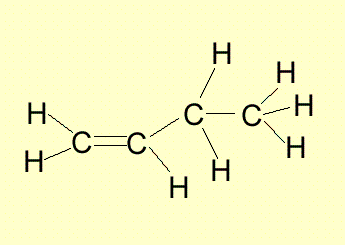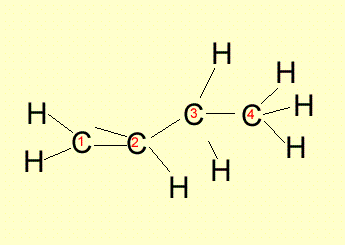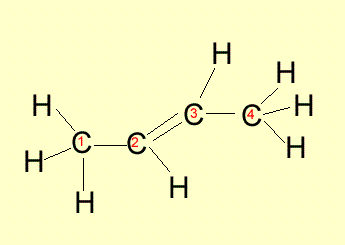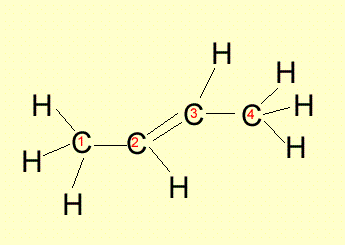
С увеличаване на броя на С атоми нараства броят на възможните изомери. При пентена позиционни изомери са:
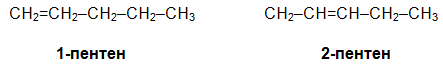
Верижни изомери на 1-пентен са 3-метил-1-бутен и 2-метил-1-бутен, а 2-метил-2-бутен е верижен изомер на 2-пентен и позиционен изомер на 2-метил-1-бутен
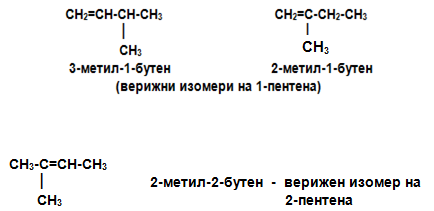
Според тетраедричния модел на С атом, пространственият модел на двойната С=С връзка може да се представи като два тетраедъра с общ ръб, поради което при алкените не е възможно въртене на С атоми при двойната връзка. Тази стабилност на пространствения строеж на двойната връзка обуславя вид пространствена изомерия - геометрична изомерия, наречена цис-транс изомерия. При цис изомерите заместителите са разположени от една и съща страна на равнината на двойната връзка, при транс - от двете страни. Геометрична изомерия има, когато двата заместителя при въглеродните атоми носещи двойната връзка са еднакви. Например при 2-бутен са възможни два пространствени геометрични изомера, в зависимост от разположението на метиловите (–СН3) радикали, спрямо равнината на π-връзката. Когато двата СН3-радикала се намират от едната страна на равнината на π-връзката изомерът се нарича цис, а когато те са от двете страни на тази равнина – транс изомер.
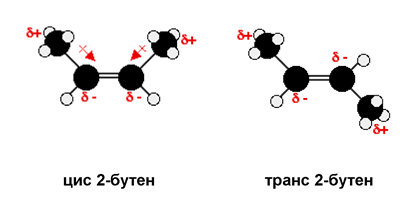
При 1,2-дихалогенопроизводните на алкените също е възможна геометрична изомерия т.н. при 1,2-дихлороетена геометричните изомери са цис-1,2-дихлороетен и транс-1,2-дихлороетен:
Геометричните изомери са оптично неактивни, тъй като през молекулата им може да се прекара равнина на симетрия.
III. МОЛЕКУЛЕН СТРОЕЖ НА АЛКЕНИ

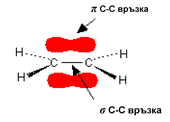
Въглеродните атоми в молекулите на алкените, които са свързани с двойната връзка са в sp2-хибридно състояние (Линк Тема 3: Видове химични връзки в неорганичните и органични съединения, т.VII.2. SP2 Хибридизация). Трите хибридните sp2-орбитали на С атом лежат в една равнина под ъгъл 120○. При всеки един sp2-хибридизиран С атом остава по една нехибридизирана рz-атомна орбитала.
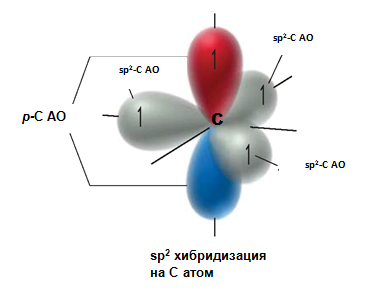
Фиг. 58. Образуване на σ- и π-връзки при алкени
Двойните С=С връзки в молекулите на алкените са изградени от една σ-връзкаС–С връзка (sp2–sp2) и една π-връзка (рz–рz), образувана при странично припокриване на две нехибридизирани 2рz-АО - по една при всеки от двата С-атома, носещи двойната връзка. Чрез припокриване на двете sp2-хибридните орбитали на С-атоми се реализира С–С σ-връзка на двойната връзка. При припокриване на sp2-хибридните орбитали на С със σ-орбиталите на Н-атоми, се образуват С–Н σ-връзки в молекулите на алкените (фиг. 58). Всички σ-връзки лежат в една равнина и образуват т.н. σ-скелет. Двете нехибридизирани 2рzАО при двата sp2 хибридизирани С-атома лежат в равнина перпендикулярна на равнината на σ-връзки и се припокриват странично под и над тази равнина. Те образуват π-връзката на двойната връзка между двата sp2 С-атомa (фиг. 58,59). При образуването на π-връзка в молекулата наетена са налице свързващата (с ниска Е) и антисвързващата (с висока Е) молекулни орбитали (фиг. 59, 60). ( Тема 3: Съвременно схващане за химична връзка, т.III. Метод на молекулните орбитали (ММО)
Фиг. 59. Образуване на π-връзка в молекулата на етен
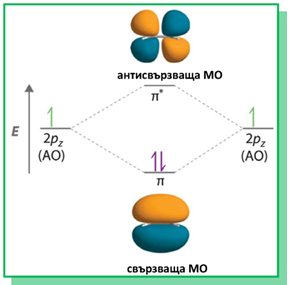
Фиг. 60. Енергетична молекулно -орбитална диаграма на образуване на π-връзка в молекулата на етен
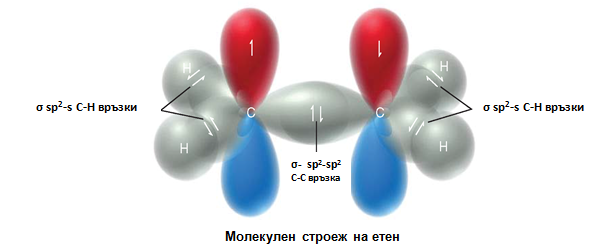
В молекулата на етена двойната връзка е неполярна, но поради подвижността на π-електроните под въздействие на полярни реагенти тя лесно се поляризира. При хомолозите на етена двойната връзка се поляризирана под действието на положителния индукционен ефект (+I) на алкиловите радикали.
IV. ФИЗИЧНИ СВОЙСТВА

Физичните свойства на алкените са близки до тези на съответните алкани със същия брой С атоми. Първите членове от хомоложния ред на алкените при обикновени условия са газове, средните (С5 - С18) са течности, а висшите - твърди вещества. Алкените не се разтварят във вода, но се разтварят в органични разтворители, като самите те са добри разтворители. Някои средни алкени и циклоалкени имат приятна миризма на етерични масла.
V. ХИМИЧНИ СВОЙСТВА

Химичните свойства на алкените се обуславят от молекулния им строеж - наличието на двойна връзка в молекулата им. Тъй като π-връзката е слаба и лесно се поляризира за алкенитe са характерни предимно присъединителни реакции.
V.1. ПРИСЪЕДИНИТЕЛНИ РЕАКЦИИ
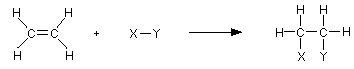
Присъединителните реакции протичат по механизъм на електрофилно присъединяване, наречено още и катионидно, тъй като пръв атакува катиона (E+).
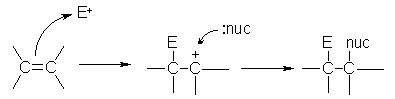
nuc: = нуклеофил
E+ = електрофил
Поради полярността на молекулата електрофилното присъединяване на полярен реактив към алкенипротича значително по-лесно от електрофилното присъединяване на неполярни.
Присъединителните реакции на алкените са свързани с промяна на хибридизацията на С-атоми при двойната връзка - от sp2 в sp3 .
V.1.1. Хидрогениране (хидриране) – присъединяване на водород (Н2)
Присъединяването на Н2 към химични съединения съдържащи сложна връзка се нарича хидрогениране (hydrogen - водород). При висока температура и налягане, в присъствие на катализатор Ni, водородът се присъединява към двойната връзка на алкените и се получават алкани т.н. при хидрогенирането на етен се получава етан.
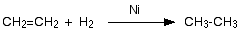
При хидрогенирането на алкени π връзката от двойната връзка се разкъсва и се образуват две нови С–Н σ-връзки, като σ-връзката между С атоми-носещи двойната връзка, остава непроменена. Тази реакция е израз на генетичната връзка между хомоложните редове на алкани и алкени.
V.1.2. Халогениране – електрофилно присъединяване на халоген (Х2)
Алкените не присъединяват флуор. Реакцията протича с взрив като се получава въглерод и флуороводород.

Ако се пропусне етен през бромна вода, той я обезцветява (разлика от алканите). Извършва се химична реакция, при която Br2 се присъединява към алкена и се образува само един реакционен продукт - 1,2-дибромоетан.
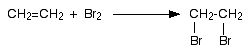
Обезцветяването на бромна вода е качествена реакция за доказване на сложна (в случая двойна) връзка, с която могат да се различат алкени от алкани и арени. По аналогичен начин алкените присъединяват и други халогенни елементи - хлор и йод. Поради това, че двойната връзка се атакува от катиона на халогена, това присъединяване се нарича електрофилно или катионоидно, а механизмът - механизъм на електрофилно присъединяване.
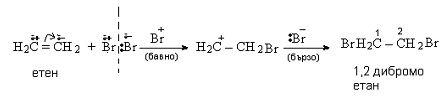
- Първи етап: Неполярната молекула на Br2 се поляризира под действието на π-връзката. В резултат единият от халогенните атоми получава частичен положителен заряд - Brδ+ (електрофил), реагира с π-връзката (електрофилна атака) и образува нестабилен π-комплекс;
- Втори етап: Нестабилният π-комплекс се разрушава и се образува σ-комплекс;
- Трети етап: Нехибридизираната рz-орбитала на sp2-хибридизирания С атом се припокрива с неподелената електронна двойка на Br-атом и образува цикличен бромониев катион
- Четвърти етап: Нуклеофилът Br– атакува бромониевия катион от противоположната страна на sp2-хибридизирания С атом, който е с частичен положителен заряд. В резултат на нуклеофилната атака се извършва транс-присъединяване на втория Br- и се получава крайният реакционен продукт 1,2-дибромоетан.
V.1.3. Електрофилно присъединяване на халогеноводород (НХ) към алкени
- Присъединяване на НХ към симетричен алкен
Присъединяване на халогеноводород към алкен протича по механизъм на електрофилно присъединяване, но значително по-лесно от електрофилното присъединяване халоген, поради полярността на молекулата на халогеноводорода.
Полярните молекули на халогеноводородите (хлороводород, бромоводород) се присъединяват към двойна връзка като се получават монохалогеноалкани. При електофилното присъединяване на хлороводород към етен се получава етилхлорид.

етилхлорид
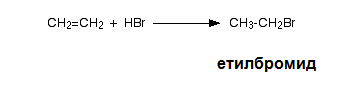
Присъединяване на бромоводород към етен също протича по механизъм на електрофилно присъединяване.
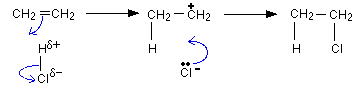
Първи етап: Електрофилна атака: полярната молекула на НBr атакува с положителната си част (Н-атом) π-систематаот двойната връзка и образува нестабилен π-комплекс.
Втори етап: π-комплексътсе разрушава и образува σ-комплекс, като Н-атом от HBr се свързва с единия sp2-хибридизиран С атом, а другият sp2 С-атом получава положителен заряд - карбокатион, който е много реактивоспособен. Образуването на карбокатиона, е най-бавен и следователно вторият етап е скоростно определящия етап на реакцията.
Трети етап: карбокатионът реагира с нуклеофил (Br-) до получаване на крайния реакционен продукт – етилбромид.
- Присъединяване на полярни молекули към несиметричен алкен
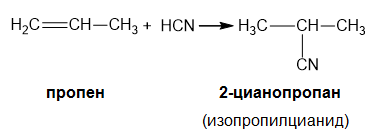
При присъединяването на НХ идруги полярни молекули към алкени с несиметрична молекула по отношение на двойната връзка - например пропен, 2-метилпропен, бутен-1 и др., се спазва правилото на Марковников.
Съвременната формулировка на правилото на Марковников гласи: Електрофилното присъединяване на полярни молекули към несиметрични алкени протича през междинно образуване на по-стабилния карбониев катийон.
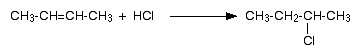
Механизъм:
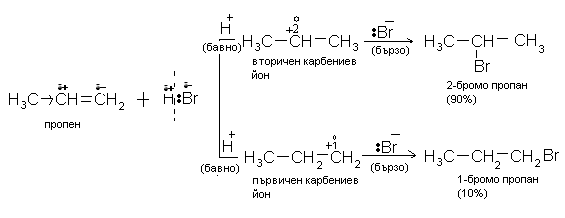
При присъединяване на бромоводород (HВr) към 2-метилпропен, като основен реакционен продукт се получава 2-бромо-2-метилпропан и страничен продукт - 1-бромо-2-метилпропан. Получаването на основния продукт на тази реакция спазва правилото на Марковников, което се обяснява с преразпределението на електронна плътност в молекулата на алкена. Под действие на положителния индукционен ефект на двата метилови радикала (+I, електронен донор) двойната връзка на несиметричния алкен се поляризира:
Крайната метиленова
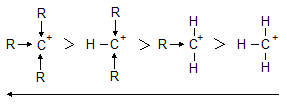
 група на 2-метилпропена получава частичен отрицателен заряд (d-), което улеснява електрофилната атака на Н-атом от молекулата на полярния реактив. Образува се стабилен вторичен карбокатион, който реагира с Br- до получаване на 2-бромо-2-метилпропан (основен реакционен продукт). Страничният продукт на реакцията (1-бромо-2-метилпропан) е в незначително количество, тъй като за неговото получаване е необходим първичен карбокатион, който е много по-нестабилен и следователно вероятността за неговото получаване е малка. Стабилността на еднин карбониев йон е толкова по-голяма, колкото положителния заряд при С атом е по-делокализира, а делокализацията е толкова по-голяма колкото повече са заместителите (алкилови радикали) с положителен индукционен ефект (+I) при положително натоварения С атом. Поради тази причина стабилността на третичните карбониеви катиони е по-голяма отколкото на вторичните, а те са по-стабилни от първичните. Метиловият катион е най-нестабилен.
група на 2-метилпропена получава частичен отрицателен заряд (d-), което улеснява електрофилната атака на Н-атом от молекулата на полярния реактив. Образува се стабилен вторичен карбокатион, който реагира с Br- до получаване на 2-бромо-2-метилпропан (основен реакционен продукт). Страничният продукт на реакцията (1-бромо-2-метилпропан) е в незначително количество, тъй като за неговото получаване е необходим първичен карбокатион, който е много по-нестабилен и следователно вероятността за неговото получаване е малка. Стабилността на еднин карбониев йон е толкова по-голяма, колкото положителния заряд при С атом е по-делокализира, а делокализацията е толкова по-голяма колкото повече са заместителите (алкилови радикали) с положителен индукционен ефект (+I) при положително натоварения С атом. Поради тази причина стабилността на третичните карбониеви катиони е по-голяма отколкото на вторичните, а те са по-стабилни от първичните. Метиловият катион е най-нестабилен.
V.1.4. Хидратация - присъединяване на вода
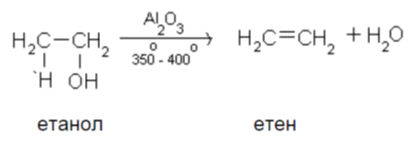
Водатае полярен реагент и се присъединява към двойната връзка на алкени по описания вече механизъм на електрофилно присъединяване. Присъединяването на вода към несиметрични алкени се спазва правилото Марковников. Хидратирането на етен при високо налягане, температура и катализатор Н2SO4 е промишлен метод получаване на етанол.
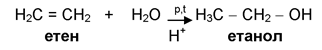
Хидратацията на алкени е реакция протичаща при висока температура и налягане, в присъствие на катализатор Н+ (H3PO4, H2SO4):
V.1.5. Присъединяване на циановодорд - НСN
При присъединване на НСN към алкени се получават съединения наречени нитрили (цианиди). Това метод за удължаване на С-верига (увеличава се броя на С-атоми).
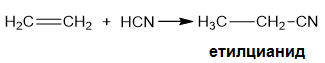
Ако реакцията се извършва с несиметричен алкен се спазва правилото на Марковников:
V.1.6. Присъединяване на минерални киселини
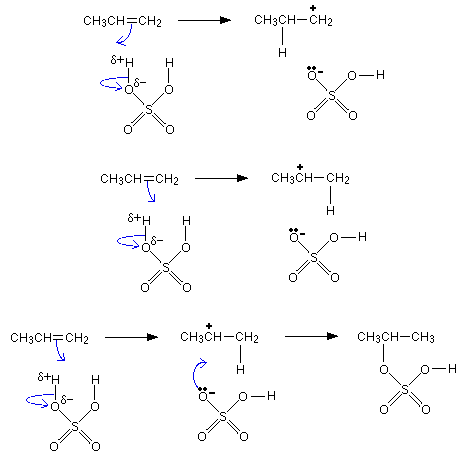
Към двойната връзка на алкените могат да се присъединяват силни минерални киселини. Например при присъединяване на сярна киселина към етен се получава етил сулфонова киселина. Реакцията има значение за промишлеността, тъй като след осапунване на реакционния продукт се получава етанол.
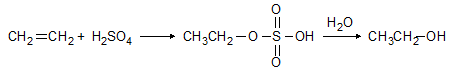
Механизмът е електрофилно присъединяване:
V.2. ОКСИДАЦИЯ (ОКИСЛЯВАНЕ)
-
Горене
В кислородна атмосфера алкените изгарят напълно до СО2 и Н2О. Реакцията на горене на алкени е екзотермичен окислително-редукционен процес.
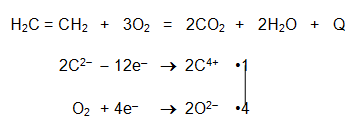
С кислорода от въздуха етенът образува взривоопасни смеси! - Умерена оксидация
При обикновена температура и силни оксиданти - разредени разтвори на KMnO4, Н2О2 и др., окисляват алкените, като получените съединения се наричат диоли. Реакцията се нарича оксидативно хидратиране.
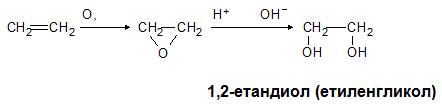
Обезцветяването на разреден разтвор на KMnO4 и както вече бе споменато на Br2-вода се използва за качествено доказване на двойна връзка.
- Енергична оксидация
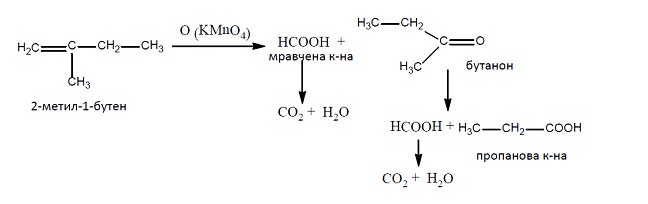
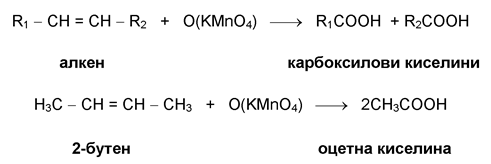
Концентриран разтвор на KMnO4, в сярнокисела среда при нагряване, разкъсва молекулите на алкена при двойната връзка, като се получава смес от карбоксилови киселини.
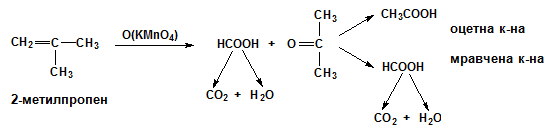
При енергична окисидация на алкен с двойната връзка в началото на въглеродната верига, една от получените киселини задължително е метанова (мравчена), която се окислява до въглеродна киселина Н2СО3 (СО2 и Н2О). Ако непосредствено до двойната връзка има третичен С атом, алкена се окислява първо до кетон. При окисидация на 2-метилпропен се получава ацетон, който по-нататък в хода на реакцията се окислява до смес от мравчена и оцетна киселини:
V.3. ПОЛИМЕРИЗАЦИЯ
При определени условия - температура, налягане и катализатори, голям брой нискомолекулни алкени се навързват помежду си и образуват макромолекули с голяма молекулна маса. Процесът се нарича полимеризация, а реакционният продуктът-полимер. При полимеризация на етен се получава полиетилен, а на пропен – полипропилен:

Полимеризацията на транс 2-бутен до полибутен протича по следния начин:
При полимеризация на винилхлорид (хлороетен) се получава поливинилхлорид (ПВЦ).
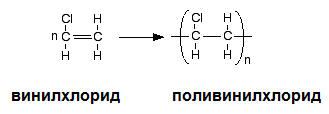
VI. ПОЛУЧАВАНЕ НА АЛКЕНИ

VI.1. КРЕКИНГ
Промишлен метод за получаване на алкени е преработката на нефта чрез крекинг процеси (линк Тема 6: Наситени алифатни въглеводороди - Aлкани (парафини), т.V.8. Каталитичен крекинг (пиролиза)).
VI.2. КАТАЛИТИЧНО ДЕХИДРОГЕНИРАНЕ НА АЛКАНИ
Каталитичното дехидрогениране на етан е промишлен метод за получава етен. (Тема 6: Наситени алифатни въглеводороди - Aлкани (парафини), т.V.5. Дехидрогениране на алкани)
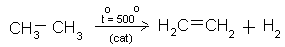
При дехидрогениране на бутан (700○С, Ni/Pd) се получават два реакционни продукта: 1-бутен и 2-бутен (фиг. 61), като основният продукт е 2-бутен, тъй като молекулата е с по-голяма симетрия и енергитично по-бедна.
Фиг 61. Каталитично дехидрогениране на бутан
VI.3. УМЕРЕНО ХИДРОГЕНИРАНЕ НА АЛКИНИ
Реакцията на умерено хидрогениране на алкини е възможна в присъствие на катализатори с понижена актовност напр. желязо, Pt или Pd частично „отровени” със серни съединения т.н. при умерено хидрогениране на етин се получава етен:
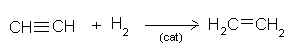
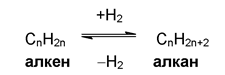
Двата метода - VI.2. и VI.3., за получаване на алкени, показват генетичната връзка между въглеводородите - алкани, алкени и алкини.
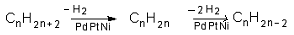
VI.4. ЛАБОРАТОРНИ МЕТОДИ ЗА ПОЛУЧАВАНЕ НА АЛКЕНИ
-
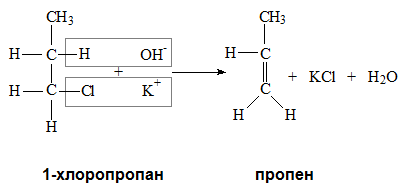
реакция на елиминиране елементитe на халогеноводород (HX)
От монохалогенопроизводни на алкани под действието на алкохолен разтвор на калиева основа (KOH) се получават алкени. Спазва се правилото, че протон (Н) се откъсва най-лесно от третичен, след това от вторичен и най-трудно от първичен С атом, съседен на С атом свързан с халогенния атом.
-
вътрешно молекулно обезводняване (дехидратация) на алкохоли
При нагряване на етанол в присъствие на водоотнемащи средства (H2SO4, Al2O3 и др.) се извършва вътрешно-молекулна дехидратация и се получава етен.
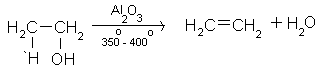
-
редукция на 1,2-дихалогеноалкани с Zn или Mg
При нагряване на 1,2-дихалогеноалкани в присъствие на катализатор Zn или Mg се получават алкени:

VII. ПРЕДСТАВИТЕЛИ

ЕТЕН
Етенът се използва като евтина суровина за промишлен органичен синтез на етанол, стирен, полимери, оцетна киселина, органични разтворители и др. В минимални количества етен се съдържа в растителните организми, като междинен продукт при обмяната на веществата. Етенът и ауксините (растителни хормони) са антагонисти и взаимно инхибират (потискат) биосинтеза и функционирането си. Ако в растителния организъм преобладава етена това ускорява растежа, съзряването и стареенето му и обратно - при преобладаването на ауксини. Свойството на етена да активира действието на някои ензими се използва за ускоряване зреенето на плодове и зеленчуци в складове и хранилища, като за цел е необходимо съдържание от 0,1 % до 0,2 % етен в тези помещения.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
π-комплекс - комплекс, съдържащ π-връзка
σ-комплекс - комплекс, съдържащ σ-връзка
геометрична изомерия - стереоизомерия, при която изомерите се различават по пространственото разположение на заместителите си
диоли - хидроксилни производни на въглеводородите, в чиито молекули два Н-атома са заместени с две ОН-групи
електрофил - реагент, който по време на участието си в химичните реакции привлича електронната двойка и се свързва с нуклеофила; наричат се също Люисови киселини.
електрофилно присъединяване - присъединителна реакция, характерна за съединения съдържащи сложна връзка, която се осъществява чрез разкъсване на π-връзката в молекулата на химичното съединение, в резултат на което се получават две σ-връзки.
индукционен ефект - допълнителна поляризация на химичните връзки, които се намират в близост до дадена силно полярна връзка
крекинг - процес, при който от висшите алкани при нагряване (450-650оС) в присъствие на катализатори (природни алумосиликати, Al2O3, AlCl3, SiO2) чрез разкъсване на въглеродната верига се получава смес от по-нисши въглеводороди - алкани, които частично се дехидрогенират до алкени и алкини.
нитрил - органични съединения с обща формула R-C≡N, които могат да се разгледат като производни на циановодородната киселина HC≡N
нуклеофил - химически реагент, които предоставя свободна електронна двойка на електрофил, за да се образува химическа връзка или който притежава поне една π-връзка
окисидация - окисление
оксидант - окислител
олефини - алкени: ненаситени въглеводороди, които съдържат в молекулата си поне една -С=С-връзка
полимер - високомолекулно съединение, молекулата на което се състои от голям брой повтарящи се атомни групи, свързани помежду си с ковалентни химични връзки
полимеризация - процес, при който полимерната верига се образува чрез последователно присъединяване на молекулите на един или няколко мономера към нарастващ активен център
правило на Марковников - при присъединяване на полярен реактив към несиметричен алкен отрицателната част на полярната молекула преимуществено се присъединява към най-малко хидрирания (най-бедния на Н) sp2-хибридизиран С атом (носещ двойната връзка).
присъединителни реакции - химични реакции, характерни за съединения със сложна връзка, при които в резултат на химичното взаимодействие се получава един единствен продукт
хидрогениране - процес на присъединяване на Н2 към химични съединения, съдържащи сложна връзка
цис-транс - геометрична изомерия, при която ако заместителите са разположени от една и съща страна на равнината на двойната връзка изомерите се наричат ЦИС, а ако са от двете страни на равнината - транс.
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
- При нормални условия бромната вода се обезцветява от:
А. бензен
B. хексан
C. циклохексен
D. етан.
Отговор
- Според правилото на Марковников водородният атом се присъединява към:
A. четвъртичен въглероден атом
B. най-богатия на водород въглероден атом
C. нехибридизиран въглероден атом
D. най-бедния на водород въглероден атом
Отговор
- Въглеродни атоми в sp3 и sp2 хибридизация има в молекулите на:
A. C3H4
B. C3H6
C. C6H6
D. C6H14
Отговор
- При окисление на пропен с H2O2 се получава:
A. 2-пропанол
B. 1,3-пропандиол
C. 1,2-пропандиол
D. CO2 и H2O
E. 1-пропанол.
Отговор
- При присъединяване на вода към 1-бутен се получава:
A. 1-бутанол
B. 1,2-бутандиол
C. 2-бутанол
D. 2-бутенол.
Отговор
- Напишете структурните формули и наименования на всички възможни позиционни изомери на хексена. При кой от изомерите му е възможна геометрична изомерия?
- Кой от посочените полимери се получава при полимеризация на винилхлорид:
Отговор
А. (-СН2-СН2-)n
B. (-СНCl-СНCl-)n
C. (-СН2-СНCl-)n
D. (-СН=СН-)n
Отговор
Напишете наименованието му.
- При взаимодействие на 2-метил-1-бутен с HBr се получава:
A. 1-бромо-2-метилпропан
B. 2-бромо-2.метилпропан
C. 2-бромо-1-метилпропан
D. 1-бромо-2-метилпропен.
Отговор
- Довършете следната химична реакция и напишете наименованията на всички междинни и крайни продукти:
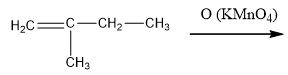
Отговор
- Напишете крайните продукти на тази химична реакция. Как се нарича процесът?
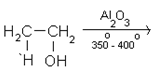
Отговор