ВИДОВЕ ХИМИЧНИ ВРЪЗКИ В НЕОРГАНИЧНИТЕ И
ОРГАНИЧНИТЕ СЪЕДИНЕНИЯ
Акцентира се върху същността на основните видове химични връзки в неорганичните и органични съединения: неполярна и полярна ковалентна връзка, йонна връзка, донорно-акцепторна връзка, метална и семиполярна връзки. Особено внимание се отделя на начините на образуване на σ- и π-връзките и пространствената геометрия на молекулите. Систематично са разгледани основните видове хибридизация (sp3, sp2, sp) в молекулите на неорганичните и органични съединения.
Студентите се запознават и с основните качествени и количествени характеристики на химичната връзка: дължина, енергия, кратност и полярност. Акцентира се върху пространствената насоченост на химичните връзките от гледна точка на пространствените особености при припокриването на атомните орбитали на валентните електрони.
С цел по-доброто възприемане и усвояване на представения теоретичен материал, темата е онагледена с конкретни примери и флаш модули.
I. Ковалентна връзка

Съгласно теориите на Косел (1916) и Люис (1923) причината за свързаването на атомите в молекули е техният стремеж към образуване на стабилна конфигурация, т.е. запълнен външен електронен слой, аналогично на благородните газове.
Ковалентната връзка е химична връзка, която се осъществява чрез общи електронни двойки, принадлежащи и на двата атома.
Тя се образува като всеки от участващите атоми предоставя по един (при проста връзка) или повече от един (при сложни, кратни връзки) свободни (валентни) електрони. Тя възниква, както между еднакви атоми, например в молекулите на Cl2, O2, H2, диаманта и др., така и между различни атоми - в молекулите на H2O, NH3, HX, в кристалите на карборунда SiC. Във всички органични съединения (ниско и високомолекулни) връзката е също ковалентна.
Здравината на ковалентните химични връзки се определя от енергията, която се отделя при образуването им. Връзката е по-здрава и по-трудно се разкъсва, ако при образуването и се отделя по-голямо количество енергия. Има прости и сложни ковалентни връзки. Прости, ако между двата атома е образувана само една обща електронна двойка. Сложна е, когато имаме две или повече общи електронни двойки.
Особености на тази връзка са нейната насоченост в пространството и наситеният й характер.
l.1. Ковалентна неполярна връзка
Когато двата атома, свързани с обща/и електронна/и двойка/и са с еднаква или близка по стойност електроотрицателност ( χ), ковалентната връзка е неполярна. Следователно, при хомоядрените и при някои хетероядрени молекули като: H2, N2, Cl2, O2, CH4, повишената електронна плътност е разположена симетрично спрямо ядрата на атомите и се привлича в еднаква степен от тях. Центровете на положителните и отрицателните заряди съвпадат, т.е. тази връзка има диполен момент: μ= 0.
При образуването на H2 молекула, двата Н-атома участват в образуването на общата електронна двойка с по един е-. Целта е да постигнат електронната конфигурация на He, който има два електрона в най-външния си електронен слой:
Фиг. 15. Ковалентна неполярна връзка в молекулата на Н2
Кислородните атоми в молекулата на О2 образуват две общи електронни двойки, т.е. връзката между тях е двойна неполярна. Стремежът им е да постигнат стабилната електронна конфигурация на Ne.
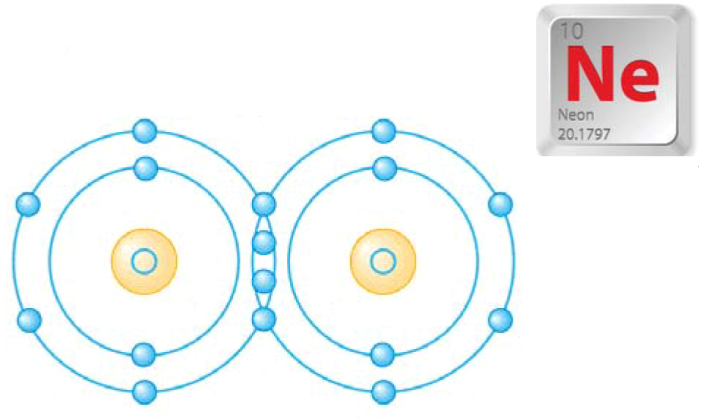
Фиг. 16. Ковалентна неполярна връзка в молекулата на О2
В молекулата на CH4, C-атом образува 4 неполярни връзки с четирите Н-атома, в които той участва с четирите си валентни електрона. Следователно Н-атоми се стремят да да постигнат електронната конфигурация на He, а С-атом - тази на Ne:

Фиг. 17. Образуване на неполярни С−Н връзки в молекулата на метана
Неполярните молекули се изобразяват най-често във вид на елипса: 
Те не създават около себе си изразено електрическо поле.
Веществата, изградени от молекули с неполярна ковалентна връзка са най-често газови системи.
I.2. Ковалентна полярна връзка
Когато свързващите се атоми са разнотипни, т.е. с различна електроотрицателност, електронната плътност е асиметрично разпределена и общата електронна двойка е изтеглена към ядрото на по-електроотрицателния атом. Наблюдава се появата на частични електрични заряди в молекулата, които са по-малки от йонните, приети за 1. Връзката се нарича ковалентна полярна. Тя е присъща за полярните молекули - диполи, които се изобразяват във вид на елипса, в двата полюса, на която са обозначени противоположните заряди. Полярните молекули се характеризират с диполен момент μ≠ 0. Такива са, например HCl, HF, H2O, CO, NO и др.
✓ полярна ковалентна връзка в молекулата на HCl: χH < χCl
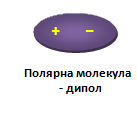
Полярна ковалентна връзка в молекулата на HCl
✓ полярна ковалентна връзка в молекулата на HF: χH < χF
Полярна ковалентна връзка в молекулата на HF
✓ полярни ковалентни връзки Н−О в молекулата на H2O: χH < χO
Полярни ковалентни връзки в молекулата на H2O
По-голяма част от съединенията с неполярна ковалнетна връзка се характеризират с ниски температури на стапяне и кипене, което се дължи на слабите междумолекулни сили. Понякога неполярната връзка може да се разпространява в трите посоки на пространството. Това е причина за образуване на т. нар. „атомни кристални решетки”, например при диаманта. Тези вещества се характеризират с много голяма твърдост и високи температури на топене

Възможни са и два гранични случая на ковалентна химична връзка: σ-връзки и π-връзки.

|
σ-Връзката се образува, когато взаимното припокриване на АО се осъществява по оста, свързваща атомните ядра (X). |
σ-Връзката най-ясно се дефинирана при образуването на двуатомни молекули в резултат на припокриване на s-s, s-px или px-px атомни орбитали (AO). Тя е симетрична по отношение на въртенето си около оста на атомните ядра и се характеризира с най-висока енергия
Фиг. 18. Образуване на σ-връзки
- σs-s-връзкa
Ковалентната неполярна σs-s-връзкa в молекулата на H2 се образува при препокриване на две 1s електронни атомни орбитали, както е показано на фиг. 19.
Фиг. 19. Образуване на σs-s-връзкa в молекулата на H2
-
σs-p-връзкa
Ковалентнтната полярна σs-p връзка в молекулата на HF се образува при препокриване на 1s атомна орбитала на водорода (Z 1) (1. Периодична система) и една 2р атомна орбитала на флуора (Z 7) (1. Периодична система), както е показано на фиг. 20
Фиг. 20. Образуване на σs-p-връзка в молекулата на HF
-
σp-p-връзка:
Ковалентните неполярни σp-p-връзки в молекулите на F2, Br2, I2, Cl2 ( Периодична система) се образуват при препокриване на 2р атомни орбитали на съответния халогенен елемент, както е показано на фиг. 21
Фиг. 21. Образуване на σp-p-връзки в молекулите на F2, Br2, I2, Cl2
π-ВРЪЗКА

|
π-Връзка се получава при странично припокриване на две р-АО, т.е. тя лежи в равнина перпендикулярна на равнината на σ-връзката. |
При това странично припокриване на р-АО се получават два сектора на припокриване - под и над равнината на σ-връзката (Ненаситени алифатни въглеводороди - Алкени, т.III. Молекулен строеж на алкени) Тъй като степента на това припокриване е по-малка, π-връзките са по-слаби от σ-връзките, което обяснява по-лесното им разкъсване при химичните реакции. Освен това молекулните фрагменти, свързани с π-връзка не могат да се въртят около оста на връзката, тъй като това въртене е свързано с разрушаване на паралелната ориентация на съставните p-AO (py-py; pz-pz). При образуването на π-връзките са налице свързващи и антисвързващи МО, като е показано на фиг. 22. (Съвременно схващане за химична връзка, т.III. Метод на молекулните орбитали (ММО))при образуване на π-връзки
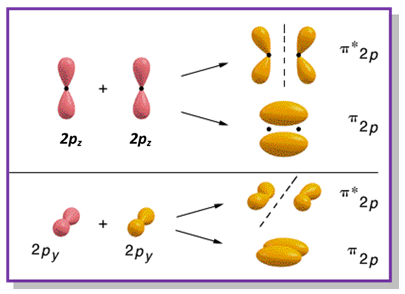
Фиг. 22. Свързващи и антисвързващи МО ( Тема 2: Съвременно схващане за химична връзка, т. III. Метод на молекулните орбитали (ММО)) при образуване на π-връзки
II. ЙОННА ВРЪЗКА

Йонната (електровалентна, хетерополярна) връзка е резултат от електростатично привличане между противоположно заредени йони, получени от атоми с ниска йонизационна енергия и високо електронно сродство.
Превръщането на електронеутралните атоми в йони се дължи на стремежа им да постигнат стабилна електронна конфигурация на външния си електронен слой. Това превръщане е съпроводено с промяна на радиуса на атомите:
− атомът електонодонор (А) (който отдава електрони) се превръща в
катион (А+) с по-малък радиус:

− атомът електроноакцептор (В) (който приема електрони) се превръща в анион (В−) с по-голям радиус:
Например в молекулата на NaCl образуването на йонната химична връзка става по следния механизъм:

Фиг. 23. Образуване на йонна връзка и йонна кристална решетка при NaCl
Според квантово-механичните теории йонната връзка може да се разгледа като гранично състояние на ковалентната връзка, при което електронната плътност е изтеглена изцяло към по-електроотрицателния атом.
- Характеристики на съединенията с йонна връзка
✓ йонната връзка не е насочена в пространството, тъй като всеки йон може да привлича противойони в произволно избрана посока на пространството;
✓ съединенията с йонна връзка не образуват единна молекулна структура, а представляват твърди вещества с йонна кристална решетка. В структурата на твърдия NaCl всеки Na+ взаимодейства с 6 Cl−, oт своя страна всеки Cl− е заобиколен от 6 Na+. Тази структура се повтаря многократно, формирайки йонна кристална решетка.
✓ йонната връзка е ненаситена;
✓ веществата с йонна кристална решетка се характеризират с високи температури на стапяне, в стопилка са електропроводими; добре разтворими са в полярни разтворители; разтворите им имат висока електропроводимост.
III. ДОНОРНО-АКЦЕПТОРНА ВРЪЗКА

Донорно-акцепторна (координативна) е ковалентна химична връзка, която се образува между атом, който предоставя неподелена електронна двойка (донор) и атом/йон, който предоставя свободна АО (акцептор).
Механизмът на образуване на на донорно-акцепторна връзка в NH4+ е следния: азотът (донор) от амонячната молекула предоставя неподелената си електронна двойка на водородния катион (акцептор), който има свободна атомна орбитала.
Механизмът на oбразуване на донорно-акцепторна връзка в H3O+ е следния: кислородът (донор) от молекулата на водата предоставя неподелената си електронна двойка на водородния катион (акцептор), който има свободна атомна орбитала.
Донорно-акцепторните връзки в двата катиона са равностойни по енергия, кратност и полярност с останалите ковалентни връзки в структурата на амониевия и хидроксониевия катион. Координативни връзки са характерни и за комплексните съединения. При тях лигандите, притежаващи неподелени електронни двойки са донори, а йоните-комплексообразуватели - акцептори. Например в [Cu(NH3)4]2+ (тетрааминомеден катион):
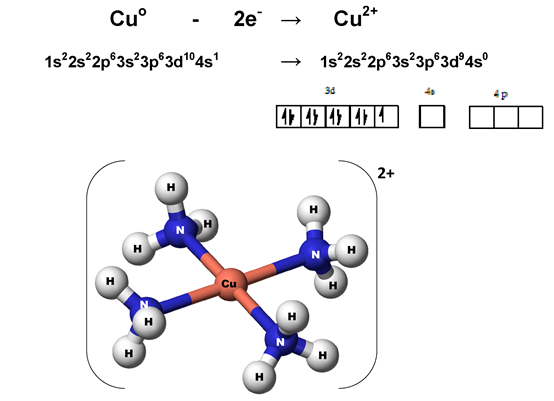 Образуване на донорно-акцепторна връзка в тетрааминомедния катион [Cu(NH3)4]2+
Образуване на донорно-акцепторна връзка в тетрааминомедния катион [Cu(NH3)4]2+
В този случай свободната електронна двойка на NH3 участва в образуването на донорно-акцепторна връзка с комплексообразувателя Cu2+, който предоставя свободна АО. Колкото е по-голяма степента на припокриване на орбиталите на комплексообразувателя и лигандите, толкова връзката между тях е по-здрава. В органичните комплексни съединения, известни като ониеви съединения, ролята на донори изпълняват обикновено: N, S, P, Cl, O атоми:
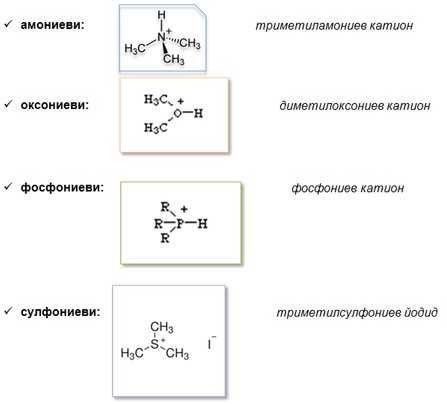
IV. МЕТАЛНА ВРЪЗКА

Металната връзка е особен вид връзка в металните кристали, която се характеризира с пълна делокализация и ненасоченост.
Химичните елементи с метални свойства съществуват при обикновени условия като метални кристали. Те се характеризират със специфични свойства, които ги отличават от останалите твърди вещества:
> оптични: висока отражателна способност, на която се дължи металния им блясък;
> електрични: висока електропроводимост;
> топлинни: висока топлопроводимост и голям специфичен топлинен капацитет;
> механични: ковкост, пластичност, твърдост;
> магнитни свойства.
Класическата теория за електронния газ, обаче, не дава задоволително обяснение на някои от тези свойства: специфичен топлинен капацитет, полупроводникови свойства и т.н. Това води до създаването на т. нар. зонна теория (Ферми, Дирак, 1926 г.), според която взаимодействащите си частици в металната кристална решетка са загубили напълно своята индивидуалност.
Според зонната теория, в резултат на взаимодействието на N на брой еднакви атоми се образуват N на брой МО, на които съответстват N на брой енергетични нива. Разликата в техните енергии е толкова по-малка, колкото броят им е по-голям. N-енергетичните нива образуват една енергетична зона. В металните кристални решетка могат да се образуват една или повече енергетични зони, които изпълват обема й. В зависимост от вида на изходните АО, образуваните енергетични зони биват s, p, d, f. Валентните електрони се разпределят по техните нива в посока на повишаване на енергията им.
Енергетичната зона или определена част от нея, която съдържа валентни електрони, участващи в образуването на химичната връзка се нарича
валентна зона. Останалата част от нея или друга енергетично по-богата и празна зона се нарича
проводима зона. В резултат на прилагането на външно електрично поле електроните се движат от валентната към проводимата зона.
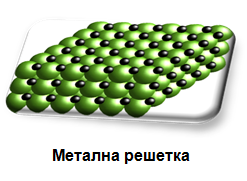
Фиг. 24. Разположение на металните катиони и валентните електрони в металната кристална решетка
Възможно е припокриване на валентната и проводимата зона в зависимост от структурата на атомите и симетрията на кристалната решетка. Когато зоните не се припокриват, областта между тях се нарича забранена зона, която според квантовата механика не може да бъде заета. По широчината на тази зона се съди за степента на електропроводимост на различни вещества и те се класифицират като метали, полупроводници и изолатори (диелектрици). При металите валентната и проводимата зони се припокриват:
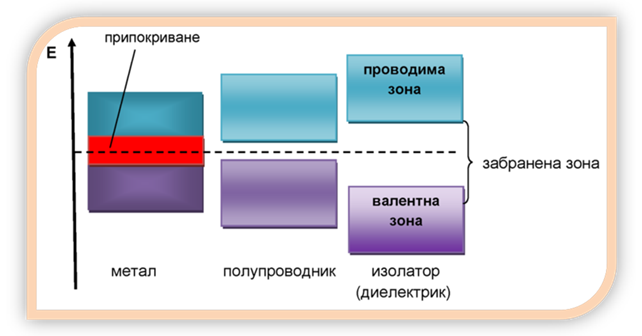
Фиг. 25. Енергетична диаграма на разпределение на проводимата и валентна зони при метали, полупроводници и изолатори
V. СЕМИПОЛЯРНА ВРЪЗКА

Семиполярната връзка може да се разгледа като комбинация между донорно-акцепторна ковалентна връзка и йонна връзка.
Тя е характерна за някои неорганични (HNO3:) и органични съединения (триметиламинооксид):
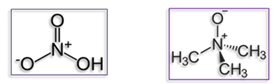
Кислородният атом е електронеутрален, с незапълнен октет на електони в най-външния електронен слой. Азотният атом, който също е електронеутрален има неподелена електронна двойка. Кислородният атом приема неподелената електронна двойка, стабилизира се и получава отрицателен заряд, а N-атом - отдава електронната двойката и получава положителен заряд.
Получената химична връзка се осъществява чрез обща електронна двойка, следователно е ковалентна, но поради електростатично привличане между противоположните заряди може да се рагледа и като йонна.
VI. ОСНОВНИ ХАРАКТЕРИСТИКИ НА ХИМИЧНАТА ВРЪЗКА

VI.1. ДЪЛЖИНА НА ХИМИЧНАТА ВРЪЗКА
Дължината на химичната връзка в молекулите се измерва с разстоянието между центровете на ядрата на ковалентно свързаните атоми в равновесно състояние, т.е. при равна големина на силите на привличане и отблъскване и минимална потенциална енергия на молекулата.
Експериментално тя се определя чрез дифракционни (рентгеноструктурни, електронографски) методи или по данните от молекулните спектрални характеристики. Измерва се в nm. Дължината на връзката зависи от вида на АО (s, p) и хибридизацията им, oт вида на връзката (σ, π), електроотрицателността на атомите, кратността на връзката

|
Дължината на химичната връзка зависи обратно-пропорционално от енергията й. |
Фиг. 26. Зависимост на дължината на C-C връзката от кратността й
VI.2. ЕНЕРГИЯ НА ХИМИЧНАТА ВРЪЗКА
Енергия на химичната връзка е енергията, необходима за хомолитичното й разкъсване.
Нарича се още енергия на дисоциация (ЕD). Тя е количествена мярка за здравината на връзката и се измерва в J/mol или kJ/mol. При двуатомните молекули енергията на дисоциация е равна по абсолютна стойност и обратна по знак на енергията на образуване на химичната връзка. При многоатомните молекули с еднотипни химични връзки средната енергия на връзката за 1 mol вещество е равна на енергията на образуване на веществото (сума от енергиите на образуване на отделните връзки), разделена на броя на връзките. Например при метана CH4 средната дължина на C−H връзката се изчислява по следния начин:
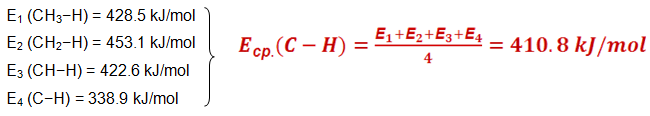

|
Енергията на химичната връзка нараства с увеличаване на кратността й. |
VI.3. КРАТНОСТ НА ХИМИЧНАТА ВРЪЗКА
Кратността на химичната връзка се определя от броя на електронните двойки, чрез които двата атома се свързват:
>еднократна връзка- образувана от една електронна двойка:
>двукратна връзка- образувана от две електронна двойка:
>трикратна връзка- образувана от три електронна двойка:
Кратността на химичната връзка е правопропорционална на енергията и обратнопропорционална на дължината й.
VI.4. ПОЛЯРНОСТ НА ХИМИЧНАТА ВРЪЗКА
Полярността на химичната връзка се определя от електроотрицателността (χ) на свързаните атоми.
Според Полинг електроотрицателността се определя като способност на атомите в молекулата да привличат електроните от химичната връзка към себе си. Според Миликен - тя се дефинира като средноаритметичната стойност от йонизационната енергия (I) и електронното сродство (А), т.е. зависи от склонността на атома да задържа своите електрони и да привлича чужди електрони. Атомът на азота в молекулата на амоняка е с по-голяма електроотрицателност от вдорода и привлича в по-голяма степен общата електронна двойка, в резултат на което неутралната молекула се превръща в полярна –дипол. В молекулата на водата кислородът е с по-голяма електроотрицателност от вдорода и привлича в по-голяма степен общата електронна двойка, в резултат на което водната молекула се превръща в дипол.
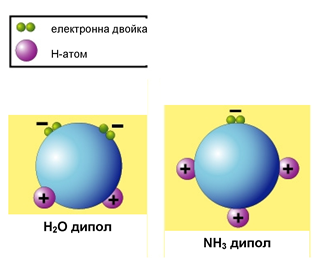
Диполът се характеризира с диполен момент μ ≠ 0, който се изчислява като произведение от абсолютната стойност на заряда (е) и разстоянието между центровете на зарядите в дипола (l):
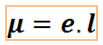
Диполният момент се измерва в D (дебаи), като 1D = 3,33.10-30 C.m(кулон x метър). Диполният момент е вектор, насочен от по-електроотрицателния към по-малко електроотрицателния атом. При неполярните молекули μ = 0, тъй като при тях l = 0.
VI.5. ПРОСТРАНСТВЕНА НАСОЧЕНОСТ НА ХИМИЧНАТА ВРЪЗКА
Пространствената насоченост на химичните връзките се определя от пространствените особености на АО на валентните електрони, които се припокриват при образуването на ковалентната връзка.
Пространствената насоченост на химичните връзките се определя от пространствените особености на АО на валентните електрони, които се припокриват при образуването на ковалентната връзка. Тъй като АО на валентните електрони могат да бъдат s, p, d и f със съответната форма и пространствена насоченост, тяхното припокриване може да се осъществи по различен начин (фиг. 28) .
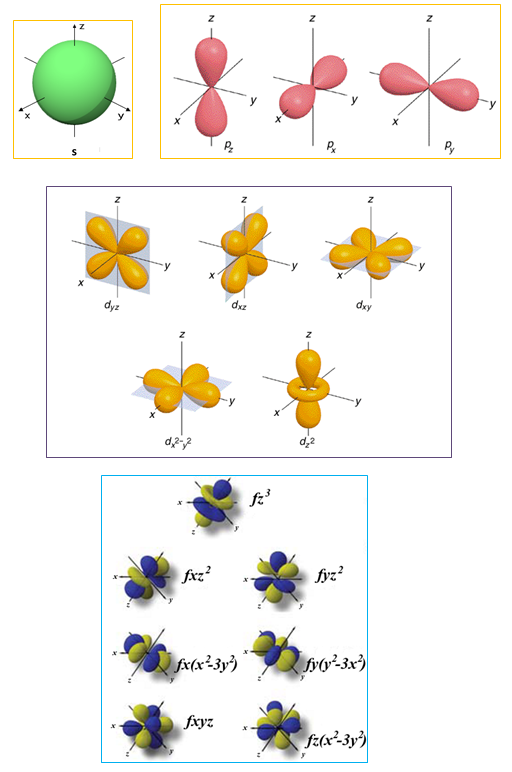
Фиг. 28. Пространствена насоченост на АО
VII. ХИБРИДИЗАЦИЯ

Хибридизацията на АО е моделно взаимодействие между орбиталите на валентните електрони в един и същ атом, което води до получаване на нови хибридни орбитали ХО - еднакви по енергия, равномерно насочени в пространството и равностойни за участие в химична връзка. Необходимо условие за хибридизацията е съответните орбитали да бъдат близки по енергия. Следователно това са орбитали от един и същи електронен слой или такива, при които сумата от главното (n) и орбиталното квантово число (l) е близка. В хибридизацията могат да участват s, p и d-орбитали. Припокриването между хибридни орбитали, както между хибридни и нехибридни атомни орбитали води до образуване на σ-връзки. Нехибридните р-АО, останали след sp и sp2-хибридизации, участват в образуването на π-връзки. Различават се три вида хибридизация на валентните електрони: sp3, sp2 и sp.
VII.1. SP3 ХИБРИДИЗАЦИЯ
В периодичната система химичният елемент С има пореден номер Z= 6. (линк Приложение 1. Периодична система). Следователно електронната обвивка на С-атом се състои от 6 е- (1s2 2s2 2p2). В основно състояние C-атом има във външния си електронен слой 2 сдвоени електрона на 2s нивото и 2 валентни електрона на 2p нивото. При преминаване във възбудено състояние един електрон от 2s нивото прескача на 2p нивото, т.е. С-атом има общо 4 валентни електрона:
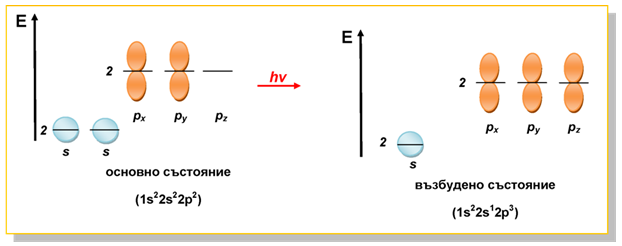
Фиг. 29. Електронна конфигурация на С-атом в основно и възбудено състояние
При взаимодействието на една s и три p AO на С се образуват 4 еквивалентни sp3 ХAO. Хибридните АО имат форма на неправилна обемна осморка (фиг. 30, 31).
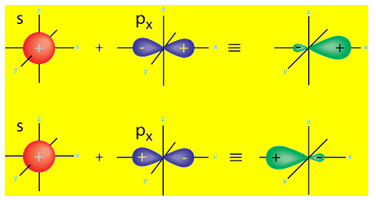
Фиг. 30. Форма на sp3 ХAO
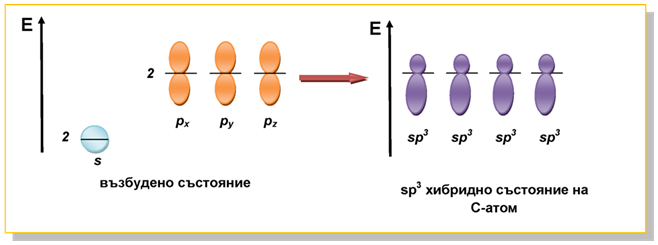
Фиг. 31. Възбудено и sp3 хибридно състояние на С-атом
Фиг. 32. sp3 хибридизация на С-атом в молекулата на CH4
Sp3 хибридизация е характерна за алканите. Хибридните орбитали са напълно равностойни и се разполагат около ядрото на С-атом с обемистите части навън, под ъгъл 109о5’ във формата на тетраедър (линк Тема 6: Наситени алифатни въглеводороди - Aлкани (парафини), т.II. Молекулен строеж на алкани). Sp3 хибридизация е възможна и когато централният атом образува по-малко от четири връзки, но има свободни електронни двойки. В тези случаи обикновено валентният ъгъл е по-малък, но близък до 109о5’, поради което се говори за частична sp3 хибридизация. В молекулата на водата експериментално е доказано, че валентният ъгъл е равен на 104,5оС, следователно двете свободни електронни двойки при О-атом също са ориентирани в пространството: ъглова (L-образна) форма на молекулата.
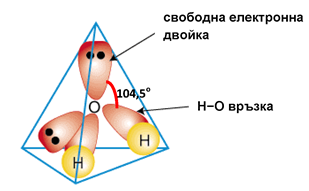
Фиг. 33. Частична sp3 хибридизация на O-атом в молекулата на H2O
В молекулата на NH3 валентният ъгъл е 107оС, а молекулата му има тригоналнa-пирамидална форма.
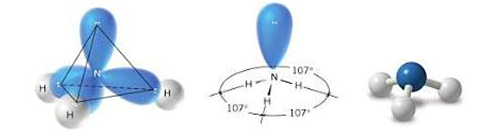
Фиг. 34. Частична sp3 хибридизация на N-атом в молекулата на NH3
VII.2. SP2 ХИБРИДИЗАЦИЯ
При sp2 хибридизацията се наблюдават три sp2 ХАО, получени при смесването на една 2s АО с 2px и 2py АО:
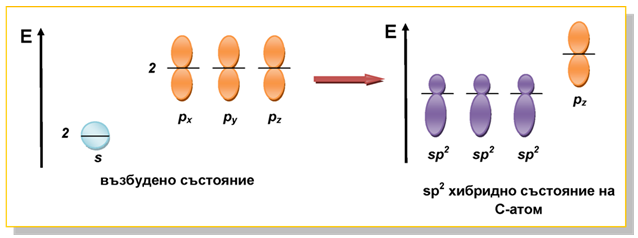
Фиг. 35. sp2 хибридно състояние на С-атом
Трите хибридни sp2 AO са разположени в една равнина под ъгъл 120о. Нехибридизираната 2pz AO не участва в хибридизацията и се разполага перпендикулярно на равнината на sp2 ХАО. Този тип хибридно състояние е характерно за алкени (линк Тема 7: Ненаситени алифатни въглеводороди - Алкени, т.III. Молекулен строеж на алкени), алкадиени, арени (линк Тема 9: Ароматни въглеводороди (арени), т.II. Молекулен строеж) и др. В молекулата на 1,3-бутадиена четирите С-атоми са в sp2 хибридно състояние и образуват се 6 σ-(С-Н)-връзки и 3 σ-(С-С)-връзки. Страничното взаимно припокриване на нехибридизираните 2pz АО на четирите С-атома води до образуването на π-квартет (делокализирана π-връзка):
Фиг. 36. sp2 хибридизация на С-атоми, σ- и π-връзки в молекулата на 1,3-бутадиена
VII.3. SP ХИБРИДИЗАЦИЯ
При sp хибридизацията на С-атом се наблюдават две sp ХАО, получени при припокриването на 2s и 2px AO и разположени под ъгъл 180о. 2py и 2pz AO остават нехибридизирани.
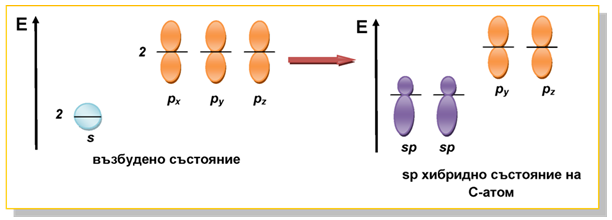
Фиг. 37. sp хибридно състояние на С-атом
Sp-хибридизацията е характерна за алкините (линк Тема 8: Ненаситени алифатни въглеводороди - Алкини, т.III. Молекулен строеж). Пространствената геометрия на молекулите зависи, както от вида хибридизация, така и от специфичния строеж на молекулата (например наличие на свободни електронни двойки). Най-разпространените форми на молекулите в зависимост от тези параметри са представени на фиг. 38.
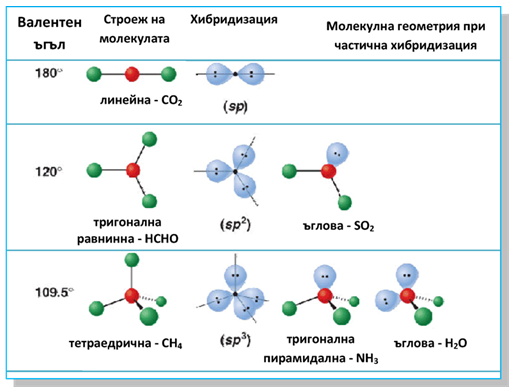
Фиг. 38. Пространствената геометрия на молекули на неорганични и органични химични съединения при sp3, sp2 и sp хибридно състояние
КЛЮЧОВИ ПОНЯТИЯ
дипол- полярна молекула
диполен момент (μ)- свързан е с орбиталното движение на електроните около атомното ядро, както и с въртенето на последните около собствената им ос (спин на електроните)
електронно сродство (електроафинитет) (А)- енергията, която характеризира приемането на електрон от атома в основно състояние, (J), (eV)
електроотрицателност (χ)- свойство на атомите на химичните елементи при свързване в молекули да привличат към себе си общите електронни двойки
йонизационна енергия (йонизационен потенциал) (I)- енергията, необходима за отделянето на един или повече електрони от атома, (J), (eV)
хибридизация- моделно взаимодействие между орбиталите на валентните електрони в един и същи атом, което води до получаване на нови хибридни орбитали
ХО- хибридна орбитала
σ-връзка- образува се при взаимното припокриване на АО по оста, свързваща атомните ядра
π-връзка- получава при странично припокриване на две АО, т.е. в равнина перпендикулярна на равнината на σ-връзката
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
1. Посочете вида на химичните връзки в следните съединения/йони: CH4, NO2, H2O, HI, H2S, KBr, NH4+, Cu.
Отговор
2. Определете зарядите на йоните в йонните съединения: AlCl3, CaO, K2S, CuSO4.
Отговор
3. Кои вещества се характеризират с добра електропроводимост, топлопроводимост и ковкост. На какво се дължат тези свойства?
Отговор
4. В образуването на общи електронни двойки участват:
А. всички електрони от най-външния електронен слой;
B. единичните валентни електрони;
C. всички сдвоени електрони;
D. електроните, разположени най-близко до ядрото.
Отговор
5. От какво се определят полярната и неполярната ковалентни химични връзки?
A. от всички електрони в атома;
B. от броя на свързващите електронни двойки;
C. от електроотрицателността на свързващите се атоми;
D. от броя на валентните електрони.
Отговор
6. Кое твърдение за ковалентната полярна връзка е неправилно?
A. свойствата на атомите в молекулата не влияят върху полярността на ковалентната връзка;
B. електронната двойка е несиметрично разположена между ядрата на двата свързващи атома;
C. колкото по-голяма е разликата в електроотрицателността на свързаните елементи, толкова по-полярна е връзката;
D. йонната връзка представлява ковалентна полярна връзка.
Отговор
7. В молекулите на координационните съединения задължително присъства?
A. водородна;
B. метална;
C. ковалентна;
D. донорно-акцепторна.
Отговор
8. В молекулите на кой ред вещества връзките са ковалентни неполярни?
А. CO2, H2O, HCl
B. CaCl2, NaOH, KI
C. Cl2, O2, N2
D. NH3, F2, CH4.
Отговор
9. Кое от следните твърдения е коректно: (възможен е повече от един верен отговор)
А. Кратността на химичните връзки е правопропорционална на енергията и обратнопропорционална на дължината на химичната връзка.
B. Диполният момент е вектор, насочен от по-малко електроотрицателния към по-електроотрицателния атом.
С. Енергията на химичната връзка нараства с увеличаване на кратността й.
D. Зависимостта между дължината на химичната връзка и енергията й е правопропорционална.
E. Семиполярната връзка може да се разгледа като комбинация между ковалентна неполярна връзка и йонна връзка.
Отговор
10. Какво изобразяват следните фигури:
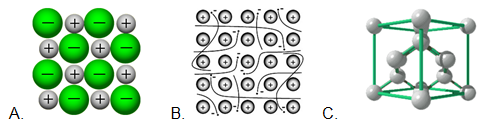
Отговор
11. Довършете изреченията:
A. При взаимодействието на една s и три p AO се образуват ………………………………..
B. При sp хибридизацията на С-атом се наблюдават ……. sp ХАО, а ….. и …… AO остават нехибридизирани.
C. При sp2 хибридизацията се наблюдават ……… ХАО, получени при смесването на една 2s АО с една 2px и една 2py АО.
Отговор
12. Кои твърдения са коректни?
A. sp3 хибридизация е възможна и когато централният атом образува по-малко от четири връзки, но има свободни електронни двойки.
B. Пространствената геометрия на молекулите зависи от вида хибридизация, но не зависи от молекулния стореж.
C. В образуването на π-връзки участват, както хибридизирани, така и нехибридизирани АО.
D. Необходимо условие за хибридизацията е участващите орбитали да бъдат близки по енергия.
Отговор
13. Сравнете по сила σ- и π-връзките. Обосновете отговора си детайлно.
Отговор
14. Пояснете какво изобразяват следните три фигури? Подредете фигурите последователно в логичен ред.
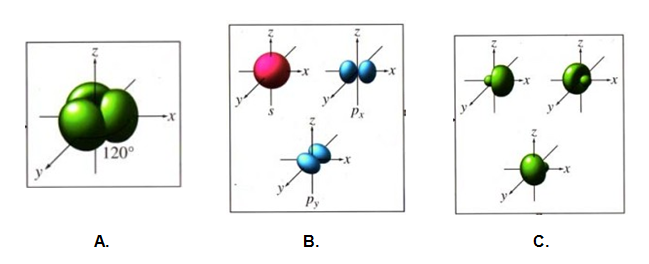
Отговор
15. Обозначете хибридното състояние на C в молекулата на HCN, вида на АО и връзките, които се получават, в резултат на припокриването им. Каква според вас е геометричната форма на молекулата на HCN?
Отговор
16. Обяснете по какво си приличат и по какво се различават σs-s, σs-p и σp-p връзките. Посочете примери.
Отговор




