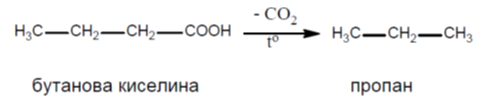МОНОКАРБОКСИЛОВИ КИСЕЛИНИ
I. ОПРЕДЕЛЕНИЕ, НОМЕНКЛАТУРА, ХОМОЛОЖЕН РЕД

I.1. ОПРЕДЕЛЕНИЕ
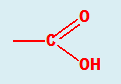
Те могат да се разгледат и като производни на въглеводородите, в чиито молекули един Н-атом е заместен с −COOH група.
I.2. НОМЕНКЛАТУРА
Наименованията на моно-карбоксиловите киселини по IUPAC се образуват като към наименованието на съответния въглеводород със същия брой C-атоми се прибави окончанието „-ова киселина”.
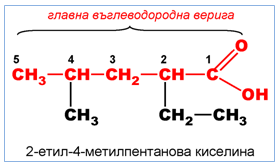
Наименованията на субституираните монокарбоксилови киселини, които съдържат в молекулата си втора функционална група, се образуват с представките хидрокси-, амино-, хлоро- и т.н. Мястото на втората функционална група или заместител/и по отношение на карбоксиловата се отбелязва с цифра (по IUPAC) или с буква от гръцката азбука (при тривиалните наименования), като −COOH групата е “старша”, т.е C-атом от −COOH групата получава номер “1”.

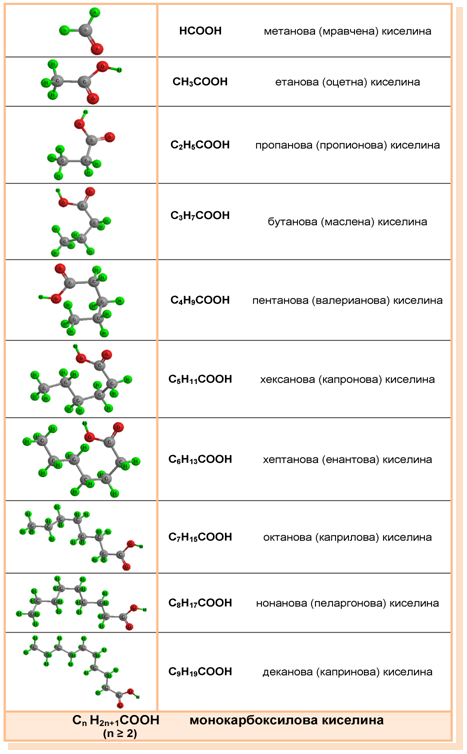
I.3. ХОМОЛОЖЕН РЕД НА АЛИФАТНИ НАСИТЕНИ МОНОКАРБОКСИЛОВИ КИСЕЛИНИ
Таблица 7. Хомоложен ред на алифатни наситени монокарбоксилови киселини
II. ИЗОМЕРИЯ

II.1. ВЕРИЖНА ИЗОМЕРИЯ
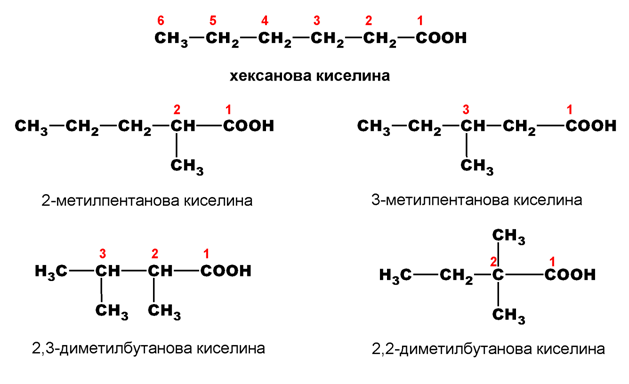
При наситените монокарбоксилови киселини е възможна верижна изомерия. Положението на страничните вериги се означава с цифри, като С-атом от карбоксиловата група получава винаги No.1.
II.2. ОПТИЧНА ИЗОМЕРИЯ
Наличието на асиметричен (хирален) въглероден атом (С*) в молекулата на монокарбоксиловите киселини определя тяхната оптическа активност. Такива молекули могат да съществуват в две пространствено изомерни форми, наречени енантиомери, оптични изомери или оптични антиподи, които се отнасят една спрямо друга като предмет и огледалния му образ.
Например в молекулата на 2-метилбутановата киселина вторият C-атом е асиметричен (С*):
Следователно тази киселина има два оптични изомера. Според R-/S-системата (правила на Кан-Инголд-Прелог) начинът на подреждане на заместителите при C*-атом се осъществява по „старшинство”:
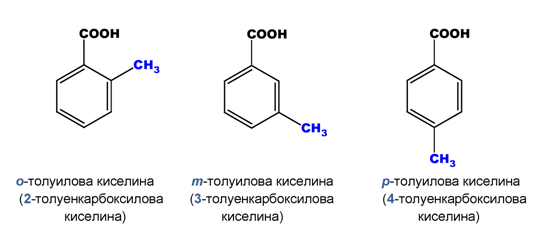
II.3. ПОЗИЦИОННА ИЗОМЕРИЯ ПРИ НЕНАСИТЕНИ И АРОМАТНИ МОНОКАРБОКСИЛОВИ КИСЕЛИНИ
 позиционни изомери на толуиловата киселина
позиционни изомери на толуиловата киселина
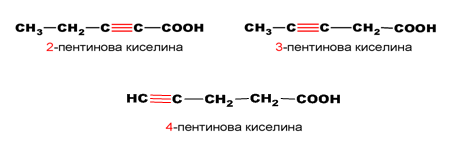
 позиционни изомери на пентиновата киселина:
позиционни изомери на пентиновата киселина:
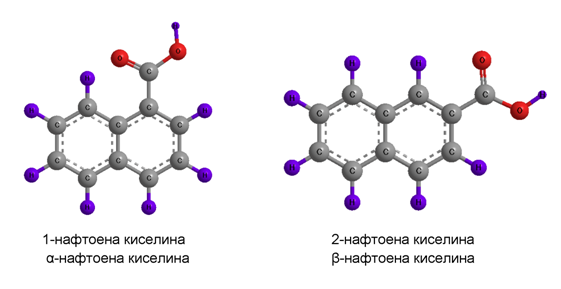
 позиционни изомери на нафтоената киселина
позиционни изомери на нафтоената киселина
II.4. ГЕОМЕТРИЧНА ИЗОМЕРИЯ ПРИ НЕНАСИТЕНИ МОНОКАРБОКСИЛОВИ КИСЕЛИНИ
Наличието на двойна C=C връзка и наличието на два еднакви заместителя, свързани поотделно с двата C-атома, участващи в двойната връзка при някои ненаситени монокарбоксилови киселини определя възможността за наличие на геометрични изомери (цис-, транс-). Такъв пример е 3-фенил-2-пропеновата киселина (3-фенил-акрилова киселина, канелена киселина):
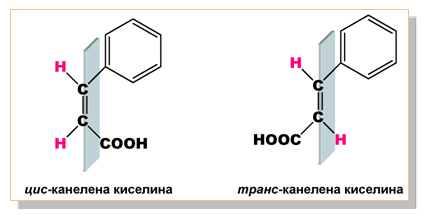
III.МОЛЕКУЛЕН СТРОЕЖ

Карбоксиловата група (−COOH) се разглежда като функционално нова група, съставена формално от две функционални групи: карбонилна (−C=O) и хидроксилна (−OH). Силното взаимно влияние на тези две групи определя качествено различните свойства на карбоксиловите киселини от карбонилните и хидроксилни производни на въглеводородите.
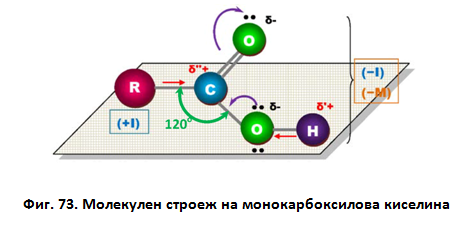
Атомите, свързани с С-атом от -COOH група са разположени в една равнина с ъгли между химичните връзките приблизително равни на 120о (фиг. 73). Тъй като C, O и H атоми имат различна електроотрицателност, −COOH група е силно полярна. Неподелената р-електронна двойка при О-атом от −ОН групата взаимодейства с π-електроните на двойната С=О връзка (ефект на π,р-спрягане) и увеличава полярността на О−Н връзката, което обуславя киселинните свойства на карбоксиловите киселини.
Под влияние на карбонилната двойна връзка се преразпределя електронната плътност в -СООН, което увеличава полярността на връзката О−Н до такава степен, че във воден разтвор се дисоциира водороден атом (киселинен характер).
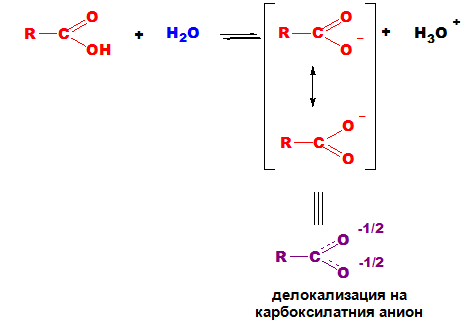
Полученият карбоксилатен анион се стабилизира, в резултат на резонансна стабилизация (делокализация) на отрицателния електричен товар. Реалната хибридна структура (в) се получава чрез наслагване на двете гранични структури (а и б) една върху друга. при която електронната плътност между карбоксиловия С-атом и двата О-атома е изравнена.
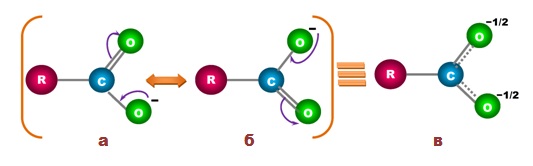
Делокализацията на отрицателния товар и на π-електроните са причина за значителната устойчивост на карбоксилатния анион, с което може да се обясни и дисоциацията на карбоксиловите киселини.
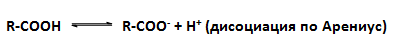
Наситените монокарбоксилови киселини, са слаби електролити, тъй като степента им на електролитна дисоциация е значително по-малка от тази на силните неорганични киселини.
Силата на наситените алифатни монокарбоксилови киселини намалява с увеличаване на молекулната маса. Най-силна е мравчената киселина. Под влияние на (+I) ефект на алифатния въглеводороден остатък (R-), при следващите хомолози намалява полярността на О−Н връзката. Това е причина за намаляване на киселинните свойства в хомоложния ред на наситените алифатни монокарбоксилови киселини.
При ароматните киселини бензеновият остатък има отрицателен индукционен ефект (-I), но по-малък по стойност в сравнение с отрицателния индукционен ефект на карбоксиловата група. Тези два отрицателни индукционни ефекта са с различна посока и се наслагват, в резултат на което сумарният индукционен ефект на -СООН групата е отрицателен (-I), но по-малък по стойност в сравнение с отрицателния индукционен ефект на -СООН групата при алифатните киселини.
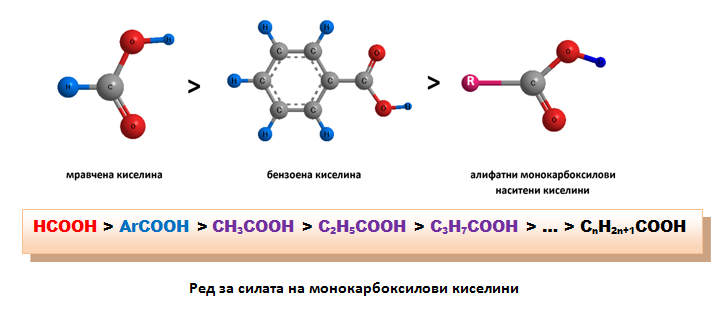
В молекулата на ароматните киселини π-електронния облак на ароматното ядро се спряга с π-електроните на -СООН групата. Наслагват се (-I) и (-М) ефектите на карбоксиловата група. Електронната плътност на ароматното ядро намалява, като относително най-голяма е на m-място.

|
Ароматните монокарбоксилови киселини са по-силни от алифатните.Карбоксиловата група в ароматните карбоксилови киселини ориентира заместителите в бензеновото ядро на m-място. |
IV. ФИЗИЧНИ СВОЙСТВА

Първите три хомолога на алифатните наситени монокарбоскилови киселини са лесно подвижни течности с остра миризма, следващите са маслообразни течности с неприятна миризма, а висшите са твърди вещества без миризма. Оцетната киселина например е безцветна течност с остра миризма и кисел вкус. При относително ниска температура (16.5оС) тя кристализира и затова се нарича ледена оцетна киселина. Мравчената киселина, която се намира в жлезите на определен вид мравки, е също течност с остра миризма, предизвикваща възпаление на кожата. Ароматните киселини са твърди вещества. Бензоената киселина е безцветно кристално вещество, което при загряване сублимира. Парите й имат остра миризма и дразнят дихателните пътища
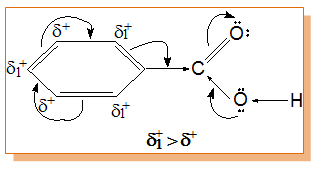
Карбоксиловите киселини съдържат в молекулите си полярни връзки и аналогично на алкохолите образуват междумолекулни Н-връзки ( Тема 4: Междумолекулни сили и връзки. Водородна връзка, т. II.1. Междумолекулна водородна връзка). Поради тази причина в течно и твърдо агрегатно състояние те съществуват като сравнително стабилни групировки под формата на цикличен димерен асоциат. За разкъсването на тези здрави Н-връзки е необходимо допълнително количество енергия.
Карбоксиловите киселини се характеризират с по-високи температури на кипене (ТкоС) от съответните представители на алкохолите и алдехидите със същата молекулна маса. Освен това зависимостта между Тк и молекулната маса на карбоксиловите киселини е правопропорционална
Фиг. 74. Сравнителен анализ на Тк в зависимост от молекулната маса при алкохоли ( Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т. IV. Физични свойства), алдехиди ( Тема 11: Карбонилни производни на въглеводородите - алдехиди и кетони т. IV. Физични свойства) и карбоксилови киселини
Таблица 8. Физикохимични свойства на някои представители на алифатните наситени монокарбоксилови киселини
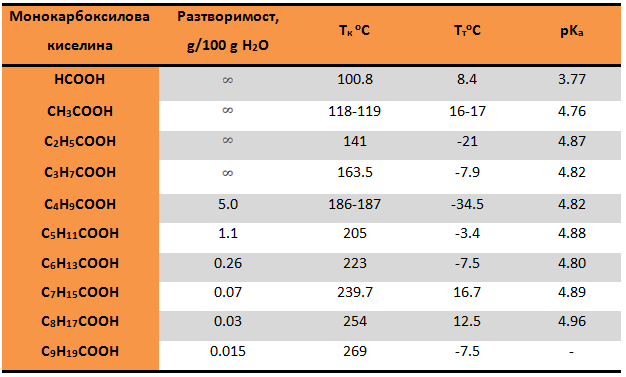
Такава ясно изразена зависимост по отношение на изменението на температурите на топене (ТтоС) на карбоксиловите киселини, обаче, не се наблюдава. Първите два представителя на хомоложния ред: HCOOH и CH3COOH се характеризират с високи Тт: 8оС и 17оС, съответно. Молекулите на тези две киселини имат равнинна структура и могат лесно да се подредят в правилната структура на кристална решетка.
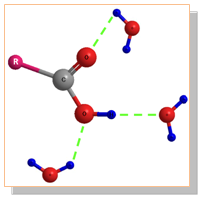
При карбоксиловите киселини с права въглеводородна верига се наблюдава интересна зависимост: Тт на киселините с четен брой С-атоми е по-висока от тази на киселините с нечетен брой.
Разтворимостта на карбоксиловите киселини се обяснява с образуването на междумолекулни Н-връзки между молекулите на киселината и Н2О. Поради тази причина низшите членове (от метанова до бутанова киселина) на хомоложния ред на алифатните наситени монокарбоксилови киселини се характеризират с почти неограничена разтворимост във вода.
С увеличаване на молекулната маса разтворимостта на киселините във вода намалява: C4H9COOH е с ограничена разтворимост, а C9H19COOH - практически неразтворима.
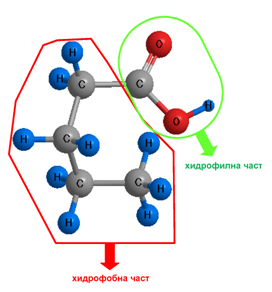
Молекулата на една карбоксилова киселина може да се разгледа като съставена от две части: хидрофилна и хидрофобна.
Увеличаването на дължината на хидрофобната част, т.е. на въглеводородната верига, води до увеличаване на дисперсионните сили между молекулите не киселините. Киселините, които имат ≥ 4 C-атома във въглеводородната си верига, киселинните молекули образуват отделна фаза и трудно се смесват с водата.
Висшите карбоксилови киселини се разтварят добре в неполярни разтворители (бензен, етер).
V. ХИМИЧНИ СВОЙСТВА

V.1. КИСЕЛИННО-ОСНОВНИ СВОЙСТВА
Протолитичните взаимодействия при карбоксиловите киселини са свързани с разкъсване на O-H връзката, при което се отделят H+, т.е. киселините са протонни донори. Делокализацията на отрицателния заряд стабилизира карбоксилатния йон и допринася за изтегляне на киселинно-основното равновесие надясно. Във водна среда ролята на база играе водната молекула. Мярка за силата на киселините е величината рКа = – lgKa. Колкото по-ниска е стойността на рКа, толкова по-силна е киселината във водна среда. За карбоксиловите киселини рКа обикновено е в интервала 4-5 рКа-единици.
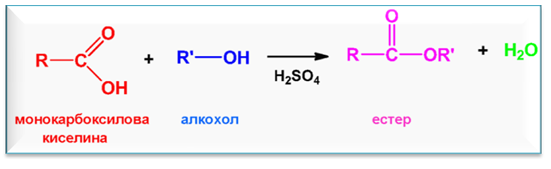
V.2. ЕСТЕРИФИКАЦИЯ
Естерификацията е бавен, молекулен и обратим химичен процес на взаимодействие между карбоксилова киселина и алкохол, в резултат на който се получава естер и се отделя молекула H2O. Реакцията се катализира от силни неорганични киселини (най-често к. H2SO4).
- Механизъм на естерификация на пропанова киселина с етанол
V.3. ПОЛУЧАВАНЕ НА ПРОИЗВОДНИ НА КАРБОКСИЛОВИТЕ КИСЕЛИНИ
- Киселинни халогениди (ацилхалогениди), амиди и нитрили
- Киселинни амиди
- Киселинни нитрили
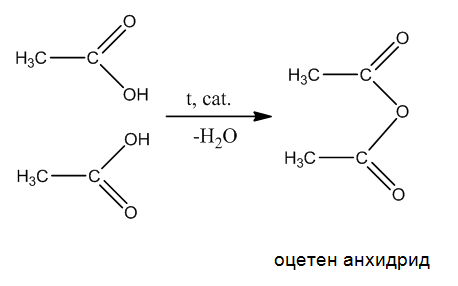
- Киселинни анхидриди (ациланхидриди) - получават се при каталитично междумолекулно обезводняване на карбоксилови киселини:
Киселинните халогениди се получават се при заместване на ОН-групата с халогенен атом (Х = Cl, F, Br, I). Киселинните флуориди се характеризират с много висока реактивоспособност и се съхраняват в специални ампули от резистентни материали. Киселинните йодиди са нестабилни и са практически без значение. Най-широко приложение при този тип реакции имат киселинните хлориди (SOCl2, PCl3, POCl3, PCl5) и бромиди (SOBr2, PBr3):
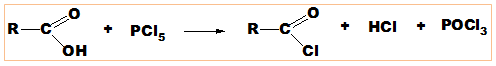
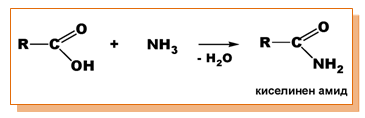
При взаимодействието на карбоксиловите киселини с NH3 се получават киселинни амиди:
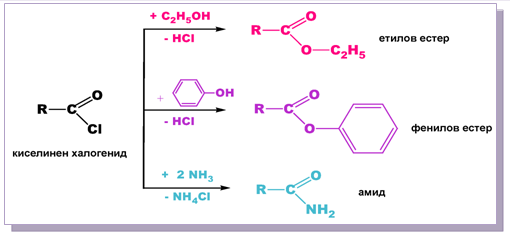
Електроотрицателният Х-атом увеличава δ+ при C-атом на COOH-група, в резултат на което киселинните халогениди встъпват по-лесно в нуклеофилни заместителни реакции с алкохоли и феноли, при което се получават съответните естери. При взаимодействието на киселинните халогениди с NH3 се получават отново амиди.
При вътрешномолекулно обезводняване на амиди се получават нитрили.
V.4. РЕДУКЦИЯ
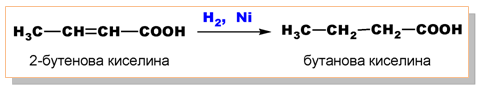
Карбоксиловата група е устойчива спрямо редукция. Тя не може да бъде редуцирана от H2 в присъствие на катализатор. Например 2-бутеновата киселина се редуцира до бутанова киселина под действието на H2 и катализатор Ni, но −COOH групата остава непроменена:
Карбоксиловата група може да бъде редуцирана само под действието на силно реактивния LiAlH4:
V.5. ДЕКАРБОКСИЛИРАНЕ
Това е процес на отделяне на CO2 от -COOH група на карбоксиловите киселини и получаване на съответните въглеводороди.
Декарбоксилирането на алифатните карбоксилови киселини протича при нагряване в присъствие на натронкалк:
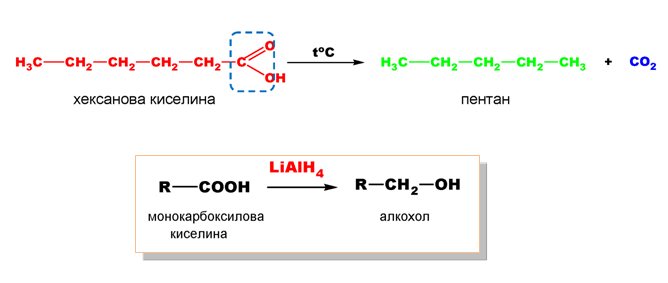
При ароматните карбоксилови киселини процесът на декарбоксилиране се извършва също при нагряване, но в среда от хинолин и присъствие на катализатор Cu-прах.
V.6. ПОЛУЧАВАНЕ НА ПЕРОКСОКИСЕЛИНИ
При взаимодействие на карбоксиловите киселини с H2O2 се получават перкарбоксилови (пероксо-) киселини. Те съдържат в молекулите си още един О-атом при карбоксиловата група - връзката −О−О−.
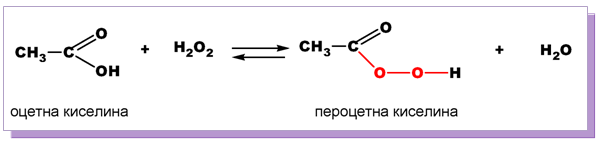
Пероксокиселините имат окислително и дезинфекционно действие, тъй като при обикновени условия те отделят атомен О. В резултат на нагряване или UV-облъчване се наблюдава разкъсване на −О−О−връзката и отделяне на силно реактивоспособни R• и RO• радикали.
V.7. РЕАКЦИИ ХАРАКТЕРНИ ЗА α-С АТОМ, СПРЯМО КАРБОКСИЛОВАТА ГРУПА
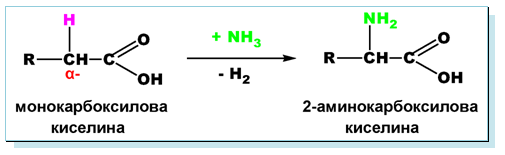
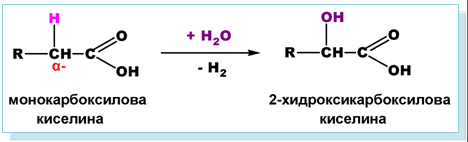
Аналогично на алканите, въглеводородният остатък в наситените алифатни (алканови) монокарбоксилови киселини също може да участва в заместителни реакции. Поради (-I)-ефект -COOH групата влияе върху подвижността на H-атоми при съседно разположените (α−) C-атоми. Този ефект се проявява най-силно при карбоксилови киселини, съдържащи α−Н атоми. Поради повишената реактивоспособност на α−Н атоми те лесно встъпват в заместителни реакции (с X2, NH3, H2O), при което се получават субституирани (халогено-, амино- и хидрокси-) карбоксилови киселини.
- Халогениране
- Взаимодействие с амоняк
- Нитриране
- Хидратиране
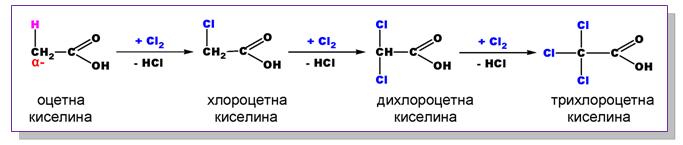
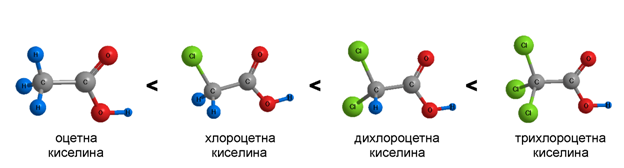
Тъй като индукционният ефект на хлорните атоми е адитивен, силата на тези хлорокарбоксилови киселини расте в следния ред:
При взаимодействието на монокарбоксилови киселини с амоняк се заместват α−Н атоми с амино група (–NH2), в резултат на което се получават α−аминокарбоксилови киселини.
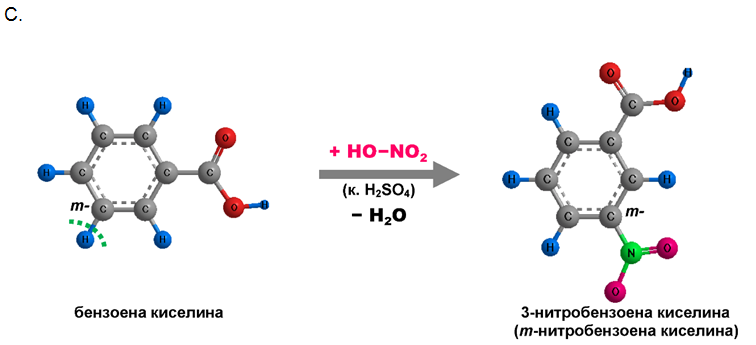
При нитриране на бензоена киселина с нитрирна смес се получава 3-нитробензоена киселина ( m-нитробензоена киселина):
Арил-алифатните карбоксилови киселини също притежават подвижен α-Н атом (в метиленовата група -CH2-) и могат да взаимодействат с органомагнезиеви съединения.
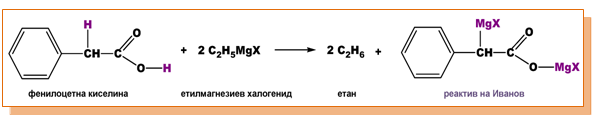
Например при взаимодействието на фенилоцетна киселина с етилмагнезиев халогенид се получава етан и реактива на Иванов, открит от българския химик акад. Димитър Иванов.
VI. БИОЛОГИЧНО ЗНАЧЕНИЕ НА МОНОКАРБОКСИЛОВИТЕ КИСЕЛИНИ

- Метанова (мравчена) киселина - HCOOH
- Оцетна (етанова) киселина - CH3COOH
- Маслена (бутанова) киселина - C4H9COOH
- Валерианова (пентанова) киселина - C4H9COOH
- Палмитинова (хексадеканова) киселина - C15H31COOH
- Стеаринова (октадеканова) киселина - С17Н35COOH
- Олеинова киселина - C17H33COOH
- Линолова киселина - C17H31COOH
- Линоленова киселина - C17H29COOH
- Бензоена киселина
- Фенилоцетна киселина

Мравчената киселина се съдържа в жлезите на някои представители от разред Ципокрили (червени мравки, пчели), във власинките на копривата. Основната й употреба е като консервант (E236) и антибактериално средство във фуражи за селскостопански животни. В пчеларството се използва като акарицид. Намира приложение в текстилната промишленост и при щавенето на кожи. Някои формиатни естери са изкуствени ароматизатори за парфюми. Тя е активната съставка на някои марки домакински почистващи препарати за котлен камък. Перспективни са и горивните клетки, които използват модифицирана мравчена киселина. Солите на мравчената киселина се наричат формиати.
Чистата, безводна оцетна киселина е безцветна хигроскопична течност и замръзва при температура < 16,7°C до безцветно твърдо кристално вещество - ледена оцетна киселина. Оцетната киселина е корозивна и изпаренията й дразнят очите и носа, въпреки че е слаба киселина. Тя е важен химически реактив и промишлен химикал, който се използва в производството на полиетилентерефталат (PET), използван главно за производство на пластмасови бутилки за напитки; на целулозен ацетат, главно за фотофилми и на поливинилацетат за лепило за дърво, както и в много синтетични влакна и тъкани. В хранителната промишленост оцетната киселина се използва под код за хранителна добавка Е260 като регулатор на киселинността. Оцетната киселина има широко приложение в практиката. 6% и 9%-ните й разтвори са известни под търговското наименование оцет. Оцетната киселина се произвежда и отделя от определени бактерии, особено от рода Acetobacter и Clostridium acetobutylicum. Тези бактерии присъстват навсякъде в хранителните продукти, водата и почвата и оцетна киселина се получава естествено при разваляне на плодове и някои други храни. Оцетната киселина е компонент и на вагиналната лубрикация при човека и други примати, където тя служи като слаб антибактериален агент.
Маслена киселина се съдържа в млякото (козе, овче, биволско), маслото, някои видове сирена, в потта, освен това тя е един от продуктите на анаеробна ферментация. Неприятният мирис на гранясали масла се дължи на освободената от триглицериди при процеса хидролиза бутанова киселина. Тя е важен член на групата на т .нар. летливи или късо-верижни мастни киселини. Солите и естерите на бутановата киселина са наричат бутирати или бутаноати. Някои от тях, например метил бутирата, имат приятни аромати или вкусове и намират приложение като добавки към храни или парфюми. Маслената киселина се използва и като добавка за храна за животни, поради способността й да намалява патогенната бактериална колонизация. Изомаслената киселина се намира в свободно състояние в рожков (Ceratonia siliqua) - вечнозелено растение от семейство Бобови, като етилов естер в маслото от Croton tiglium.

Валериановата киселина се съдържа в растението дилянка (валериана — Valeriana officinalis), от което е получила името си. Основното й приложение е синтезът на нейните естери. Летливите естери на валериановата киселина имат приятна миризма и се използват в парфюмерията и козметиката. Етилвалератът и пентилвалератът се използват като хранителни добавки заради плодовите си вкусове.

|
Наситените мастни киселини се свързват с глицерола в организма, при което се формират триглицериди с твърда консистенция или твърди мазнини. Ненаситените мастни киселини при свързване с глицерола формират течни масла. Поради наличието на поне една двойна връзка при тях винаги съществуват поне два изомера – т.нар. цис- и транс- изомери. В живите организми съществуват единствено цис-изомерите. Транс-изомерите са несвойствени за организма и ефектите им в него не са добре проучени. Полиненаситените мастни киселини са от особено голямо физиологично значение, тъй като от тях се синтезират медиатори, участващи в процеса на кръвосъсирване, възпаление и др. Също така, те повлияват нивата на холестерола в кръвта, както и окислението му, което е от значение срещу атеросклероза. |
Палмитиновата киселина е една от най-често срещаните висши наситени мастни киселини при животните и растенията. Среща се в палмовото масло, сиренето, млякото и месото. Не се разтваря във вода, слаборазтворима в алкохол и естер. Може да се получи при хидролиза на естествени мазнини с прегрята водна пара, тъй като тя е първата мастна киселина, която се отделя при дестилация.
Стеариновата киселина е една от многото полезни наситени висши мастни киселини, съдържащи се в животинските и растителни мазнини и масла. Стеариновата киселина се използва като съставна част на свещи, сапуни и козметични средства, както и за омекотяване на гуми.
Твърда смес от палмитинова и стеаринова киселина (стеарин) се използва за направа на свещи. Натриевата и калиевата сол на палмитиновата и стеариновата киселина са сапуни.
Олеиновата киселина е мононенаситена мастна киселина, която се съдържа в организмите на някои животни и растения. Тя е бледожълта или кафеникаво-жълта мазна течност с мирис, подобен на този на свинската мас. Зехтинът представлява 55–80 % олеинова киселина.
Линоловата киселина съдържа две двойни връзки. Тя влиза в състава на много растителни и някои животински масла под формата на триглицериди.
Линоленовата киселина принадлежи към класа на омега-3 полиненаситените мастни киселини. Тя съдържа три двойни връзки и като триглицерид се съдържа в много растителни масла.
Солите на бензоената киселина се наричат бензоати. При нагряване сублимира. Слабо се разтваря във вода. Разтваря се в етанол, етер и други органични разтворители. Парите й имат остра миризма и дразнят дихателните пътища. Има антисептично действие и се използва в хранително-вкусовата промишленост като консервант, най-вече в алкохолните напитки. Най-широко приложение има нейната сол - натриев бензоат. Използва се и за синтез на фунгициди, лекарства, багрила и др. Смята се за една от най-вредните добавки сред разрешените консерванти.
Фенилоцетната киселина представлява безцветно кристално вещество със слаба разтворимост във вода и добра разтворимост в органични разтворители. Тя е била доказана като активен ауксин (растителен хормон) в плодовете. Тази киселина е продукт на разпадането на белтъчните вещества в организма и се отделя чрез урината под формата на фенацетурова киселина.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
адитивен - наслагващ се
амид - съединение, съдържащо органична функционална група, състояща се от карбонилна група (C=O), свързана с азотен атом (N)
асиметричен С-атом - въглероден атом, който е свързан с четири различни вида атоми или групи от атоми
декарбоксилиране - процес на отделяне на CO2 от -COOH група на карбоксиловите киселини при нагряване и получаване на съответните въглеводороди
дисоциация (електролитна)- процес, при който определена група вещества, наречени електролити се разпадат в разтвор или стопилка се разпдат до йони
енантиомери - оптични изомери, които се отнасят една спрямо друга като предмет и огледалния му образ
киселинен анхидрид - органично съединение с обща формула (RC(O))2O, което има две ацилни групи, като най-често, двата ацилни остатъка произхождат от една и съща карбоксилова киселина
натронкалк - абсорбент на въглероден диоксид, който представлява смес от NaOH, Ca(OH)2 и H2O
нитрили - органични съединения с обща формула R-C≡N, които могат да се разгледат като производни на циановодородната киселина HC≡N
хидрофилен - лесно свързващ се с водата, проявяващ афинитет към водата
хидрофобен - който не проявява афинитет към водата
хинолин - органично хетероциклично съединение 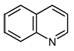

ВЪПРОСИ И ЗАДАЧИ
1. Напишете общата формула на наситените монокарбоксилови киселини.
Отговор
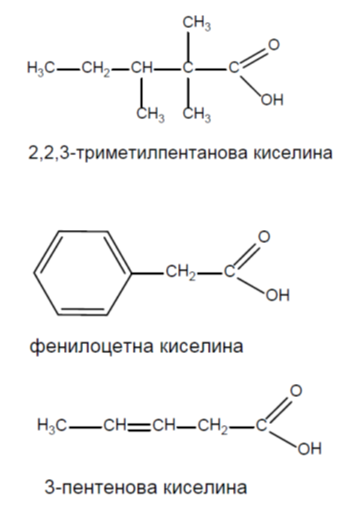
2. Напишете структурните формули на: 2,2,3-триметилпентанова киселина, фенилоцетна киселина, 3-пентинова киселина.
Отговор
3. При 2-пентеновата киселина е/са възможна/и:
А. позиционна изомерия
B. геометрична изомерия
C. оптична изомерия
D. верижна изомерия.
Отговор
4. В какъв ред нараства силата на следните монокарбоксилови киселини: C4H7COOH, HCOOH, C6H5COOH, CH3COOH.
Отговор
5. На какво се дължи почти неограничената разтворимост във вода на първите членове от хомоложния ред на монокарбоксиловите киселини?
Отговор
6. Допълнете прехода с липсващите реагенти, междинни и крайни продукти:
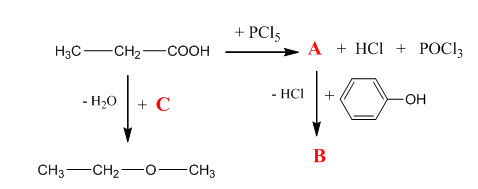
Отговор
7. Какъв е реакционният продукт, който се получава при междумолекулно каталитично обезводняване на две молекули оцетна киселина? Напишете химичната реакция.
Отговор
8. При нитрирането на бензоена киселина с нитрирна смес се получава:
А. о-нитробензоена киселина
B. р-нитробензоена киселина
C. m-нитробензоена киселина
D. 2,4,6-тринитробензоена киселина.
Обосновете отговора си. Напишете химичната реакция.
Отговор
9. Довършете химичната реакция:
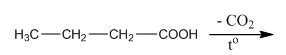
Как се нарича този процес?
Отговор
10. Коe от посочените твърдения е коректно (възможен е повече от един отговор):
А. Наситените монокарбоксилови киселини, са слаби електролити, тъй като степента им на електролитна дисоциация е значително по-малка от тази на силните неорганични киселини
B. Силата на наситените алифатни монокарбоксилови киселини намалява с увеличаване на молекулната маса.
C. Атомите, свързани с С-атом от -COOH група са разположени в една равнина с ъгли между химичните връзките приблизително равни на 109.5о:
D. Карбоксиловата група в ароматните карбоксилови киселини ориентира заместителите в бензеновото ядро на о- и p-място.
Е. Карбоксиловата група не може да бъде редуцирана от H2 в присъствие на катализатор.
Отговор