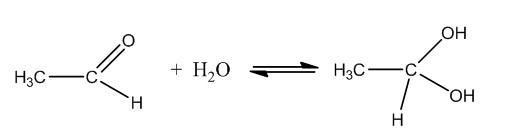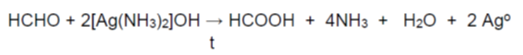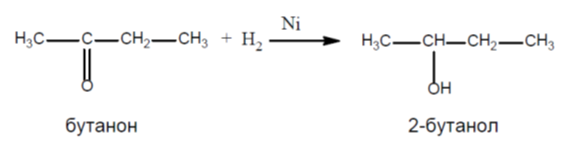КАРБОНИЛНИ ПРОИЗВОДНИ НА ВЪГЛЕВОДОРОДИТЕ
АЛДЕХИДИ И КЕТОНИ
I. ОПРЕДЕЛЕНИЕ, КЛАСИФИКАЦИЯ, НОМЕНКЛАТУРА

I.1. ОПРЕДЕЛЕНИЕ
I.2. КЛАСИФИКАЦИЯ
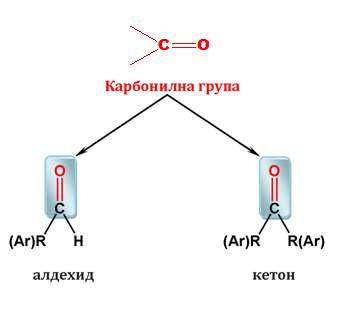
Според вида на заместителите при карбонилната група, те биват алдехиди и кетони. Карбонилната група при алдехидите е свързана с водороден атом и въглеводороден радикал (R) или с два водородни атома, а при кетоните – с два въглеводородни радикалa.
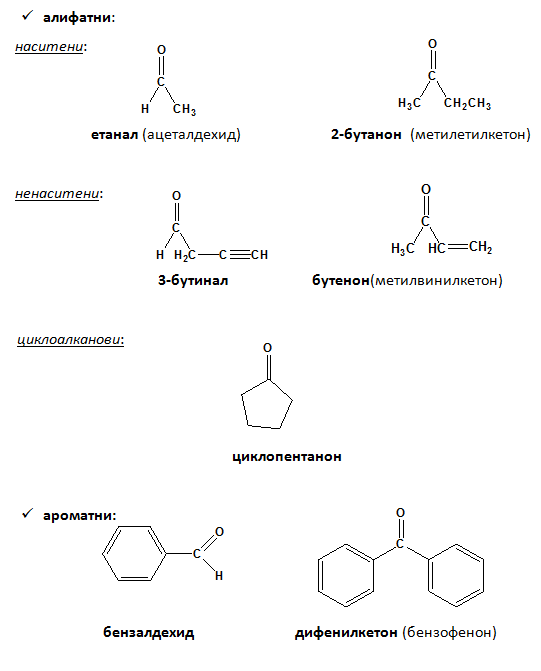
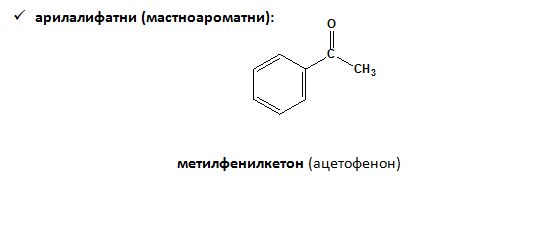
- В зависимост от вида на въглеводородния/те остатъци, алдехидите и кетоните се класифицират на:
- Според броя на карбонилните групи алдехидите и кетоните се класифицират на:

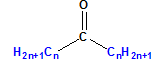
Прости са кетони, които притежават еднакви наситени алифатни остатъци:
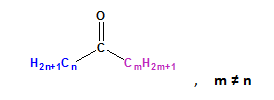
Смесените кетони притежават различни наситени алифатни остатъци:
I.3. НОМЕНКЛАТУРА ПРИ АЛДЕХИДИ
Според IUPAC:
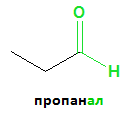
1) Наименованията на алдехидите се образуват от наименованието на съответния въглеводород със същия брой C-атоми и окончанието „-ал”:
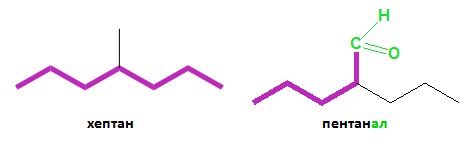
2) За главна верига при алдехидите се избира най-дългата, която съдържа C-атом от алдехидната група:
3) При номерирането на главната верига при алдехидите, C-атом от -CHO групата приема номер 1, независимо от присъствието на π-връзки, хидроксилни групи (-ОH) или други алкилови заместители.

4) Циклични съединения (циклоалкани, арени), съдържащи алдехидна група непосредствено свързана с пръстена се наричат карбалдехиди.
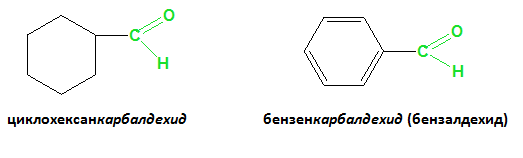

I.4. НОМЕНКЛАТУРА ПРИ КЕТОНИ
Според IUPAC:
1) Наименованията на кетоните се образуват от наименованието на съответния въглеводород със същия брой C-атоми и окончанието „-он”:
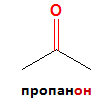
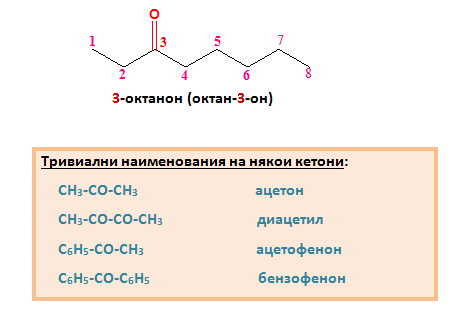
2) Посочва се позицията на кетогрупата във въглеводородната верига, така че тя да получи най-малък пореден номер.
II. МОЛЕКУЛЕН СТРОЕЖ

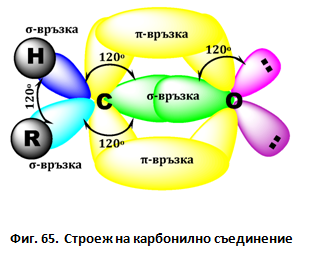
Карбонилната група се състои от един С-атом и един О-атом. С-атом е в sp2 хибридно състояние и образува общо три σ-връзки с трите си хибридни атомни орбитали (АО), лежащи в една равнина под ъгъл 120о (Фиг. 65). Нехибридизираните p-АО на C и О атоми се припокриват странично формирайки π-връзка (Фиг. 65).
Карбонилната група се характеризира с отрицателен индукционен ефект (-I) и отрицателен мезомерен ефект (резонансен ефект, ефект на спрягане, (-М), фиг. 66).
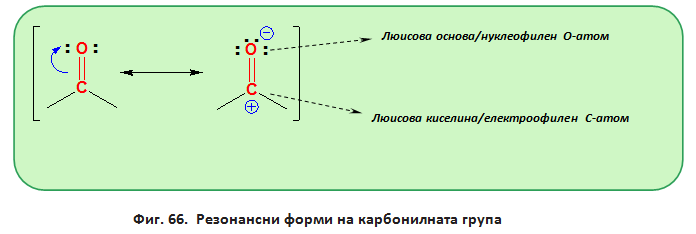
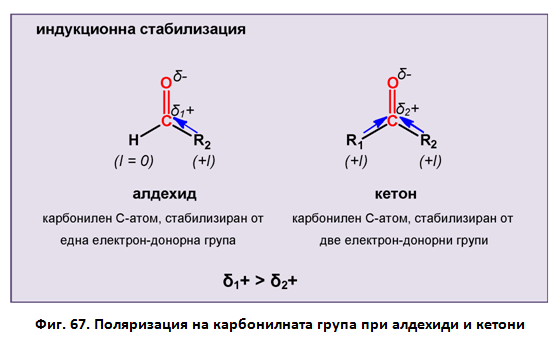
Подобно на алкените Тема 7: Ненаситени алифатни въглеводороди - Алкени, т.III. Молекулен строеж на алкени , двойната въглерод-кислородна връзка в карбонилната група се състои от една σ - и една π-връзка, което обуславя плоския строеж на тази част от молекулата на алдехидите и кетоните. Поради по-голямата електоотрицателност на О-атом от тази С-атом двойната въглерод-кислородна връзка в карбонилната група е поляризирана (μ-2,7 D). Под влияние на R електронната плътност се изтегля към карбонилния О-атом, който получава частичен отрицателен заряд (δ-), а карбонилният С-атом - получава частичен положителен заряд (δ+), т.е. π-връзката в карбонилната група е силно полярна, което определя високата реактивоспособност на алдехидите и кетоните. Като се има предвид, че алкиловите радикали (R) се характеризират с +I (донор на електрони) те частично компенсират δ+ на карбонилния С-атом, което понижава поляризацита на двойната връзка при кетоните. Замяната един R с H-атом (I = 0) в молекулата на алдехидите, спрямо кетоните, води до повишаване полярноста на карбонилната връзка при алдехидите. Това определя по-високата реактивоспособност на алдехидите, спрямо кетоните (δ1+> δ2+, фиг. 67).
III. ИЗОМЕРИЯ

III.1. ВЕРИЖНА ИЗОМЕРИЯ
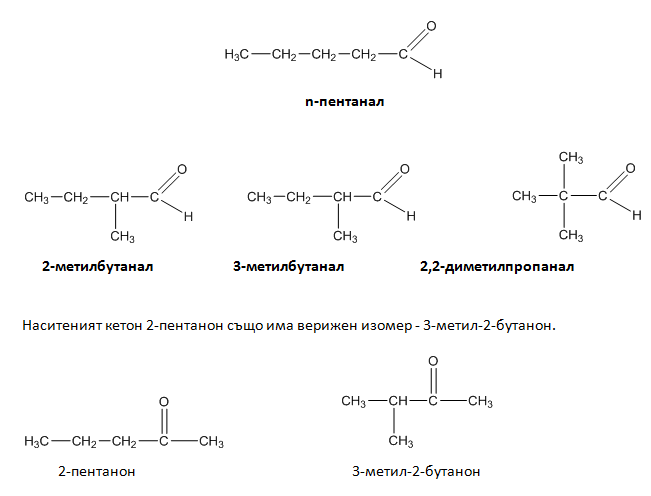
При наситените алдехиди и кетони се наблюдава верижна изомерия. Например, n-пентаналът има три верижни изомера: 2-метилбутанал, 3-метилбутанал и 2,2-диметилпропанал.
III.2. ПОЗИЦИОННА ИЗОМЕРИЯ
III.2.1. При ненаситени алдехиди и кетони
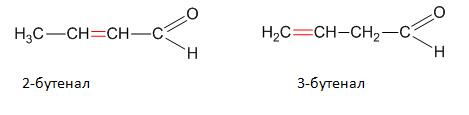
Позиционните изомери при ненаситените алдехиди и кетони се различават по мястото на сложната (двойна, тройна) връзка във въглеродната верига.
Позиционни изомери са например 2-бутенала и 3 бутенала:
III.2.2. При наситени кетони
При наситените кетони е възможна позиционна изомерия, която се определя от мястото на кето-групата във веригата. Такива изомери са например 2-пентанон и 3-пентанон:

III.2.3. Функционална позиционна изомерия
Алдехидите и кетоните с еднакъв брой въглеродни атоми могат да се разглеждат като позиционни изомери (различна позиция на общата за двата класа съединения функционална група - карбонилната група (-CHO).
Например на съединенията с обща молекулна формула С4Н8О отговарят бутанал и бутанон:
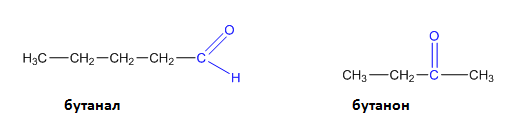
Тези съединения се означават като функционални изомери, поради значителната разлика в техните химични отнасяния, която е причина те да образуват два отделни класа съединения (алдехиди и кетони) и респективно карбонилната група при първите да се нарича алдехидна, а при вторите - кетонна.
III.3. КЕТО-ЕНОЛНА ТАВТОМЕРИЯ
Кето-енолната тавтомерия е характерна само за алдехиди и кетони, притежаващи H-атом на α-място, спрямо карбонилната група. Този вид структурна изомерия се изразява във вътрешномолекулна миграция на протон, съпроводена с промяна мястото на двойната връзка.
Обикновено равновесието е изтеглено към енергетично по-стабилния изомер.
III.4. ОПТИЧНА ИЗОМЕРИЯ
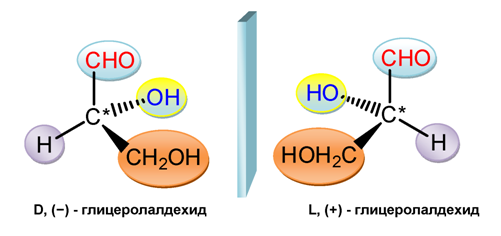
Според D-/L-системата (правила на Фишер) за определяне на начина на подреждане на заместителите при асиметричния C*-атом се използва еталонно оптически активно вещество. По предложение на Розанов за стандартно вещество е бил приет глицеролалдехида. С-атом от алдехидната група, който е с най-висока степен на окисление, се поставя най-горе във формулата. Приема се, че (+), т.е. дясновъртящата му форма, в която ОН-групата е вдясно, се нарича D-конфигурация, а (-), т.е. лявовъртящата форма (ОН-групата е вляво) - L-конфигурация.
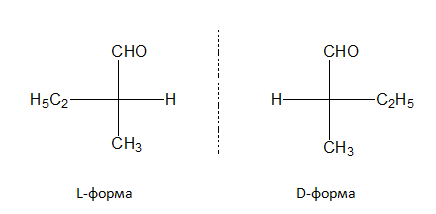
2-метилбутаналът съдържа асиметричен въглероден атом. Следователно при него също се наблюдава пространствена изомерия:
При съединения, съдържащи два неравностойни асиметрични С-атома са възможни четири пространствени форми, които са две по две енантиомерни. Пример за такъв алдехид е 2,3,4-трихидроксибутанала, който образува два рацемата - а-б и в-г:
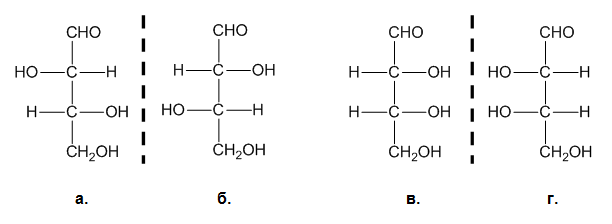
Изомерните форми а и в, а и г, б и в, б и г се характеризират с частична енантиомерност, т.е. само части от структурата на молекулите им се отнасят една спрямо друга като предмет и огледалния му образ. Такъв тип оптични изомери се наричат диастереомери.
IV. ФИЗИЧНИ СВОЙСТВА

Низшите алдехиди и кетони са течности (с изключение на метанала) с умерена разтворимост във вода, а висшите членове на хомоложните редове са твърди вещества, неразтворими във вода. Карбонилните производни на въглеводородите са разтворими в органични разтворители със средна полярност (Таблица 6). Полярността на карбонилната връзка обуславя по-високите им температури на кипене на алдехидите и кетоните в сравнение с неполярни алкани Тема 6: Наситени алифатни въглеводороди - Aлкани (парафини), т.IV. Физични свойства с приблизително равна молекулна маса; и по-ниските им температури на кипене в сравнение с алкохоли Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т.IV. Физични свойства с приблизително равна молекулна маса.

V. ХИМИЧНИ СВОЙСТВА НА АЛДЕХИДИ И КЕТОНИ

V.1. НУКЛЕОФИЛНИ ПРИСЪЕДИНИТЕЛНИ РЕАКЦИИ (AN)
С-атом на карбонилната група е sp2 хибридизиран с тригонална равнинна геометрия. При нуклеофилните присъединителни реакции (AN) карбонилният С-атом преминава от sp2 в sp3 хибридно състояние с тетраедрична геометрия, т.е. настъпва изменение на пространствената насоченост на валентните му орбитали. Според молекулно-орбитални изчисления нуклеофилната атака се осъществява под ъгъл приблизително равен на 107° спрямо равнината на карбонилната група. Полученият алкоксиден йон често се нарича тетредричен междинен продукт.
Фиг. 68. Механизъм на нуклеофилни присъединителни реакции при алдехиди и кетони
Алдехидите са по-податливи на нуклеофилна атака в сравнение с кетоните. Това поведение може да се обясни от гледна точка на стеричните и електронни ефекти при алдехидите и кетоните. Кетоните встъпват по-трудно в тези реакции не само поради по-ниската степен на полярност на връзката, но и поради пространствено пречене на двата въглеводородни остатъка.
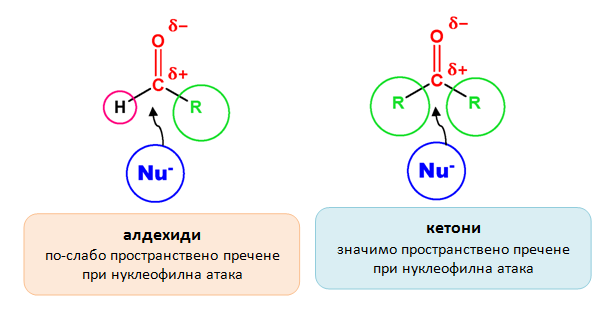
Ароматните алдехиди са по-стабилни, т.е. с по-ниска реактивоспособност по отношение на нуклеофилните присъединителни реакции поради резонансна стабилизация.
Резонансна стабилизация при бензалдехид
Алдехидите се окисляват по-лесно от кетоните, което се използва за експерименталното им разграничаване.Кислородният атом от карбонилната група може да участва в образуването на водородни връзки Тема 4: Междумолекулни сили и връзки. Водородна връзка, т.II.1. Междумолекулна водородна връзка, например с H-атоми от молекулите на водата и алкохолите.
V.1.1. Присъединяване на циановодород (HCN)
Алдехидите и кетоните присъединяват циановодород, в резултат на което се получават цианхидрини(α-хидроксинитрили).
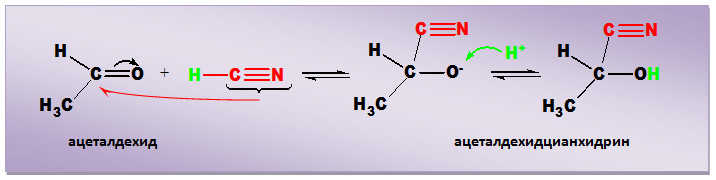
Първият етап (нуклеофилната атака) на образуване на химична връзка между карбонилния С-атом и нуклеофила (цианогрупата) водещ до получаване на тетраедричния междинен продукт (алкоксиден анион), е бавен и скоростоопределящ. Установено е, че този първи етап на реакцията протича значително по-бързо в слабо алкална среда. В присъствието на алкален хидроксид, малко количество от HCN се депротонира до CN- йони, които катализират реакцията. При втория етап (протонен трансфер) полученият анион реагира бързо с Н+, отделен от полярната молекула на HCN, при което се получава реакционния продукт - цианхидрин.

V.1.2. Присъединяване на амоняк (NH3) и производните му
Тези реакции се наричат реакции на присъединяване-елиминиране(AN+E) и протичат по следния механизъм:
Фиг. 69. Механизъм на реакции на присъединяване-елиминиране (AN + E)
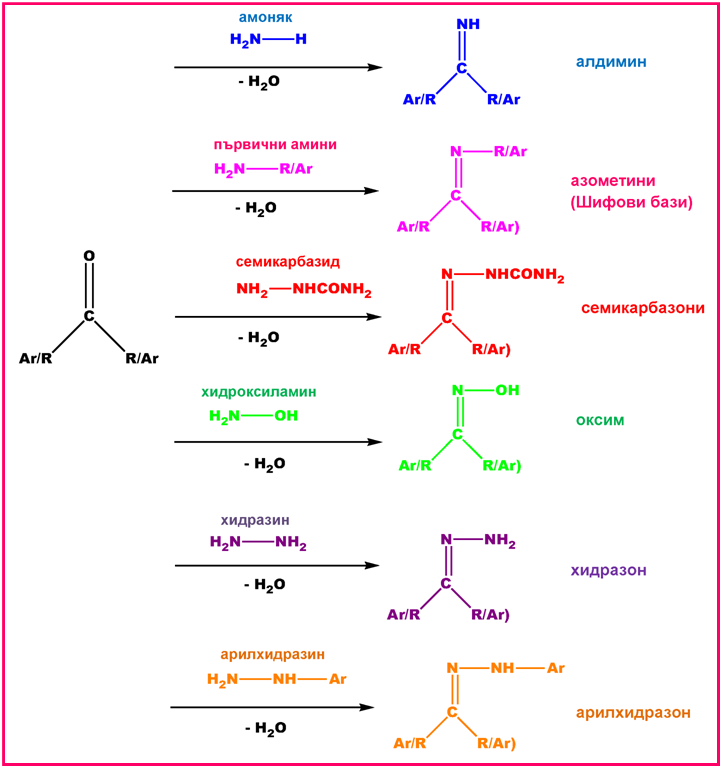
Доказано е, че този тип реакции протичат с най-висока скорост при #pH# 4.5. В алкална среда карбонилната група и карбиноламинът не се протонират и реакцията протича с много ниска скорост. В силно кисела среда по-голямата част от амино-молекулите ще бъдат протонирани, т.е. те няма да бъдат нуклеофили, и процесът на нуклеофилно присъединяване ще се забави.
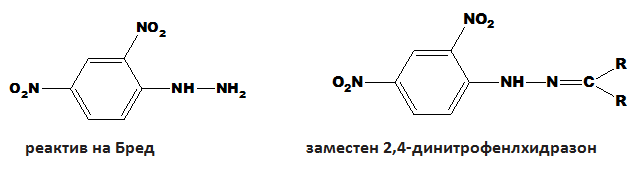
Реакцията на образуване на арилхидразони се използва за качествено идентифициране и характеризиране на алдехиди и кетони. Ако към непознато съединение прибавянето на 2,4-динитрофенилхидразин (реактив на Бред) води до получаването на оранжева или червена утайка от заместен 2,4-динитрофенлхидразон, то анализираното съединение е алдехид или кетон.
V.1.3. Присъединяване на О-нуклеофили (H2O, алкохоли)
- Присъединяване на H2O (хидратация)
При взаимодействие с H2O голяма част от алдехидите се превръщат в хидрати. Под действието на алкални катализатори реакцията протича по следната схема:
Фиг. 70. Механизъм на процеса хидратация на алдехиди под действието на алкални катализатори
Под действието на киселинни катализатори механизмът е следния:
Фиг. 71. Механизъм на процеса хидратация на алдехиди под действието на киселинни катализатори
Поради нестабилността на получените хидрати химичното равновесие е изтеглено в посока на обратната реакция, т.е. към алдехида.
Получаването на кетохидрати, т.е. хидратирането на кетони, се осъществява трудно поради малкия частичен положителен товар при карбонилния С-атом.
- Присъединяване на алкохоли
При взаимодействието на алдехиди с алкохоли (R-OH) в присъствие на киселинен катализатор се получават съединения наречени полуацетали. При тези реакции H-атом от ОН-групата на алкохола се присъединява към карбонилния О-атом, а алкокси групата на алкохола (-OR) - към карбонилния С-атом. Полуацеталите, които по строеж са едновременно етери и алкохоли, са нетрайни съединения. Те се характеризират с висока реактивоспособност, поради което в присъствие на киселина и излишък от алкохол, ОН-групата в молекулата на полуацетала се замества с -ОR група от молекулата на алкохола. Полученият реакционен продукт се нарича ацетал. Ацеталите имат строеж на етери и се характеризират със сравнително по-висока устойчивост.
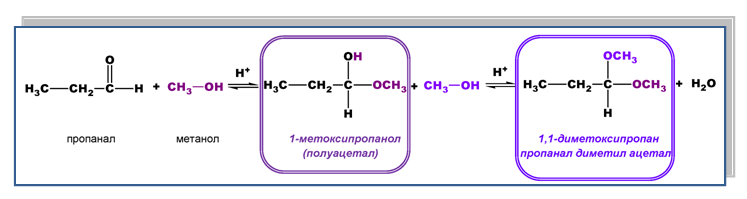
При кетоните тези нуклеофилни присъединителни реакции протичат значително по-трудно.
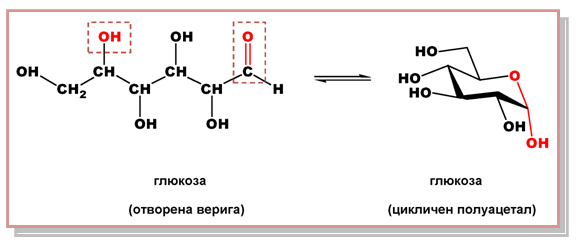
Ацеталите и полуацеталите имат важно значение при изучаване на свойствата и структурата на въглехидратите Тема 18: Въглехидрати. Глюкозата Тема 19: Монозахариди, т. V.1. Хексози, например, съществува предимно под формата на цикличен полуацетал.

V.2. ОКИСЛЕНИЕ (ОКСИДАЦИЯ)
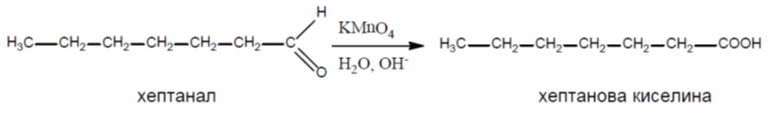
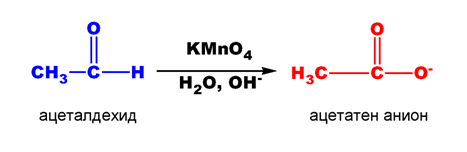
Алдехидите се окисляват лесно под действието на слаби окислители, а понякога дори и от кислорода на въздуха при стайна температура (автоокисление) до карбоксилови киселини Тема 12: Карбоксилови киселини, което създава трудности при синтезирането и съхранението им. Като окислителни агенти биха могли да се използват KMnO4, хромна киселина (H2CrO4), реактив на Толенс и Фелингов разтвор.
- Оксидация с KMnO4 и H2CrO4
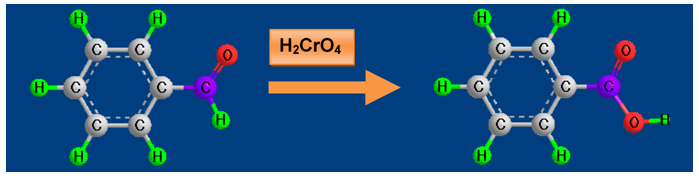
Окислението на бензалдехида до бензоена киселина е пример за превръщането на ароматен алдехид в съответната ароматна карбоксилова киселина.
Най-често използваните лабораторни тестове за качествено разпознаване на алдехидите и кетоните са реактив на Толенс и Фелингов разтвор.
-
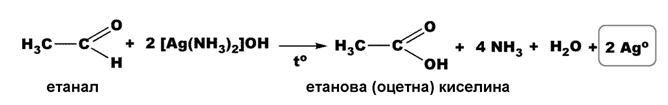
 Тест (реактив) на Толенс - при взаимодействие на алдехид с реактива на Толенс, [Ag(NH3)2]OH (амонячен разтвор на Ag2O), алдехидът се окислява до карбоксилатен анион, а сребърният катион (Ag+) се редуцира до метално сребро (Ago), което се отлага по стените на съда под формата на сребърен налеп. Затова този тест е известен като „реакция на сребърното огледало” за доказване на алдехидна група.
Тест (реактив) на Толенс - при взаимодействие на алдехид с реактива на Толенс, [Ag(NH3)2]OH (амонячен разтвор на Ag2O), алдехидът се окислява до карбоксилатен анион, а сребърният катион (Ag+) се редуцира до метално сребро (Ago), което се отлага по стените на съда под формата на сребърен налеп. Затова този тест е известен като „реакция на сребърното огледало” за доказване на алдехидна група.

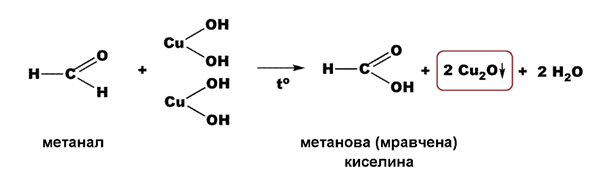
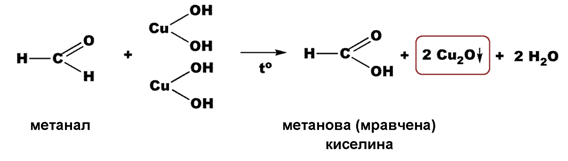
Фелингова проба (прясно утаен Cu(OH)2) - полученият при разтварянето на алдехид алдехидхидрат се дехидрогенира до киселина, а отделящите се водородни атоми редуцират куприйоните (Cu2+) до купройони (Cu+). Наблюдава се образуването на червено-кафява утайка от Cu2O, която при окисление на алифатни алдехиди се редуцира до метална мед, т. нар. „медно огледало”:

|
Тестът на Толенс и Фелинговата проба са реакции характерни само за алдехидите и служат за експерименталното им разпознаване от кетони! |
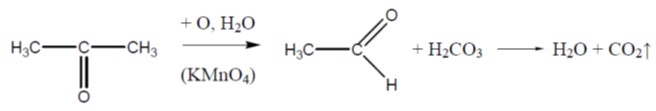
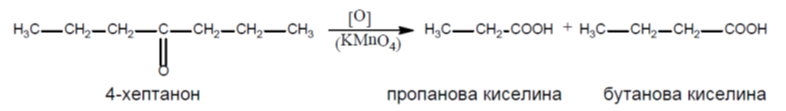
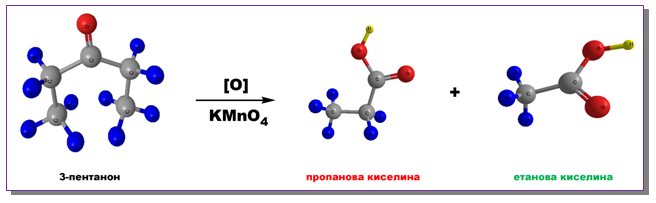
Кетоните се окисляват по-трудно под действието на силни окислители (KMnO4, К2Cr2O7). Процесът е съпроводен с разкъсване на C-C връзка в карбонилната група и получаването на смес от карбоксилови киселини с по-малък брой С-атоми:
V.3. РЕДУКЦИЯ (ХИДРОГЕНИРАНЕ)
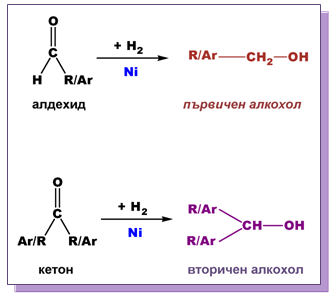
Алдехидите и кетоните се редуцират до съответния алкохол под действието на различни редуциращи агенти.
Хидрогенирането (присъединяване на H2) на карбонилните производни на въглеводородите е един от класическите методи на редукция. Тези процеси протичат в присъствие на катализатор (Ni, Pt или Pd), при високо налягане и понякога при висока температура. В резултат на редукцията алдехидите се превръщат в първични, а кетоните - във вторични наситени алкохоли ( Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т. I.4. Класификация на алкохоли и феноли).
При редукция на ненаситени алдехиди/кетони с помощта на комплексни метални хидриди (LiAlH4, NaBH4) се получават ненаситени алкохоли ( Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т. I.4. Класификация на алкохоли и феноли)..
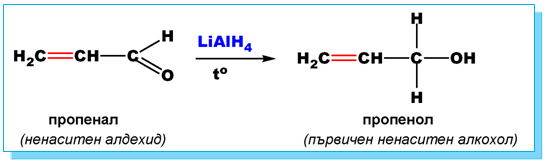
V.4. РЕАКЦИЯ НА КАНИЦАРО
Реакцията на Каницаро, известна още като диспропорциониране или дисмутация, е характерна предимно за ароматни алдехиди и алдехиди, в молекулите на които няма Н-атоми на α-място. Тя се изразява във взаимодействие на две молекули алдехиди и една молекула вода (в силно алкална среда) водещо до получаване на смес от равни моларни количества на съответния алкохол и киселина или нейна сол. Тази реакция на едновременно окисидация и редукция на алдехиди се използва при обяснението на алкохолната ферментация, при изучаването на химичните свойства на органичните съединения, както и при промишленото получаване на различни алкохоли и полиалкохоли ( Тема 10 , I.Определение, хомоложен ред, номенклатура, класификация, т. I.4. Класификация на алкохоли и феноли). Тя има важно значение за биологичните системи, тъй като е свързана с протичането на ензимните процеси и обмяната на веществата в живите организми.
- Реакция на Каницаро с бензалдехид
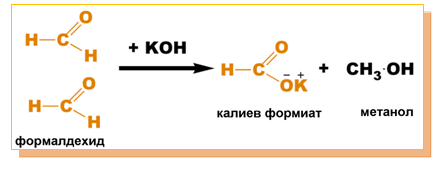
- Реакция на Каницаро с формалдехид
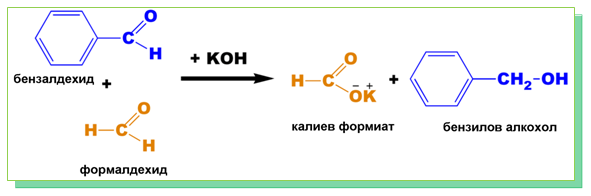
- „Кръстосана” реакция на Каницаро (с формалдехид и безалдехид)
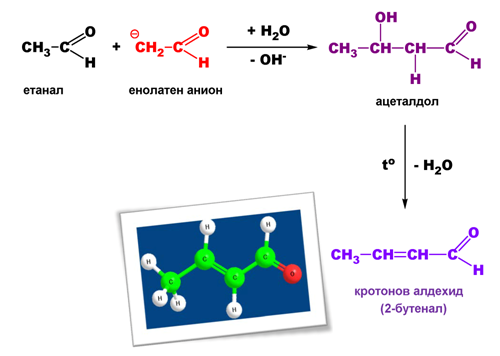
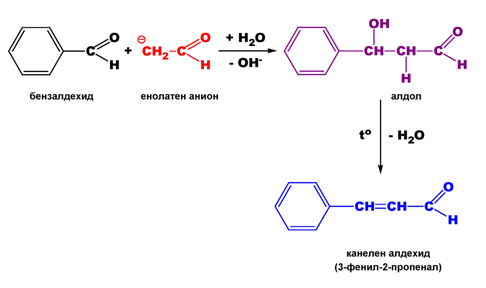
V.5. АЛДОЛНО-КРОТОНОВА КОНДЕНЗАЦИЯ
Взаимодействието между две молекули алдехид, при което се отделя молекула вода, се нарича алдолно-кротонова кондензация. Тя може да протече между молекули на един и същ или на два различни алдехида („кръстосана” кондензация). Задължително условие е единия алдехид да съдържа α-водороден атом.
- Етап на алдолизиране
- Етап на кротонизиране
Алдехидите, съдържащи α-водородни атоми образуват енолатни аниони (нуклеофили) под действието на разредени основи.
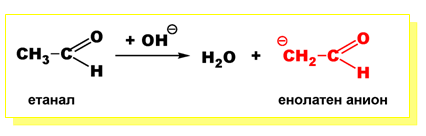
Нуклеофилите (енолатните аниони) се присъединяват към карбонилната група на втората молекула алдехид, при което се получава алдол (β-хидроксиалдехид).
При по-висока температура протича дехидратация (кротонизиране) и се получава алдол (α,β-ненаситен алдехид).
„Кръстосана” алдолно-кротонова кондензация на бензалдехид и ацеталдехид в присъствие на КОН протича по реакция показана на схемата:
При алдолно-кротоновата кондензация става удължаване на въглеводородната верига.
V.6. РЕАКЦИИ НА ПОЛИМЕРИЗАЦИЯ
За алдехидите са характерни полимеризационни реакции, при които се получават полиалдехиди.
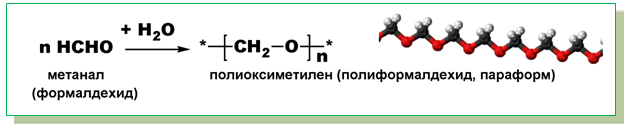
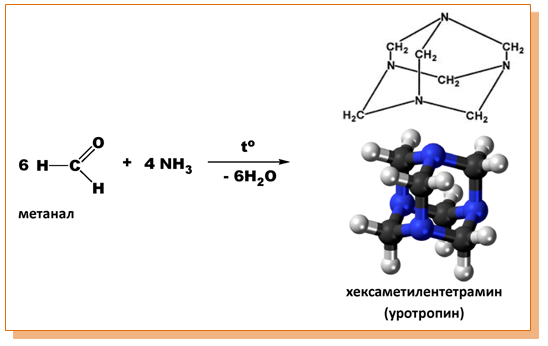
V.7. РЕАКЦИИ, ХАРАКТЕРНИ ЗА ВЪГЛЕВОДОРОДНИЯ ОСТАТЪК
Алдехидите и кетоните реагират с халогенни елементи (Br2, Cl2) като реакциите на халогениране могат да бъдат катализирани, както от киселини, така и от основи.
- халогениране в кисела среда
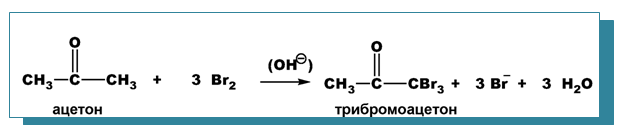
- халогениране в алкална среда
При халогениране в кисела среда се замества един Н-атом в алкиловия радикал и се получават монохалогенопроизводни.
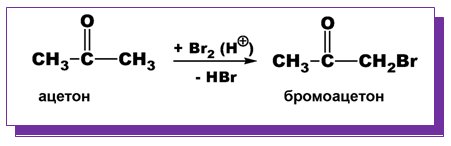
При халогениране в алкална среда се получават трихалогенопроизводни.

|
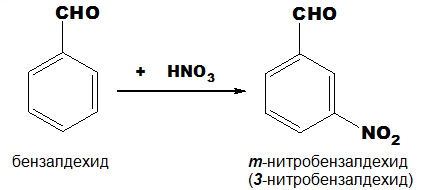
Карбонилната група в ароматните алдехиди и кетони е дезактивиращ m-ориентант!
|
VI. БИОЛОГИЧНО ЗНАЧЕНИЕ НА АЛДЕХИДИ И КЕТОНИ

Алдехидите и кетоните се използват широко в органичния синтез, фармацевтичната промишленост като разтворители, антисептични средства и пр.
В медицинската практика се използва формалдехидът под формата на 40% воден разтвор (формалин) като консервиращо, антисептично и дезинфекциозно средство. Ацетонът намира приложение като разтворител, за получаване на хлороформ, йодоформ, сулфонал и др.
Много ароматни алдехиди и кетони притежават приятна миризма и се използват в козметиката.
Алдехиди, кетони и техни производни се получават в човешкия организъм като междинни метаболити при обмяната на веществата.
- Метанал (формалдехид)
- Етанал (ацеталдехид)
- Пропанон (ацетон, диметилкетон)
- Бензохинон
При стайна температура формалдехидът е безцветен газ с характерна остра, дразнеща миризма. Водният му разтвор (~ 40 %) се нарича формалин. Формалинът има свойството да коагулира белтъчни вещества, използва се за дезинфекция, консервиране на анатомични препарати.Формалдехидът е междинен продукт при окислението (или изгарянето) на метан. Източници на HCHO в околната среда сa горските пожари, автомобилните газове, тютюневия дим. Доказано е наличието на формалдехид и в космоса.
В промишлеността формалдехидът се използва за синтеза на полиалкохоли, които намират приложение при производството на бои, фенол-формалдехидни смоли и взривни вещества. Формалдехидът се използва като дезинфектант и биоцид. Инфекции на пикочните пътища са често се третират с Метенамин - производно на формалдехида. В кисела среда той се превръща в бъбреците във формалдехид, който след това има антибактериален ефект в пикочните пътища. Препаратът не е безопасен за продължителна употреба, поради канцерогенния ефект на формалдехид. Някои кремове, козметика и продукти за лична хигиена също съдържат производни на формалдехид като активни съставки, които предотвратяват растежа на потенциално вредни бактерии.
През 2011 г. Националната токсикологична програма на САЩ описва формалдехидът като "известен канцероген ".
Представлява безцветна течност с характерна миризма и температура на кипене 20,8оС. Той е разтворим във вода, етанол и етер. При окисляването му се получава оцетна киселина, а при редукцията му - етанол. При взаимодействие на две молекули ацеталдехид се получава алдол.
Естествено присъства в зрелите плодове, кафето и пресния хляб и се произвежда от растенията при нормалната обмяна на веществата в тях. В човешкия организъм етаналът се произвежда от етанол в черния дроб. Етанолът се окислява в тази реакция, която се катализира от чернодробния ензим алкохолдехидрогеназа. Полученият етанал е причина за симптомите на махмурлук.
В промишлеността ацеталдехидът се използва като междинен продукт при синтеза на етилацетат, пентаеритритол (използван в производството на синтетични смоли, експлозиви, в лаково-бояджийската промишленост) и пиридини. Намира птиложение в производството на парфюми, полиестерни смоли и основни багрила. Ацеталдехидът се използва като разтворител в каучуковата и хартиената промишленост, като консервант на плодове и риба, като ароматично средство за втвърдяване желатин, като денатурант за алкохол и участва в състава на горивата.
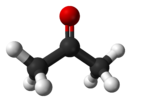
Представлява безцветна, лесно запалима течност с характерна миризма. Той е отличен разтворител за много полярни и неполярни органични вещества. Ацетон се произвежда и в организма чрез декарбоксилиране на „кетонови тела”, образувани в черния дроб. Някои хранителните навици, продължително гладуване, високо съдържание на мазнини, нисковъглехидратна диета и др., могат да доведат до кетози, т.е. повишено съдържание на ацетон телесните тъкани, или до кетоацидоза - неконтролируема кетоза, водеща до увеличаване на киселинността на кръвта. Доказано е, че ацетонът оказва антиконвулсивни ефекти при животини с епилепсия, когато се прилага в милимоларни концентрации.
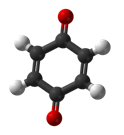
1,4-Бензохинонът е токсичен метаболит в човешката кръв и може да се използва за проследяване на излагането на бензен или смеси, съдържащи бензен и бензенови съединения. Той може да повлияе върху клетъчното дишане, както и да доведе до увреждане на бъбреците при животни. Бензохиноновите съединения са метаболити на парацетамола.
Други биологично значими алдехиди и кетони:
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
диастериомери - в резултат на тавтомерната изомерия възникват два нови изомера, които се различават по конфигурацията на двата неравностойни въглеродни атоми
pH - водороден показател (водороден индекс, водороден експонент) - представлява отрицателен десетичен логаритъм от концентрацията на наличните водородни катиони (H+) в разтвора
катализатор - химично вещество, което променя скоростта на химичните реакции като в края на реакцията остава качествено и количествено непроменено
кето-енолна тавтомерия - структурна изомерия, характерна за алдехиди и кетони, която се изразява в миграция на протон, съпроводена с преместване на двойна връзка
нуклеофил - химически реагент, които предоставя свободна електронна двойка на електрофил, за да се образува химическа връзка или който притежава поне една π-връзка
AN – нуклеофилни присъединителни реакции
AN+E – реакции на присъединяване-елиминиране
химично равновесие - състояние на обратима химична реакция, при което скоростите на правата и на обратната реакция се изравняват
реактив на Толенс - [Ag(NH3)2]OH (амонячен разтвор на Ag2O)
Фелингов разтвор - прясно утаен Cu(OH)2

ВЪПРОСИ И ЗАДАЧИ
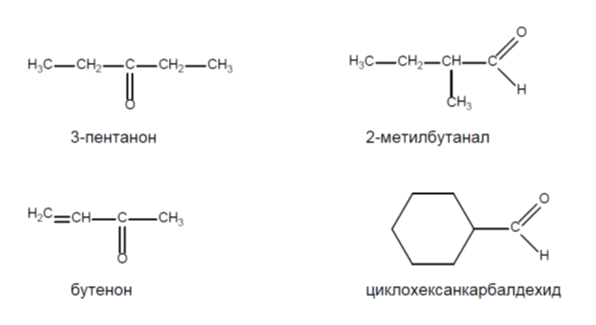
1. Напишете структурните формули на следните алдехиди и кетони:
3-пентанон, 2-метилбутанал, бутенон, циклохексанкарбалдехид
Отговор
2. Коe от посочените твърдения е коректно (възможен е повече от един отговор):
А. Алдехидите се окисляват по-лесно от кетоните.
В. С-атом в карбонилната група е в sp3 хибридно състояние с тригонална равнинна геометрия.
С. Ароматните алдехиди встъпват по-лесно в нуклеофилни присъединителни реакции в сравнение с алифатните.
D. Алдехидите са по-податливи на нуклеофилна атака в сравнение с кетоните.
E. Кислородният атом от карбонилната група може да участва в образуването на H-връзки например с H-атоми от молекулите алкохолите.
Отговор
3.Напишете химичната реакция на взаимодействие на ацеталдехид с H2O. Какъв тип е тази реакция? Как се нарича реакционния продукт.
Отговор
4.Допишете следната химична реакция и посочете наименованията на изходните реагенти и реакционните продукти:
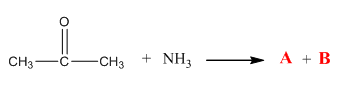
Отговор
5.Предложете подходяща качествена реакция/и за идентифициране на формалдехид и ацетон. Изразете реакцията/ите с химично уравнение/я.
Отговор
6.При какви условия е възможно окислението съответно на 4-хептанон и хептанал? Напишете съответните химични реакции. По какво си приличат и по какво се различават реакционните продукти в двата случая?
Отговор
7.Предложете метод за получаване на 2-бутанол от съответен алдехид или кетон. Напишете химичната реакция.
Отговор
8.При бромиране на ацетон в алкална среда се получава:
А. трибромоацетон
В. реакцията не е възможна
С. бромоацетон
D. дибромоацетон.
Отговор
9.Посочете вярното твърдение:
А. При взаимодействието на две молекули бензалдехид в присъствие на KOH (реакция на Каницаро) реакционният продукт е бензоена киселина.
В. За алдехидите не са характерни полимеризационни реакции.
С. Алдолно-кротонова кондензация е процес на взаимодействие между две молекули карбонилни съединения.
D. Шифовите бази (азометини) са реакционни продукти, получени при взаимодействието на алдехиди/кетони с хидроксиламин.
Отговор
10.Допълнете следните преходи с подходящите реагенти и продукти. Запишете наименованията на всички органични съединения:
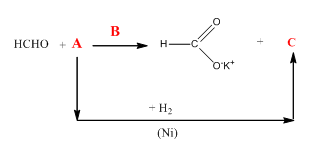
Отговор