АМИНОКАРБОКСИЛОВИ КИСЕЛИНИ
I. ОПРЕДЕЛЕНИЕ, КЛАСИФИКАЦИЯ И НОМЕНКЛАТУРА

I.1. ОПРЕДЕЛЕНИЕ
I.2. КЛАСИФИКАЦИЯ

- В зависимост от вида на въглеводородния остатък аминокиселините се класифицират на алифатни и ароматни.
- В зависимост от броя на функционалните амино- (−NH2) и карбоксилови (−COOH) групи, аминокиселините се класифицират на:
 моноаминомонокарбоксилови киселини, съдържащи една –NH2 и една –СООН групи;
моноаминомонокарбоксилови киселини, съдържащи една –NH2 и една –СООН групи;
 моноаминодикарбоксилови киселини, съдържащи една –NH2 и две –СООН групи;
моноаминодикарбоксилови киселини, съдържащи една –NH2 и две –СООН групи;
 диаминомонокарбоксилови киселини, съдържащи две –NH2 и една –СООН групи;
диаминомонокарбоксилови киселини, съдържащи две –NH2 и една –СООН групи;
 диаминодикарбоксилови киселини, съдържащи две –NH2 и две -СООН групи.
диаминодикарбоксилови киселини, съдържащи две –NH2 и две -СООН групи.
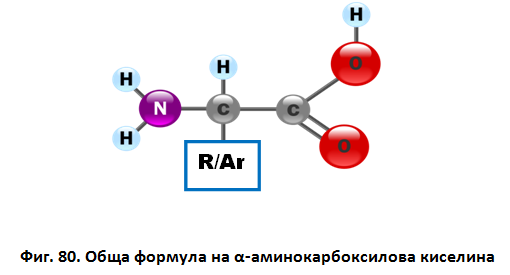
Когато аминогрупата е свързана с въглеродния атом на карбоксиловата група, то аминогрупата се намира в α-позиция и аминокиселините се наричат α-аминокарбоксилови киселини. На фиг. 80 е представена общата формула на α-аминокарбоксилова киселина, където R е алифатен въглеводороден радикал/Ar - ароматен въглеводороден радикал.
Научно е доказано, че като съставна част на протеините в живите организми участват остатъци от около 23 α-аминокиселини, които съдържат и други функционални групи (-S-, -OH). В зависимост от заместителя R, те се класифицират на: аминоалканови, аминохидроксиалканови, сярасъдържащи, хетероциклени аминокиселини.
I.3. НОМЕНКЛАТУРА
Наименованията на аминокарбоксиловите киселини са систематични (по IUPAC) и тривиални, които се използват по-често. Тривиалните наименования са свързани с някои техни специфични свойства или се образуват от наименованието на продуктите, от които произхождат. Например: глицин (от гр. glycos - сладък), тирозин (от гр. tyri - сирене), цистин (от гр. kystis - мехур, изолиран от жлъчни камъни). Според номенклатурата на IUPAC наименованията се образуват от съответната карбоксилова киселина и представката - амино.
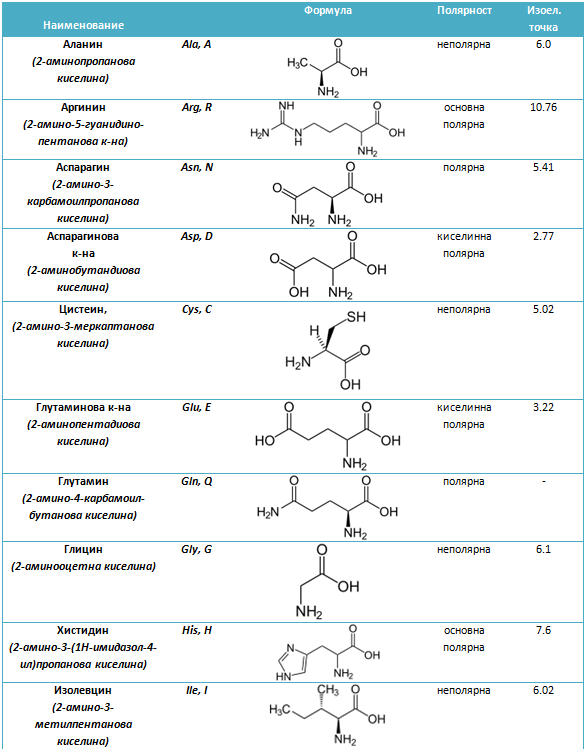
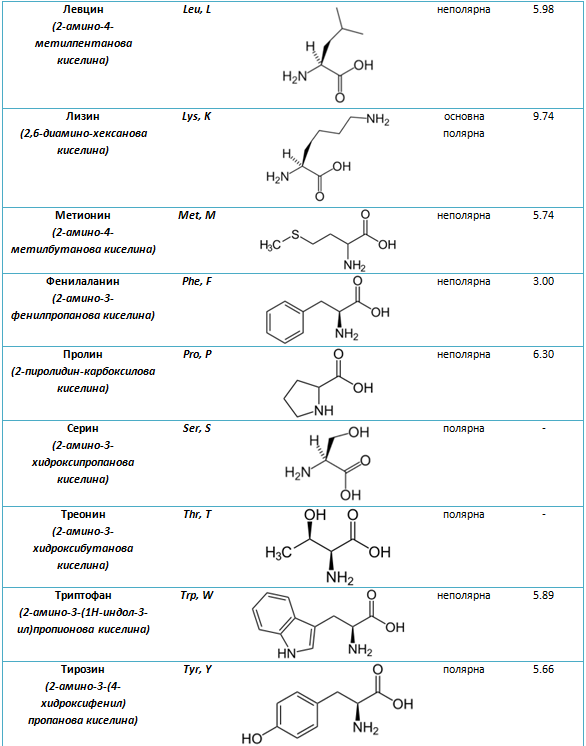
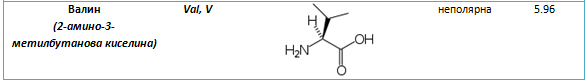
Таблица 12. Номенклатура, химични формули, полярност и изоелектрични точки на някои аминокарбоксилови киселини
II. ИЗОМЕРИЯ

За моноаминомонокарбоксиловите киселини е характерна верижна, позиционна и оптична изомерия.
II.1. ВЕРИЖНА ИЗОМЕРИЯ
В зависимост от вида на въглеводородния остатък R на аминокиселините са възможни верижни изомери, т.н. аминокиселините левцин и изолевцин са верижни изомери.

II.2. ПОЗИЦИОННА ИЗОМЕРИЯ
Различното взаимно разположение на –NH2 и –СООН групите в молекулите на аминокарбоксиловите киселини определя възможността за наличие на позиционна изомерия. Различават се α, β, γ, δ и т.н. позиционни изомери. Например при аминомаслената киселина са възможни три позиционни изомера:
Най-разпространени и с най-голямо биологично значение са α-моноаминомонокарбоксиловите киселини.
II.3. ОПТИЧНА ИЗОМЕРИЯ
При всички аминокиселини, в които въглеводородният остатък е различен от Н-атом е налице асиметричен (хирален) въглероден атом (С*), който определя възможноста за оптична изомерия. Следователно всички аминокарбоксилови киселини с изключение на глицина образуват по два енантиомера и рацемична смес. Когато NH2-групата в проекцията е разположена отляво на С* изомерът е с L-конфигурация и се обозначава като L-аминокиселина , а когато NH2-групата е разположена отдясно на С* изомерът е с D-конфигурация и се обозначава като D-аминокиселина. D- и L-аминокиселинте са енантиомери. На следващата фигура са представени оптичните изомери на аминокиселината аланин:
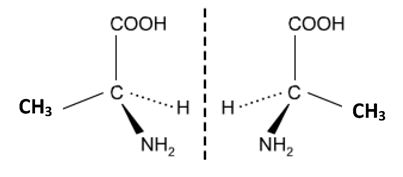
Биологично значимите природни α-аминокиселини са с L-конфигурация. Аминокиселини с D-конфигурация се среща само в клетъчните стени на някои бактерии, в молекулите на някои антибиотици и в протеините на някои злокачествени тумори.
III. MОЛЕКУЛЕН СТРОЕЖ

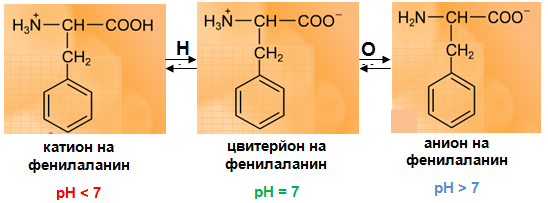
Наличието в молекулата на аминокиселините на две функционални групи с противоположни химични свойства, определя възможността при тях да протича вътрешномолекулно взаимодействие с образуване на вътрешно йонна солеобразна структура, наречена цвитерйон (бетаинова структура, фиг. 81), която е характерна и за други съединения.
Бетаиновата вътрешно йонна солеобразна структура на аминокиселините е биполярна и има амфотерен характер.
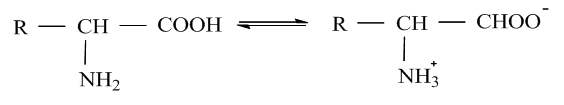
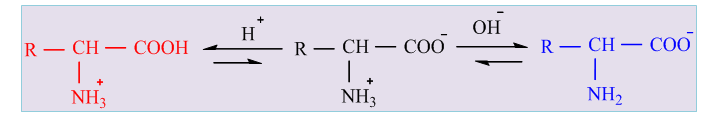
Във воден разтвор в зависимост от стойностите на pH на средата се потиска дисоциацията на –COOH или на –NH2. Поради това аминокиселините проявяват киселинни или основни свойства и разтворимостта им във вода зависи от pH на средата.
- В основна среда (излишък на ОН-) равновесието се изтегля на дясно. Цвитерйоните се превръщат в аниони и между отделните йони се създават сили на отблъскване поради еднаквия им заряд, в резултат на което разтворимостта на аминокиселините нараства.
- В кисела среда (излишък на Н+) дисоциацията на –СООН се потиска. Равновесието се изтегля на ляво. Цвитерйоните се превръщат в катиони на амониеви соли и между отделните йони се създават сили на отблъскване поради еднаквия им заряд, в резултат на което разтворимостта на аминокиселините във вода нараства.
- В неутрална среда повечето α-аминокиселини съществуват във воден разтвор под формата на цвитерйони, което създава условия за наличие на значими сили на привличане между разноименни заряди и обяснява ниската разтворимост на аминокиселините при тези условия.

|
Стойността на pH, при която йонизираната форма на аминокиселината (бетаинова структура) притежава нулев сумарен заряд и не се движи под влияние на електрично поле се нарича изоелектрична точка(pHi). |
В изоектричната точка аминокиселината е слаборазтворима, нестабилна и лесно се утаява.Регулирането на pH на разтворите на аминокиселини до стойността на изоелектричната точка обикновено води до утаяването им. Тази методика намира приложение в органичния синтез с цел разделянето на различни аминокиселини от разтвор.
Фиг. 82. Крива на разтворимостта на фенилаланин във вода като функция от pH на разтвора
Диаминомонокарбоксиловите и моноаминодикарбоксиловите киселини също образуват вътрешни соли, но поради наличието на втора −NH2 или −COOH група запазват основна или кисела реакция, респективно. Диаминомонокарбоксиловите киселини по основния си характер са близки до амоняка, докато моноаминодикарбоксиловите имат по-висока киселинност от оцетната киселина.
IV. ФИЗИЧНИ СВОЙСТВА


Алфа-аминокиселините са безцветни кристални вещества. Структурата им наподобява йонна кристална решетка, в която диполите (цвитерйоните) са свързани помежду си чрез много силни електростатични връзки.
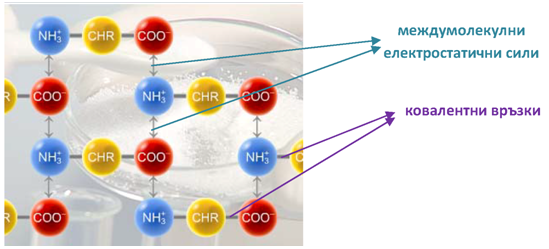
Тези междумолекулни сили са толкова здрави, че при повишаване на температурата разкъсването на ковалентните връзки ( Тема 3: Видове химични връзки в неорганичните и органични съединения, т.I. Ковалентна връзка) в самите диполи става преди разкъсването на връзките между молекулите. Затова при Т > 250оС се наблюдава по-скоро разграждане, отколкото топене на аминокиселините.
L-изомерите на повечето аминокиселини имат горчив вкус, докато D-изомерите са сладки.
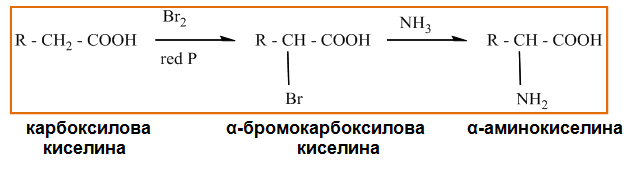
V. МЕТОДИ ЗА ПОЛУЧАВАНЕ

В природата аминокиселините се синтезират от живите организми. В лабораторни и промишлени условия също е възможен техния синтез. Има много начини за синтез на аминокиселини, някои от тях са по-общи други са по-специфични за определени аминокиселини. Два от най-общите методи са:
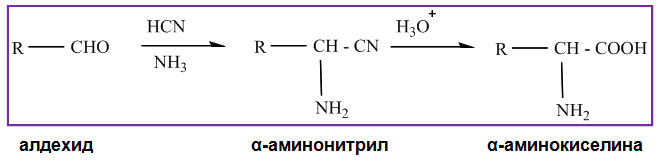
- Метод на Штрекер (цианхидринов синтез) - при взаимодействие на алдехиди с амоняк и циановодород се получават α-аминонитрили, които се хидролизират с разреден разтвор на киселина до α-аминокиселини.
- Вторият метод се състои в бромиране на карбоксилова киселина и следваща обработка на α-бромокиселината с излишък от амоняк.
VI. ХИМИЧНИ СВОЙСТВА

Химичните свойства на аминокарбоксиловите киселини се определят от двете функционални групи (амино и карбоксилова). Поради това те участват в реакции, характерни за амините и карбоксиловите киселини ( Тема 13: Монокарбоксилови киселини, т. V. Химични свойства), както и в реакции обуславящи се от взаимното влияние на двете функционални групи.
VI.1. РЕАКЦИИ ХАРАКТЕРНИ ЗА −NH2 ГРУПАТА
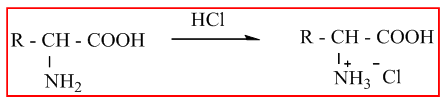
- Взаимодействие с киселини
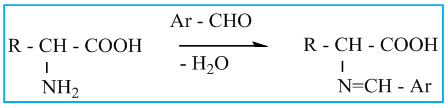
- Взаимодействие с ароматни алдехиди
При взаимодействие на аминокиселини със солна киселина се получават аминосоли
При взаимодействие на аминокиселини с HNO2 (азотиста киселина) реакционните продуктите, които се получават са хидроксикиселини.
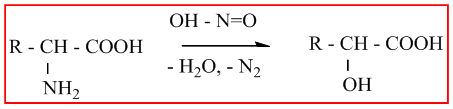
При взаимодействие на аминокиселини с ароматни алдехиди се получават Шифови бази (азометини). Образуването на Шифови бази е установено в редица случаи на биотрансформация на аминокиселините.
VI. 2. РЕАКЦИИ ХАРАКТЕРНИ ЗА −COOH ГРУПАТА
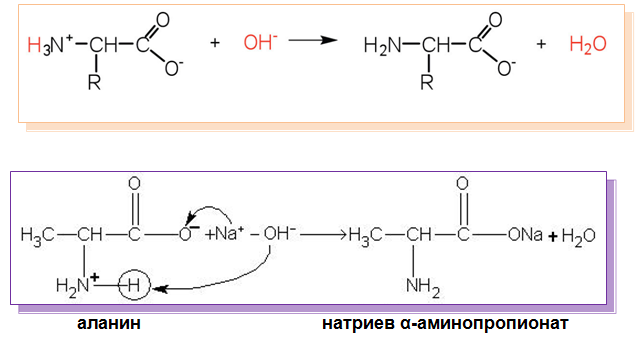
- Взаимодействие с основи
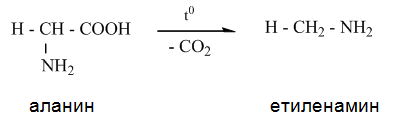
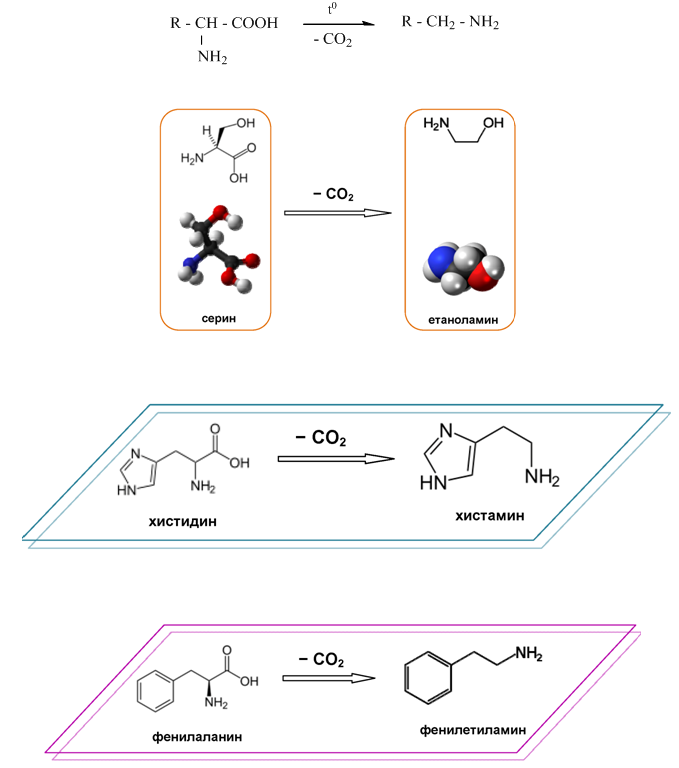
- При нагряване на една молекула α-аминокиселина тя се декарбоксилира като се превръща в амин. Декарбоксилирането на α-аминокиселините е етап при разграждането на белтъчните вещества в хода на разлагането на материята (гниенето).
В резултат на взаимодействието на аминокиселините с основи се получават соли като продукти на реакцията.
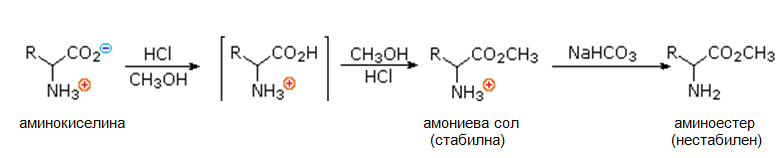
При взаимодействие на аминокиселини с алкохол в кисела среда карбоксиловата група се естерифицира. Обикновено естерификацията на аминокиселините се осъществява в кисела среда. Първият продукт, който се получава е стабилна амониева сол. На следващия етап се получава крайния реакционен продукт на естерификацията – нестабилен аминоестер.
VI.3. РЕАКЦИИ, ХАРАКТЕРНИ ЗА ДВЕТЕ ФУНКЦИОНАЛНИ ГРУПИ ЕДНОВРЕМЕННО
- При нагряване на две молекули α-аминокиселини протича процес на междумолекулно обезводняване, при което се получават шестатомни стабилни пръстенни системи (циклични амиди) – дикетопиперазини.
- При нагряване на β-аминокиселини се наблюдава вътрешномолекулно отделяне на амоняк (#дезаминиране#) и образуване на α,β-ненаситени карбоксилови киселини.
- При нагряване γ- и δ-аминокиселините протича вътрешномолекулно обезводняване, в резултат на което се получават стабилни пет- и шестатомни пръстенни съединения - лактами.
VI.4. ПЕПТИДНА И МЕЖДУМОЛЕКУЛНА ВОДОРОДНА ВРЪЗКИ ПРИ АМИНОКИСЕЛИНИ
- Пептидната връзка е характерна за пептидите и се получава в резултат на взаимодействие на две или повече молекули α-аминокиселини, в резултат на кондензация между −NH2 групата на едната аминокиселина и −COOH групата на другата аминокиселина:
- Междумолекулни водородни връзки
Фиг. 83. Получаване на дипептид
Първичната структура на белтъците се поддържа от ковалентни пептидни връзки. В белтъците полипептидните вериги не са изправени. Отделни участъци от полипептидната верига са нагънати равномерно във вид на спирала или зигзагообразно.
При α-спиралата възникват слаби водородни връзки ( Тема 4: Междумолекулни сили и връзки. Водородна връзка, т. II.1. Междумолекулна водородна връзка) между отделните участъци на спиралата.
При втория начина на нагъване (β-структура или β-нагънат лист) отделни участъци от полипептидната верига са разположени успоредно и са свързани помежду си с водородни връзки. Образува се структура, която прилича на нагънат лист хартия. Водородни връзки се образуват през три аминокиселинни остатъка и между два съседни участъка на една верига, както и между две съседни вериги. Такава структура може да възникне не само между участъци на една и съща верига, но и между две или повече отделни полипептидни вериги (фиг. 84)
Фиг. 84. Първична и вторична полипептидна структура.
VII. БИОЛОГИЧНО ЗНАЧЕНИЕ НА АМИНОКИСЕЛИНИТЕ

Броят на α-аминокиселините съдържащи се в белтъците на човешкото тяло е 22. Една част от тях се синтезират в организмите и се наричат заменими аминокиселини, но останалата част се набавят чрез храната отвън и се наричат незаменими (есенциални*) аминокиселини.
Значението на α-аминокиселините може да се систематизира в три основни направления:
VII.1. Азотен обмен на организмите
Като съставна част на полипептидите, белтъчините, ензимите и други биологично активни съединения, α-аминокиселините заемат централно място в азотния обмен на организмите. Във връзка с това от особено значение е тяхното приложение при храненето на хората и животните. Следва да се има предвид, че потребността от аминокиселините, внасяни с храната зависи от видовете и породи животни или от възраста на животните от една и съща порода. Така например при преживните животни микрофлората на търбуха синтезира всички необходими аминокиселини от NH3 , отделян от белтъка на растенията или от небелтъчни съединения като карбамид. При младите животни с недоразвит още търбух трябва да се добавя с храната определено количество от съответните аминокиселини. При други животни като свине и птици трябва задължително да приемат с храната си незаменими аминокиселини.
VII.2. Буферни системи в организмите
Поради амфотерния си характер аминокиселините имат способността да свързват отделяните при обменните процеси Н+ и ОН- йони и по такъв начин да поддържат постоянно pH.
VII.3. Антитоксично действие
Посредством аминокиселините се отстраняват редица вредни продукти, получени при обмяната на веществата.
В организма на влечуги и птици бензоената киселина се детоксифицира чрез орнитин, а в организма на членестоногите чрез аргинин.
VII.4. Биологично значение на незаменимите (есенциални) аминокиселини
- Изолевцин - HO2CCH(NH2)CH(CH3)CH2CH3
- Левцин - HO2CCH(NH2)CH2CH(CH3)2
- Лизин - HO2CCH(NH2)(CH2)4NH2
- Метионин - HO2CCH(NH2)CH2CH2SCH3
- Фенилаланин - HO2CCH(NH2)CH2C6H5
- Треонин - HO2CCH(NH2)CH(OH)CH3
- Триптофан - C11H12N2O2
- Валин - HO2CCH(NH2)CH(CH3)2
- Хистидин - C6H9N3O2
- Аргинин - C6 H14N4O2

Изолевцинът е незаменима α-аминокиселина. Тя е била открита от немския химик Феликс Ерлих в хемоглобина през 1903 г. Тя е едновременно глюкогенна и кетогенна аминокиселина. След трансаминиране с алфа-кетоглутарат въглеродния скелет може да се преобразува в сукцинил-КоА или да се включи в цикъла на Кребс за окисление или превръщане в оксалоацетат, участващ в глюконеогенезата (оттук глюкогеннен). Също така изолевцинът може да бъде превърнат в ацетил-КоА и включен в цикъла на Кребс чрез кондезиране с оксалоацетат до образуване на цитрат. При бозайниците ацетил-КоА не може да бъде превърнат обратно до въглехидрат, но може да бъде използван в синтезата на кетонни тела или мастни киселини (оттук кетогеннен). Въпреки че тази аминокиселина не се продуцира от животните, тя се съхранява в големи количества. Храни съдържащи високо количество изолевцин са яйцата, соевия протеин, водораслите, пуешкото, пилешкото и агнешкото месо, сиренето и рибата.

Левцинът е алифатна незаменима аминокиселина. Той влиза в състава на всички природни белтъци. Прилага се при лечение на чернодробни заболявания, анемии и други. Използва се също от спортисти като хранителна добавка при високи натоварвания, предимно във фитнеса и бодибилдинга.
Множество препарати съдържат ливцин синтезиран по биохимичен път. Към природните източници на левцина спадат кафявия ориз, боба и различни видове ядки.
Лизинът е незаменима α-аминокиселина. Той влиза в състава на практически всички белтъци и е необходим за растежа, възстановяването на тъканите, производството на антитела, хормони, ферменти и албумини. Лизинът има противовирусно действие, особено по отношение вируси, предизвикващи херпес и остри респираторни инфекции. При вирусни заболявания се препоръчва се съчетаването на лизин с витамин C и биофлавоноиди. Участва в синтеза на колагена и възстановяването на тъканите. Прилага се по време на регенеративния период след операции и спортни травми. Лизинът подобрява усвояването на калция от кръвта и транспорта му в костната тъкан, поради което може да бъде неотменна част от програмите за лечение и профилактикса на остеопороза. Недостигът на лизин се отразява неблагоприятно върху белтъчния синтез, което води до лесна уморяемост, слабост, лош апетит, забавен растеж и намаляване на телесната маса, неспособност за концентрация, раздразнителност, кровоизливи в очната яблълка, косопад, анемии и проблеми в репродуктивната сфера. Синтетичен лизин се използва за обогатяване на фуражи и хранителни продукти а също и като хранителна добавка при спортни натоварвания, в частност фитнес и бодибилдинг. Източници на лизин са високопротеиновите храни - яйца, червено месо, агнешко месо, пилешко месо, соя, сирене Пармезан, сардини.
Метионинът е неполярна незаменима α-аминокиселина. Изпълнява главна роля в процесите на репродукция, клетъчното оцеляване, метилирането на протеините и на ДНК. Метионинът заедно с цистеина са единствените две аминокиселини съдържащи серен атом. Метионинът има важно значение за биосинтеза на протеините, защото почти всички полипептидни вериги започват с включване на метионин в N-края си. Тази аминокиселина също се използва от растенията и за синтезиране на важен за тяхното развитие фитохормон. Този процес е известен като цикъл на Янг или цикъл на метионина.
Друго приложение на метионина е като антидот при предозиране с парацетамол: 100 mg метионин/500 mg парацетамол. Високо съдържание на метионин ima в яйцата, сусама, рибата, различни видове меса, почти всички зърнени храни в различни количества и съотношения с други аминокиселини. Повечето плодове и зеленчуци са бедни на метионин, както и повечето бобови растения. Широко използвана комбинация от растителни източници осигуряващи протеиновите нужди е съчетаването на зърнени (метионин) с бобови (лизин) храни.

Фенилаланинът е незаменима аминокиселина, срещаща се в почти всички храни като съставна част от белтъците. Поради наличието на бензилов радикал, фенилаланина се причислява към неполярните аминокиселини, когато участва в изграждането на полипептидна верига. Чистият фенилаланин представлява бял прах. L-Фeнилаланинът е електрически неутрална аминокиселина, една от двадесетте аминокиселини, които се кодират от молекулите на ДНК. Действието на фенилаланина е стимулантно и антидепресантно. Той подобрява мозъчната дейност и паметта (а според някои - и сексуалната активност), а намалява апетита и нуждата от сън. Природен източник на фенилаланина е кафявия ориз.

Треонинът е последната от 20-те протеиногенни аминокислеини, открита през 30-те години на 20 век от Уилям Къминг Роуз. Треонин е полярна незаменима α-аминокиселина. Треонинът заедно със серина са единствените две аминокиселини съдържащи алкохолна група. Също така тя е и една от двете протеиногенни аминокиселини, притежаващи хирална странична верига, другата от които е изолевцин. Храни богати на треонин са сиренето, птичето месо, рибата, червено месо, леща и др.

Триптофанът е незаменима α-аминокиселина. Съдържа се предимно в шоколада, овеса, сушените фурми, млякото, сиренето, червеното месо, яйцата, рибата, пилешкото месо, сусама, слънчогледовите семена, тиквените семки, бананите и фъстъците.

L-Валинът е протеиногенна неполярна незаменима аминокиселина. Хранителни източници на валин са сиренето, рибата, птичето месо, фъстъците, сусама и лещата. Заедно с левцин и изолевцин, валинът принадлежи към групата на т.нар. разклонено-верижни аминокиселини. Името му произлиза от лечебното растение валериана (дилянка).
Хистидинът e α-аминокиселина с имидазолова функционална група. Тя е една от 20-те протеиногенни аминокиселини. Хистидинът е изолиран за първи път от германския лекар Албрехт Косел през 1896 г. Хистидинът е незаменима аминокиселина, както за хората, така и за други бозайници. Първоначално се е смятало, че е незаменима единствено за новородените, но по продължителни проучвания доказват нейната необходимост и за възрастните. Имидазоловата странична верига е често срещан координационен лиганд в различни металопротеини, както и в каталитичните центрове на някои ензими.
Аминокиселината е прекурсор за биосинтезата на хистамин и карнозин.
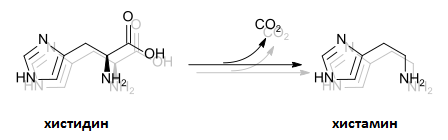
Ензимът хистидиназа трансформира хистидина в амоняк и уроканова киселина. Липсата на този ензим се среща при рядкото метаболитно заболяване хистидинемия. В актинобактериите и филаментозните гъби, като Neurospora crassa, хистидин може да се превърне в антиоксидантът ерготионеин.
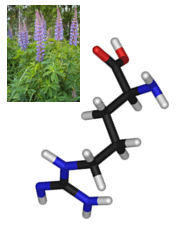
L-Аргининът е една от двадесетте най-често срещани в природата аминокиселини. За бозайниците тя е полунезаменима или условно незаменима в зависимост от етапа на развитие и здравословното състояние на индивида (при новородени тя е незаменима). Швейцарският химик Ернст Шулце изолира аргинин за първи път през 1886 г. от растение от рода Lupinus. Аргининът е алифатна аминокиселина, която в организма съществува в свободно състояние или влиза в състава на много белтъци, силно застъпена е при протамините (нискомолекулни ядрени белтъци, които заместват хистоните в късните етапи на сперматогенезата) и хистоните. Аргининът допринася за ускорената синтеза на соматотропен хормон и на други хормони. Участва в образуването на урина и в обмяната на азота. Аргининът е донор и естествен преносител на азот. Той притежава и психотропни ефекти, като способства за подобряване на настроението, активността и половата функция.
Източниците на аргинин са животински и растителни (сирене, мляко, телешко и свинско месо, бяло пилешко и пуешко месо, различни видове риба и морски деликатеси, бобови и житни растения, ядки, соя, нахут, слънчогледови, тиквени семки, сусам др.). Аргининът играе ключова роля при клетъчното делене. Редуцира времето за заздравяване на рани и е особено важен при фрактури на костите. Ускорява изхвърлянето на токсичния амоняк от организма. Подобрява имунната функция. Стимулира синтеза на растежни хормони. Стимулира натрупването на мускулна маса. Потиска натрупването на мазнини и намалява риска от сърдечни заболявания и подпомага понижаването на кръвното налягане.
VII.5. Биологично значение на някои заменими (неесенциални) аминокиселини
- Аланин - CH3CH(NH2)COOH
- Аспаргин - C4H8N2O3
- Цистеин - C3H7NO2S
- Глутаминова киселина - C5H9NO4
- Серин - HО2CCH(NH2)CH2OH
- Тирозин - C9H11NO3
α-Аланинът влиза в състава на много белтъци, а β-аланинът — в състава на редица биологически активни съединения. В черния дроб аланинът лесно се преобразува в глюкоза и обратно. Този процес се нарича глюкозо-аланинов цикъл и представлява един от основните механизми за биохимичен синтез на глюкоза в организма. Хранителни източници на аланин са: месо, морските храни, млечните продукти, яйцата, желатина, боба, кафявия ориз и др.
Аспаргинът не е незаменима аминокиселина. Реакцията между аспаргин и редуциращ въглехидрат води до синтеза на акриламид (невротоксин и канцероген) при термичната обработка на храната, особено при пържене над 140-150 С. Аспаргинът може да бъде синтезиран от наличните метаболитни субстрати в човешкото тяло и не е задължително да се приема с храната. Среща се в: млечни продукти, месо, птици, яйца, риба, морски дарове, аспарагус, картофи, бобови, ядки, семена, соя. За нормалната си функция нервната система се нуждае от аспаргин. Той играе важна роля и за синтеза на неорганичен амоний.

Цистеинът е алифатна S-съдържаща аминокиселина. L-цистеинът е част от протеините и пептидите, които играят важна роля в образуването на кожната тъкан. Той подпомага образуването на колаген и подобрява еластичността и текстурата на кожата. Цистеинът е един от най-мощните антиоксиданти, а антиоксидантното му действие се усилва при едновременен прием на витамин С и селен. Той противодейства на токсичните ефекти на ацеталдехида, който е основният продукт на алкохолния метаболизъм, и е отговорен за повечето от негативни последствия и дълготрайно увреждане, свързано с употребата на алкохол. Тази аминокиселина подпомага превръщането на ацеталдехида до значително по-безвредната оцетна киселина. Цистеинът е есенциална аминокиселина за овцете, която способства получаването на вълна.
Глутаминовата киселина е неесенциална. Карбоксилатният ѝ анион, както и нейните соли се наричат глутамати. В невробиологията глутаматът е важен невротрансмитер, играещ ключова роля в дълговременна потенциация и процесите на обучение и памет. Глутаминовата киселина е условно незаменима аминокиселина. Глутаматът се използва като вкусов подобрител. Глутаминовата киселина се съдържа в различните видове месо, яйца, риба и млечни продукти.
Серинът е една от протеиногенните аминокиселини. Поради наличието на хидроксилна група, той се класифицира като полярна аминокиселина. Първоначално е получена от копринен протеин, особенно богат източник през 1865 г. Името произлиза от латинското наименование на коприната sericum. Серинът изпълнява важна роля в каталитичната функция на много ензими.
Тирозинът е една от 20-те протеиногенни аминокиселини. Тя е заменима аминокиселина с полярна група в страничната верига. Названието "тирозин" произлиза от гръцката дума tyri, означаваща сирене, и дадено на аминокиселината от германския химик Юстус фон Либих през 1846 г. след откриването й в протеина казеин, съдържащ се в сиренето, както и във всички млечни продукти. Тирозинът има също важна роля в процеса фотосинтеза. В хлоропластите действа като донор на електрони при редукцията на окисления хлорофил. Въпреки че е заменима аминокиселина, той се среща в много високопротеинни хранителни продукти: соя, пилешко месо, пуешко месо, риба, фъстъци, бадеми, авокадо, мляко, сирене, кисело мляко, тиквени семки, сусамово семе, банани и др.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
азометини – Шифови бази
изоелектрична точка (pHi) - стойността на pH, при която йонизираната форма на аминокиселината (бетаинова структура) притежава нулев сумарен заряд и не се движи под влияние на електрично поле.
карбамид (урея, диамид, карбонилдиамид) - органично съединение, което се отделя чрез урината като краен продукт на обмяната на веществата при много животни в резултат на разграждането на азотни съединения (напр. аминокиселини). Чистият карбамид е бяло кристално твърдо вещество със слаб мирис на амоняк: 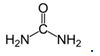
метод на Штрекер - метод за получаване на аминокиселини чрез взаимодействие на алдехиди с амоняк и циановодород, при което се получават α-аминонитрили, които се хидролизират с разреден разтвор на киселина до α-аминокиселини
цвитерйон (хибриден йон, вътрешна сол, бетаинова структура) - неутрална амфотерна молекула с един положителен и един отрицателен електрически заряд в различните части на молекулата
пептидната връзка – получава се в резултат на взаимодействие на две или повече молекули α-аминокиселини, в резултат на кондензация между −NH2 групата на едната аминокиселина и −COOH групата на другата аминокиселина
заменими аминокиселини – аминокиселини, които се синтезират в организма
незаменими (есенциални) аминокиселини – аминокиселини, които не се синтезират в организма
дезаминиране - вътрешномолекулно отделяне на амоняк

ВЪПРОСИ И ЗАДАЧИ
1. Разтворимостта на аминокиселините във вода е най-ниска в:
А. кисела среда
B. алкална среда
C. неутрална среда
D. в изоелектричната точка.
Отговор
2. Защо при нагряване на аминокиселините при Т > 250оС те започват да се разлагат, преди да се топят?
Отговор
3. Допълнете прехода:
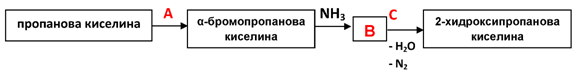
Отговор
4. Какъв е реакционният продукт, който се получава при нагряване на аланин? Напишете химичната реакция.
Отговор
5. Посочете кое от твърденията е невярно:
А. Първичната структура на белтъците се поддържа от ковалентни пептидни връзки.
B. При α-спиралата на вторичната белтъчна структура възникват слаби водородни връзки между отделните участъци на спиралата.
C. При β-вторичната структура отделни участъци от полипептидната верига са разположени успоредно и са свързани помежду си само с пептидни връзки.
D. Водородни връзки се образуват не само между различни участъци на една и съща полипептидна верига, но и между две или повече отделни полипептидни вериги.
Отговор
6. В молекулите на аминокиселините функционалните групи могат да бъдат:
А. само -NH2 и -COOH;
B. само -NH2 и -OH;
C. само -COOH и -OH;
D. само -S, -NH2 и -COOH;
Е. задължително -NH2 и -COOH, но може и -S, -ОH и др.
Отговор
7. Неполярни аминокиселини са:
А. аланин, серин и глицин
B. глицин, фенилаланин и лизин
C. левцин, хистидин и глутаминова киселина
D. цистеин, изолевцин и триптофан
Отговор
8. Аминокиселините участват в химични реакции, характерни за:
А. алкохоли и карбоксилови киселини
B. карбоксилови киселини и амини
C. алдехиди и амини
D. нито едно от посочените.
Отговор
9. При какви условия протича естерификацията на аминокиселините и кои са междинните и крайни продукти?
Отговор
10. При коя/и от посочените аминокиселини не е възможна оптична изомерия. Обосновете отговора си.
А. Валин
В. Глицин
С. Левцин
D. Изолевцин.
Отговор