Монозахариди
I.ОПРЕДЕЛЕНИЕ , класификация

I.1. Определение
Монозахаридите могат да се разглеждат като съединения, получени от поливалентни алкохоли чрез оксидация на една първична или вторична хидроксилна група до алдехидна или кето група.

I.2. Класификация според вида на основните функционални групи
Според вида на карбонилната група монозахаридите се класифицират на:
- Полихидроксиалдехиди (алдози) – монозахариди съдържащи в молекулата си алдехидна група.
- Най-известните алдози, които имат важно биохимично значение за живите организми, са глюкоза, рибоза и дезоксирибоза.
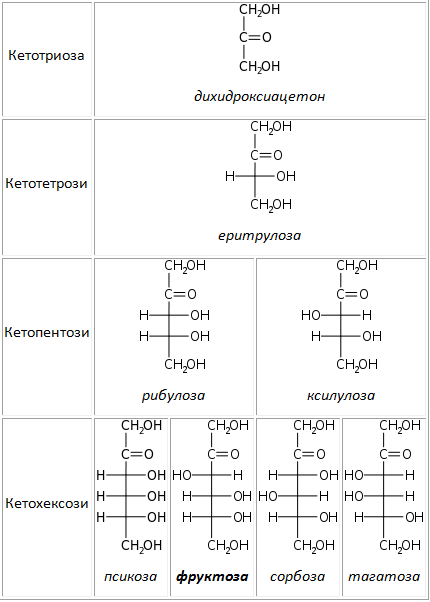
- – монозахариди съдържащи в молекулата си кето група. Към групата на кетозите се отнася фруктозата.
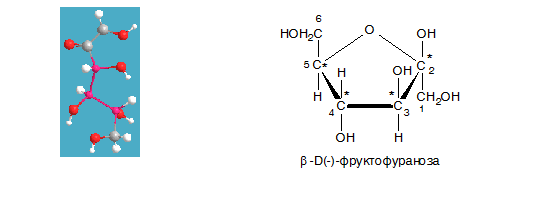
I.3. Класификация според броя на С-атоми
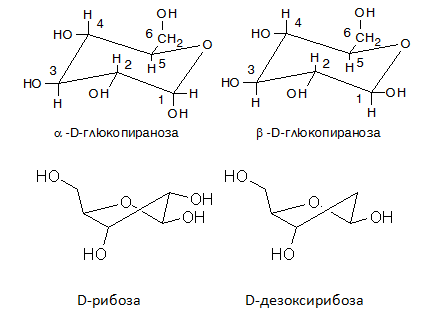
Според броя на С-атоми в молекулата на монозахаридите те се класифицират на: триози, тетрози, пентози, хексози и др. Карбонилната група се означава с представката алдо- или кето- при образуване на комбинираните им названия – напр. алдопентоза, алдохексоза или кетопентоза, кетохексоза. В природата се срещат предимно алдо- и кето- пентози и хексози. Важно биологично значение от класа на пентозите имат рибозата и дезоксирибозата (влизащи в състава на нуклеиновите киселини), а от хексозите – фруктозата и глюкозата. Най-разпространени в природата са глюкозата и фруктозата.
Таблица 14. D-АЛДОЗИ
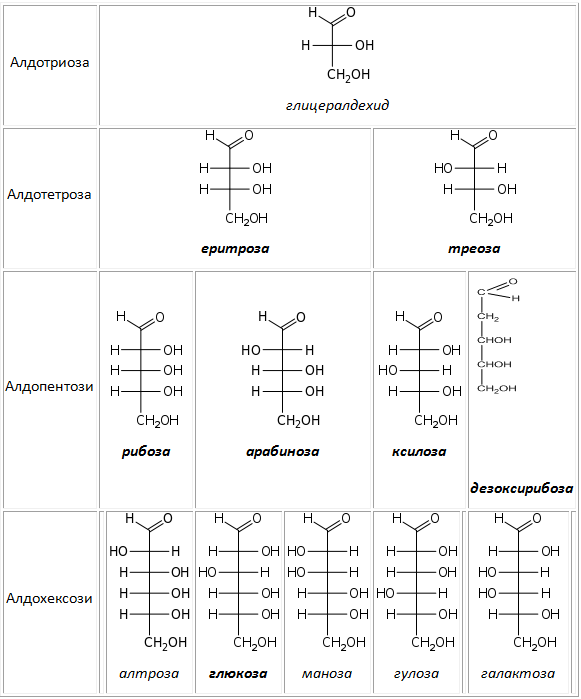
Таблица 15. D-Кетози
II. Стереохимия и конфигурация

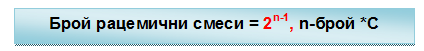
Монозахаридите съдържат в молекулата си асиметрични (хирални) въглеродни атоми (*С). Наличието на *С атом в молекулата на монозахаридите определя тяхната оптическа активност. Такива молекули могат да съществуват в две пространствено изомерни форми, наречени енантиомери, оптични изомери или оптични антиподи, които се отнасят една спрямо друга като предмет и огледалния му образ. Рацемичната смес е смес, съдържаща равни количества от двата енантиомера. Тя е оптически неактивна.
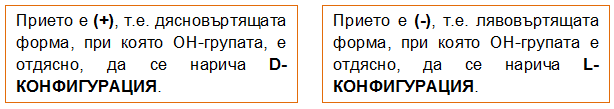
Енантиомерите имат подобни физични свойства, еднакви химични свойства, но се различават по оптичните си свойства - в разтвор с еднаква концентрация оптичните антиподи завъртат равнината на поляризираната светлина на еднакъв по големина, но противоположен по посока ъгъл - дясновъртящи (+) и лявовъртящи (–). Най-простият монозахарид е глицералдехидът (2,4- дихидроксипропанал) и неговите конфигурации се използват като еталон за определяне начина на подреждане на заместителите при C* атоми на монозахаридите, според D-/L-системата (правила на Фишер).
Фиг. 90. D- и L-конфигурации на глицералдехид
Според R-/S-системата (правила на Кан-Инголд-Прелог) начинът на подреждане на заместителите при C*-атом се осъществява по „старшинство”: най-младшият заместител (d) се разполага най-отзад. Ако останалите заместители са разположени по старшинство по посока на часовниковата стрелка - конфигурацията се нарича R (rectus - десен). Ако останалите заместители са разположени по старшинство в посока обратна на часовниковата стрелка - конфигурацията се нарича S (sinister - ляв).
Фиг. 91. R- и S-конформации на оптичноактивно вещество, според правилата на Кан-Инголд-Прелог

Теоретично при 4 *с атома в молекулата на монозахарида броят на изомерите е 24 = 16, от тях 8 са дясновъртящи (+) и 8 - лявовъртящи (-) антиподи. Различното разположение на Н и ОН групите при *с атоми определя D- и L-конфигурацията на монозахарида. Прието е конфигурацията на монозахарида да се определя от ориентацията на хидроксилната група при най-отдалечения от карбонилната група асиметричен въглероден атом. Когато ОН групата е от дясно, монозахаридът е с D-конфигурация, а когато е отляво е с L-конфигурация. При съединения с повече от един *С се отбелязват конфигурациите на всеки, като се започва от най-отдалечения от функционалната група.
Фиг. 92. D- и L-конформации на глюкоза
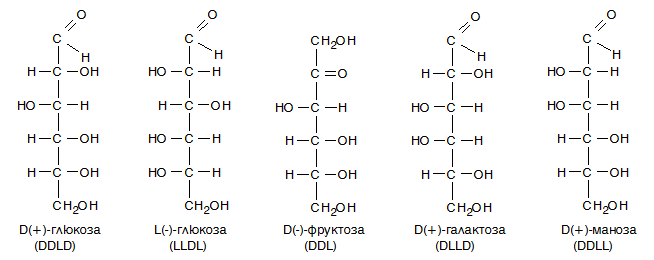
Карбонилните формули добре се съгласуват с много от физичните и химични свойства на монозахаридите - оптична активност, оптични изомери, реакции на карбонилната и хидроксилната група. През 1891 г. Е. Фишер е предложил конфигурацията на най-важните хексози:
Монозахаридите притежават и свойства, които не могат да се обяснят с карбонилните конформационни формули на Фишер. Такива свойства са:
- За разлика от карбонилните производни на въглеводородите (алдехиди и кетони) монозахаридите не реагират с натриевхидрогенсулфит (NaHSO3) и не участват в реакцията на Шиф (качествена реакция доказване на алдехидна група - получава се синьовиолетово оцветяване).
- След престояване разтворите на монозахаридите променят своя ъгъл на въртене на лъча поляризована светлина (α). Това явление се нарича мутаротация. Например, ако D(+) глюкоза изкристализира от 70% алкохолен разтвор тя има ъгъл на въртене [α]20D = +112o, който постепенно намалява до 52,7о. Ако D(+) глюкоза изкристализира от воден разтвор тогава [α]20D = +19о и постепенно се увеличава до 52.7о, т. е. променя се специфичният ъгъл на въртене до установяване на равновесие. Това явление се нарича мутаротация. Глюкозата с ъгъл на въртене +112о е α-глюкоза, а тази с +19о е β-глюкоза.
- Една от хидроксилните групи на глюкозата е по-реактивоспособна и по-лесно се метилира. Тази хидроксилна група се нарича гликозидна.
Обяснението за тези различни отнасяния са дали учените А. Коле и Б. Толенс, които допуснали, че се извършва вътрешно молекулно взаимодействие между карбонилната и хидроксилна група на отворената верига и образуване на циклични структури (полуацетални форми) при монозахаридите. Полуацетална форма се получава в резултат на тавтомерна изомеризация - оксоциклодезмотропия. Оксоциклодезмотропията се обяснява с поляризирането на двойната връзка в карбонилната група и с подвижността на водородните атоми от хидроксилните групи. Оксоциклодезмотропията е прескачане на подвижен Н атом от γ-позиция (4 място) или δ-позиция (5 място) към карбонилния кислороден атом в резултат на което се образува нова хидроксилна група, наречена гликозидна, която превръща карбонилния С атом в асиметричен. Взаимодействието е аналогично между това на алдехиди и алкохоли (линк Тема 11: Карбонилни производни на въглеводородите - алдехиди и кетони, V.1.3. Присъединяване на О-нуклеофили (H2O, алкохоли) и води до получаване на хетеропръстен съдържащ О атом - полуацетална форма на монозахарида. В резултат на тавтомерната изомерия възникват два нови изомера за всяка карбонилна форма на монозахарида, които се различават по конфигурацията на въглеродния атом носещ гликозидната хидроксилна група. Такива изомери се наричат диастериомери, които не са оптични антиподи (не са енантиомери), а са аномери - различават се само по конфигурацията на първия асиметричен въглероден атом (по разположението на гликозидната хидроксилна група): α-изомер - гликозидната хидроксилна група е от дясно и β изомер - от ляво (при проекциите на Фишер).
Фиг. 93. Аномери на D-глюкоза, където (1) е D-глюкоза; (2) е α,D-глюкопираноза; (3) е β,D-глюкопираноза
От трите възможни хетеропръстена термодинамично най-изгоден е шестатамният пиранов пръстен и той е най-стабилен (пиранозни форми). Възможно е образуването на петатомен фуранов пръстен (фуранозни форми):
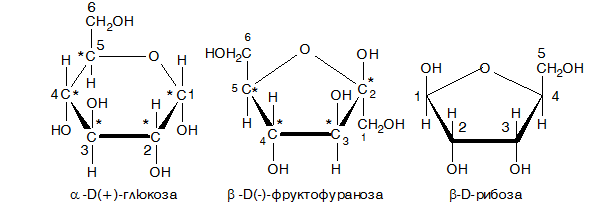
Трите форми (правата карбонилна и цикличните α- и β- ) съществуват самостоятелно само в кристално състояние. Във воден разтвор между карбонилната, α- и β-пръстенни форми се установява равновесие, изтеглено изцяло към пръстенните форми.

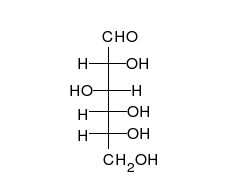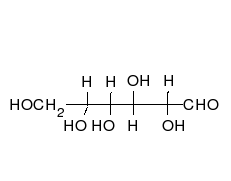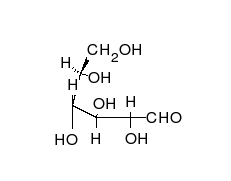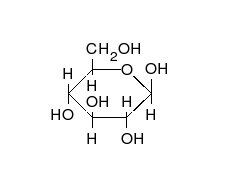
Предложените от Фишер и Толенс проекционни формули не дават пълна представа за пространственото разположение на всички части на молекулата.
През 1929 г. У. Н. Хауърт предлага перспективни (стереоравнинни) формули за цикличните структури, в които пространственото разположение на атомите в молекулите на монозахаридите се изразява по-точно.
Преминаването от проекционните към стереоравнинните формули става при прилагането на следните правила:
- Пръстенът лежи в равнина перпендикулярна на равнината на чертежа като О-атом, чрез който е образуван хетеропръстена винаги се поставя в горния десен ъгъл на 6-атомния пръстен при алдохексозите;
- в перспективните формули на Хауърт С атоми в пръстена се отбелязват с цифри;
- всички заместители при *С разположени отдясно в структурните формули, в стереоравнинните са под равнината на пръстена и обратно;
- групировката –СН2 обикновено се поставя над (извън) равнината на пръстена.
В перспективните формули на Хауърт С-атоми в пръстена се отбелязват с цифри, атомите и атомните групи, разположени отдясно, се пишат под равнината на пръстена, а разположените отляво - над равнината на пръстена. До 1950 г. се приемаше, че цикличните (пръстенни) структури на монозахаридите са равнинни. По-късно е доказано, че те съществуват в две конформационни структури („вана" и „кресло" – конформационна изомерия) т.е. пръстенът на фуранозите и пиранозите не е равнинен. В полуацеталните пръстенни форми на монозахаридите връзките в пръстена са прости С–С s-връзки и е възможно въртене около проста s-връзка в резултат на което се получават конформационни изомери (конформери), които стереохимично се представят подобно на циклохексановите производни „кресло” („стол”) и „вана”. Между двата конформационни изомера има равновесие, изтеглено към конформация кресло. Енергетично предпочитаната конформация е “кресло” (енергетично по-бедна, сл. по-устойчива конформация) и то тази, в която хидроксиметиленовата група е в екваториално положение.
Между трите форми (α-, β- и правата карбонилна) съществува равновесие, като те бавно се превръщат една в друга:
III.Физични свойства

Монозахаридите са безцветни кристални, неутрални вещества, които трудно кристализират, особено ако са онечистени с примеси. Те са лесно разтворими във вода, малко в алкохол и почти не са разтворими в неполярни органични разтворители (бензин, етер, хлороформ и др.). Химически чистата глюкоза е безцветно кристално вещество със сладък вкус, разтворимо във вода, но фруктозата като търговски продукт, поради наличието на примеси, е гъста сироповидна течност. По физичните си отнасяния фруктозата прилича на глюкозата, но по-сладък вкус от глюкозата и за разлика от нея се разтваря в алкохол. При загряване монозахаридите се стопят, карамелизират и овъгляват, като се отделят водни пари. Повечето от монозахаридите имат сладък вкус, свързан с натрупването на хидроксилни групи в молекулата им, но има и такива без вкус, а някои дори са горчиви.
IV. Химични свойства

Химичните свойства на монозахаридите се обуславят от наличието на две функционални групи - карбонилна и хидроксилни.
IV.1. Реакции характерни за карбонилната група
С карбонилната си група монозахаридите участват в почти всички присъединителни реакции, които са характерни за карбонилните производни на въглеводородите (линк Тема 11: Карбонилни производни на въглеводородите - алдехиди и кетони, т. V. Химични свойства на алдехиди и кетони).
IV.1.1. Оксидация (окисляване)
Монозахаридите притежават редукционни свойства и лесно се окисляват в кисела или основна среда.
- Оксидация в кисела среда
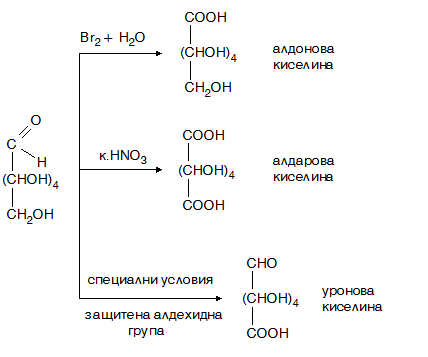
Оксидацията на монозахариди в кисела среда протича специфично. В кисела среда се окисляват само алдозите и в зависимост от окислителя се получават различни продукти:
- ✔ със слаби окислители (бромна вода) се окислява само алдехидната група и се получават хидроксимонокарбоксилови киселини, наречени алдонови (хидроксимонокарбоксилови) киселини;
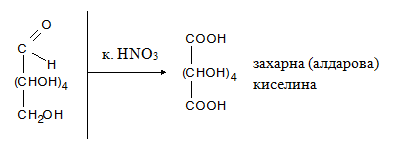
- ✔ със силни окислители (к. НNO3, к. Н2SO4) се окисляват едновременно алдехидната и първичните –OH групи, при което се получават хидроксидикарбоксилови киселини, наречени захарни (алдарови) киселини;
- ✔ при меки биологични условия (в организма) или извън организма при специални условия (блокирана/защитена, алдехидната група) се окислява само първичната алкохолна група и се получават уронови киселини.
- Оксидация в алкална среда
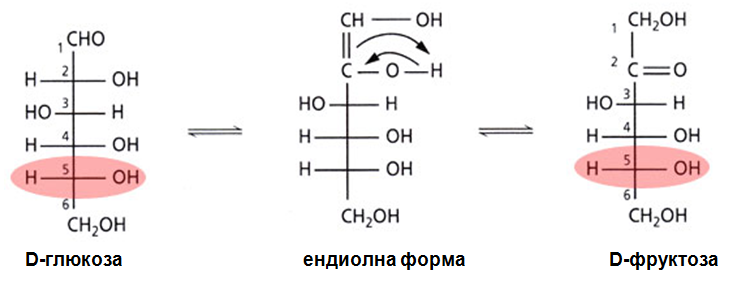
В алкална среда и невисока температура монозахаридите изомеризират като се получава равновесна смес от алдози и кетози. Тази изомеризация се нарича епимеризация, епимерите се различават по конфигурацията на един *С-атом. При епимеризацията на D-глюкоза се получава равновесна смес от α,D- и β,D-глюкофураноза и α,D- и β,D-глюкопираноза.
Фиг. 94. Епимеризация на глюкоза
В резултат на епимиризацията в алкана среда могат да се окисляват както алдози, така и кетози. Предполага се, че епимеризацията протича през междинно образуване ендиолна структура. Епимеризацията на D-глюкозата води до образуване на междинна ендиолна форма, а като краен продукт – D-фруктоза.
IV.1.2. Редукция
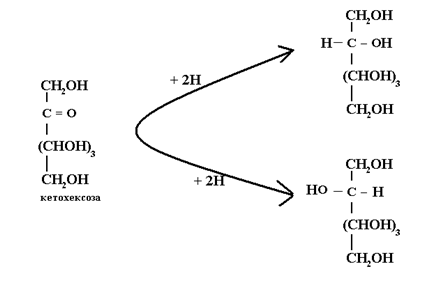
При редукция с подходящи редуктори (водород, натриев борхидрид и др.) в слабо кисела среда монозахаридите се превръщат в многовалентни алкохоли(захарни алкохоли). При редукция на кетози се получават 2 диастериомера, тъй като карбонилния С-атом също се превръща в *С:
IV.1.3. Удължаване на С-верига –присъединяване на циановодород
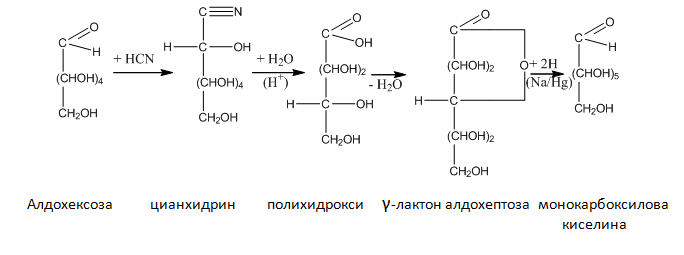
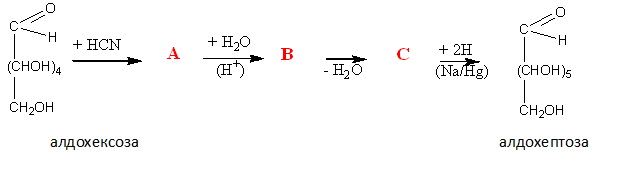
Нуклеофилното присъединяване на циановодород към карбонилната група на монозахарид е т. нар. цианхидринов синтез на Килиани-Фишер- метод за удължаване на въглеродната верига. При тази реакция от алдохексоза последователно се получават цианхидрин, полихидрокси карбоксилова киселина, γ-лактон и като краен реакционен продукт – алдохептоза.
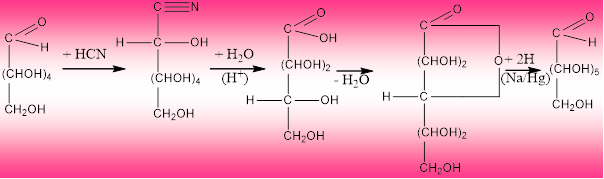
алдохексоза цианхидрин полихидрокси γ-лактон алдохептоза
монокарбоксилова к-на
IV.1.4. Скъсяване на С-верига - реакция с хидроксиламин
Взаимодействието на монозахариди с хидроксиламин се нарича метод на Воол за скъсяване на С-верига на монозахарида, т. напр. от алдохексоза се получава алдопентоза:
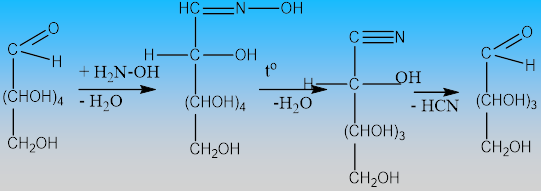
алдохексоза хидроксиламин нитрил алдопентоза
IV.1.5. Кондензация с фенилхидразин
В резултат на взаимодействието на монозахариди с фенилхидразин се получават фенилозазони. Реакцията се използува за идентифициране на хексозите.
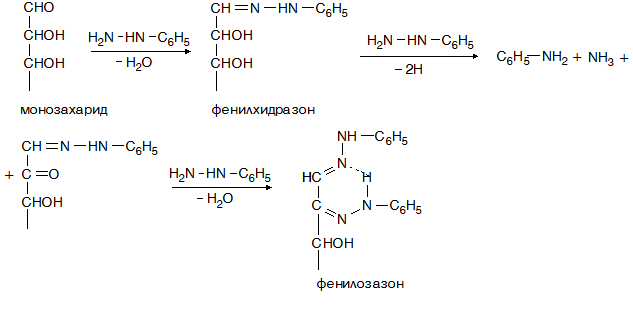
IV.2. Реакции характерни за хидроксилната група
С хидроксилните си групи монозахаридите участват в присъединителни реакции, които са характерни за алкохолите (линк Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т. V. Химични свойства на алкохоли и феноли).
IV.2.1. Естерификация
Монозахаридите образуват естери както с неорганични, така и с органични киселини. Изключително важни за биохимичните процеси в живите организми са естерите на фосфорната киселина, които се получават в резултат на процеса гликолиза – ензимно разграждане на глюкозата до пирогроздена киселина (CH3COCOOH). При първия етап на гликолизата под действие на ензима хексокиназа се получава глюкозо-6-фосфат, който изомеризира до фруктозо-6-фосфат (втори етап, ензим фосфоглюкозоизомераза). На третия етап под действие на ензима фосфофруктокиназа фруктозо-6-фосфатът се фосфорилира до фруктозо-1,6-дифосфат, който се разгражда до крайния продукт на ензимното разграждане на глюкозата в организна - CH3COCOOH (пироват).

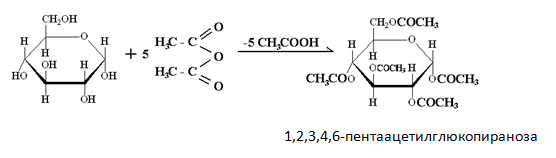
Монозахаридите се естерифицират лесно с различни производни на киселините, най-често с киселинни халогениди или анхидриди.Например при пълното естерифициране на глюкозата с оцетен анхидрид (СН3СО)2О се получава 1,2,3,4,6-пентаацетилглюкопираноза:
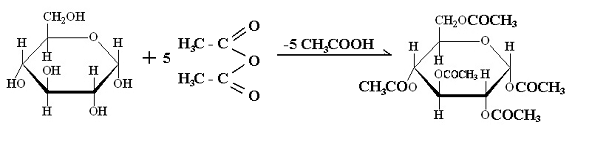
IV.2.2. Етериране (алкилиране)
Под действието на алкохол и сух газообразен хлороводород (HCl) Н-атом от гликозидната ОН-група на монозахарида се замества с алкилов радикал като се получават кислород гликозиди (О-гликозиди). Кислород гликозидите по химичната си структура са ацетали. Те се образуват при реакция на α,D- или β,D-глюкоза с метанол в среда от сух HCl, например от α,D-глюкопираноза се получава α,D-О-метилгликозид. Алкилирането на другите хидроксилни групи се извършва по-труднo.
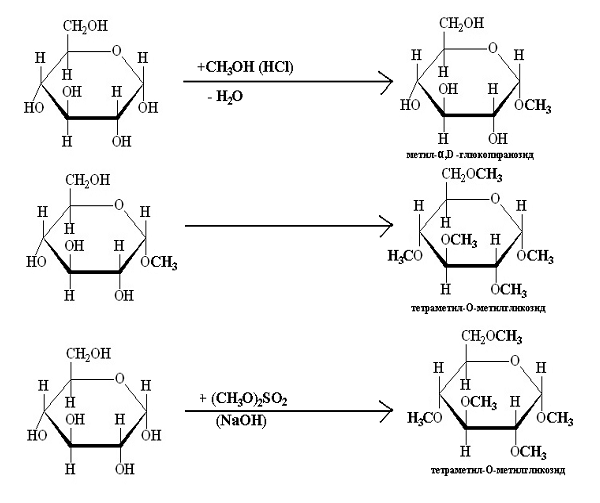
Всеки О-гликозид е изграден от захарен компонент (гликон) и незахарен остатък - алгикон. О-гликозидите лесно се хидролизират под действие на минерални киселини или ензими (глюкозидази).
IV.3. Други химични отнасяния на монозахариди
IV.3.1. Ферментация на монозахариди
Под действие на микроорганизми, бактерии, плесени, спиртни дрожди - монозахаридите се разпадат до въглероден диоксид, водород, метан и др. - процесът се нарича ферментация. Тя може да е алкохолна, маслено киселинна или млечно киселинна, според крайните реакционни продукти.
- Алкохолна ферментация
Алкохолната ферментация е характерна за D-глюкоза, D-фруктоза, D-маноза и частично за D-галактоза. Тя протича под действието на сборен ензим цимаза, в чийто състав влизат 15 ензима. Алкохолната ферментация е анаеробен (без кислород) процес, при който около 95% от монозите подложени на алкохолна ферментация се превръщат в етанол и въглероден диоксид:
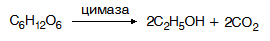
При ферментация на монози в аеробна (кислородна) среда и спиртни дрожди се получава биомаса съдържаща мазнини, белтъци, витамини и само 3-4% етанол. Тази биомаса се използва за получаване на лекарствени препарати или за храна в животновъдството.
- Оцетнокисела ферментация
Оцетнокиселата ферментация протича под действие на оцетнокиселите бактерии в кислородна среда и води до получаване на оцетна киселина (CH3COOH) като краен реакционен продукт.
IV.3.2. Отнасяне на монози към силни киселини при загряване
При загряване с разредени силни минерални киселини или органични киселини монозахаридите се обезводняват. При тези условия пентозите образуват фурфурал (хетероцикления алдехид), а хексозите първо образуват 5-хидроксиметилфурфурал, а след това се разпадат до левулинова киселина.
Под действие на к. НNO3 или к. Н2SO4 (силни окислители) в молекулите на монозахаридите се окисляват едновременно алдехидната и първичните –OH групи, при което се получават хидроксидикарбоксилови киселини, наречени захарни (алдарови) киселини;
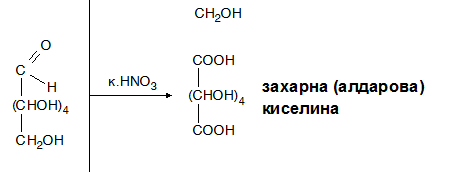
IV.3.3. Качествени реакции
- С реактив на Толенс (Ag2O) глюкозата и фруктозата се окисляват до глюконова киселина. Поради наличието на карбонилна група в молекулата им те редуцират диамонячния сребърен хидроксид до елементно сребро (сребърно-огледална проба).
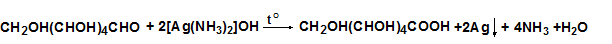
- глюкозата и фруктозата редуцират Фелингов разтвор до димеден(I) оксид (червена утайка).
- реакция на Селиванов - реакцията е специфична за кетози
При загряване с реактив на Селиванов (резорцин: m-дихидрокси бензен) и няколко капки к. H2SO4 разтвор на фруктоза се оцветява във вишневочервено.тази качествена реакция за доказване на кетози е известна като реакция на Селиванов.
- доказване на съседни хидроксилни групи при монозахариди
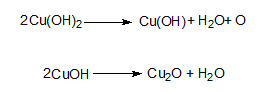
Монозахаридите образуват с Cu(OH)2 хелати - вътрешнокомплексни съединения, които са с характерно оцветяване.
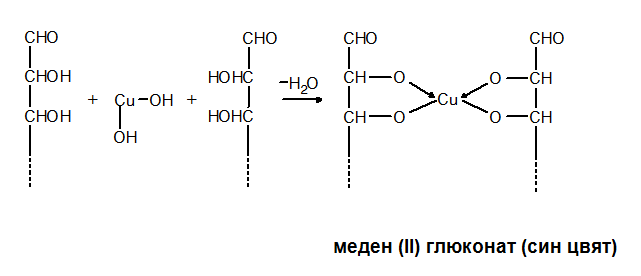
V. ПРЕДСТАВИТЕЛИ

От оптично активните форми (16) на алдохексозите в природата се срещат D(+) глюкоза, D(+) маноза, D(+) галактоза и D(+) талоза, а от кетохексозите -само D(-) фруктоза.
V.1. хексози
- Глюкоза (гроздена захар, декстроза)
Глюкозата се среща в гроздето, нишестето, гликогена и целулозата. В кръвта на човек се намира глюкоза в норми от 80-120 mg %. Тя е градивен елемент на нишестето, гликогена. При ензимно окисляване на глюкозата в тъканите се освобождава енергия, необходима за протичане на нормалните жизнени процеси в живите организми. Глюкозата се складира в черния дроб като гликоген, който при нужда се разгражда. Поради лесното й усвояване глюкозата се използва за приготвяне на лечебни препарати за венозно преливане, за приготвяне на различни захарни изделия, и други. Редукционните свойства на глюкозата се използват за направа на огледала, играчки, за дъбене на кожи и други.
- D (-) Фруктоза (плодова захар, левулоза)

Фруктозата се среща в различни сортове плодове, пчелен мед и е два пъти по-сладка от глюкозата. Тя се усвоява по-добре от диабетично болни хора и затова се използва за храна от тях.В последните години вниманието на учените се насочи към фруктозата както поради значителното увеличаване на консумацията, така и поради евентуалната й връзка с развитието на затластяването на населението. Установено е, че диета богата на фруктоза води до артериална хипертония при експериментални животни, но за сега подобен ефект не е доказан при хора.
- D (+) Галактоза
Галактозата е безцветно кристално вещество, което не е много сладко. Най-широко тя е разпространена в млечните продукти, майчиното мляко и пектините (в някои плодове). Тя влиза в състава на млечната захар лактоза. Галактоземията е наследствено заболяване, при което галактозата не може да се превръща в глюкоза.
V.2. Пентози
Пентозите не се срещат в свободно състояние в природата, а под формата на незахароподобни полизахариди (пентозани), които се намират в дървесината, обвивки на семена, сламата и др.
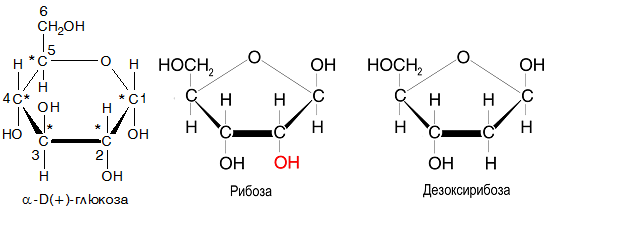
- Рибоза
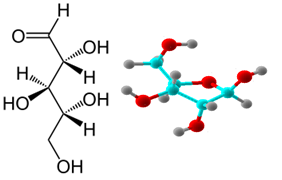
D(-)-рибозата влиза в състава на рибонуклеиновите киселини (РНК) и в някои витамини.Тя е важен компонент на коензимите АТФ, ФАД, НАД и НАДФ и участва и в изграждането на фосфозахаридния гръбнак на РНК, която има много разнообразни функции в организма. При генната експресия РНК играе ролята на посредник, като използва кодираната в ДНК информация.
- D-Дезоксирибоза

D-дезоксирибозата изгражда дезоксирибонуклеиновите киселини (ДНК), които са носители на генетичните информация за биологическото развитие на всички клетъчни форми на живот. Основната функция на ДНК е дълготрайното съхранение на информация.
- Арабиноза

Арабинозата носи своето име от гума арабика, от която за първи път е изолирана. L(+)-арабинозата е много по-често срещана от D(-)-арабинозата в живите организми. Тя е важен компонент от биополимерите хемицелулоза и пектин, изграждащи клетъчната стена на бактериите и растенията. L-арабинозният оперон (функционална единица от ДНК молекулата съдържаща "пакет" от гени) е от изключително значение в молекулярната биология и биоинженерството. D(-)-арабинозата заедно с други монозахариди може да бъде открита в урината (явлението-пентазурия). Тя се съдържа в черешовата смола и в хемицелулозата арабан.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
монозахариди - въглехидрати, които не хидролизират до по-нискомолекулни продукти се наричат
D-конфигурация - конфигурация, при която заместителите, различни от водороден атом, се намират отдясно на въглеродната верига
L-конфигурация - конфигурация, при която заместителите, различни от водороден атом, се намират отляво на въглеродната верига
агликон - незахарен остатък, участващ в изграждането на О-гликозидите
гликон - захарен компонент, участващ в изграждането на О-гликозидите
асиметричен (хирален) С-атом - въглероден атом, който е свързан с четири различни вида атоми или групи от атоми
аномери - изомери, които се различават само по конфигурацията на първия асиметричен въглероден атом
диастериомери - в резултат на тавтомерната изомерия възникват два нови изомера за всяка карбонилна форма на монозахарида, които се различават по конфигурацията на въглеродния атом, носещ гликозидната хидроксилна група
енантиомери - оптични изомери, които се отнасят една спрямо друга като предмет и огледалния му образ
гликолиза – ензимно разграждане на глюкозата до пирогроздена киселина (CH3COCOOH)
епимеризация - процес на изомеризация на монозахаридите в алкална среда и при невисока температура, при който се получава равновесна смес от алдози и кетози
метод на Воол - взаимодействие на монозахариди с хидроксиламин; метод за скъсяване на С-верига на монозахарида
мутаротация - промяна на оптичната ротация, която се наблюдава при епимеризация
НАД - никотинамид аденин динуклеотид
НАДФ - никотинамаид-аденин-динуклеотид-фосфат
ФАД - флавин-аденин-динуклеотид
АТФ - аденозинтрифосфат
оксоциклодезмотропия - тавтомерна изомеризация
перспективни (стереоравнинни) формули - формули, предложени от У. Хауърт, представящи по-точно пространственото разположение на атомите в молекулите (непр. на монозахаридите)
правила на Кан-Инголд-Прелог - система за означаване на конфигурацията на оптичноактивни молекули, известна още като R,S-система: въвежда се старшинство на заместителите около стереоцентъра: най-старши е този атом, който има най-голям номер в периодичната система на елементите
правила на Фишер - система от правила за графично изобразяване на пространствения строеж на оптичноактивни хирални молекули и наименоване на оптичните изомери
рацемична смес - оптично неактивна форма, състояща се от еквимоларни количества от двата оптични антипода на едно оптично активно съединение
реактив на Селиванов - резорцин: 1,3-дихидрокси бензен
реакция на Селиванов - качествена реакция за доказване на кетози, при която при загряване с реактив на Селиванов и няколко капки к. H2SO4 разтвор на фруктоза се оцветява във вишневочервено
синтез на Килиани-Фишер - нуклеофилно присъединяване на циановодород към карбонилната група на монозахарид; метод за удължаване на въглеродната верига
реактив на Толенс - амонячен разтвор на Ag2O
реакция на Шиф - качествена реакция за доказване на алдехидна група- получава се синьовиолетово оцветяване
Фелингов разтвор - получава се при смесване на разтвор на меден сулфат със силно алкален разтвор на калиево-натриев тартарат
хелати - вътрешнокомплексни съединения

ВЪПРОСИ И ЗАДАЧИ
1.Посочете общата формула на монозахаридите (n≥3):
- A. CnH2mOm
- B. CnH2On
- C. CnH2nOn
- D. C2nHnO2n
Отговор
2.В коя от посочените двойки съединение-група има несъответствие?
- A. захароза - дизахарид
- B. рибоза - монозахарид, алдопентоза
- C. маноза - монозахарид, алдохексоза
- D. глюкоза - монозахарид, кетохексоза
- E. целулоза - полизахарид.
Отговор
3.Напишете уравнението на окислителната реакция на глюкоза със силни окислители (к. HNO3, к. H2SO4).
Отговор
4.Напишете наименованията на следните монозахариди:
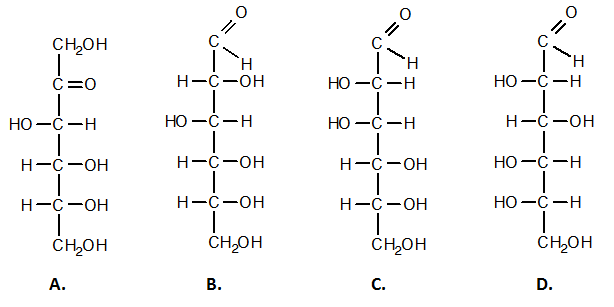
Отговор
5.При редукция на глюкоза (C6H12O6) се получава:
- A. глюконова киселина (C6H13O7)
- B. сорбитол (хексанхексол) (C6H14O6)
- C. хексанал (C6H12O)
- D. хексанон (C6H12O).
Отговор
6.Посочете грешното твърдение:
- A. Монозахаридите хидролизират.
- B. Олигозахаридите са съставени от монозахариди.
- C. Дизахаридите принадлежат към групата на олигозахаридите.
- D. Полизахаридите се състоят от 10 или повече монозахарида.
Отговор
7.Кое от посочените съединения дава положителна проба “сребърно огледало”?
- А. глюкоза
- B. рибоза
- C. фруктоза
- D. глицералдехид
- E. глюкоза и фруктоза
- F. глюкоза, фруктоза и рибоза
- G. глюкоза и глицералдехид
- H. четирите монозахарида.
- Обосновете отговора си.
Отговор
8.Под действието на ензими глюкозата ферментира според уравнението:
- А. C6H12O6 -> 2C2H5OH + 2CO2
- B. C6H12O6 -> 6CO2 + 6H2O
- C. C6H12O6 -> 2C3H6O
- D. C6H12O6 -> C12H21O11
Отговор
9.Довършете следната химична реакция:
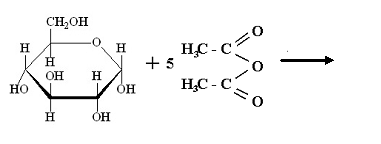
Какъв тип процес е тя?
Отговор
10.Напишете структурните формули и наименования на междинните продукти при цианхидриновия синтез на Килиани-Фишер:
Отговор