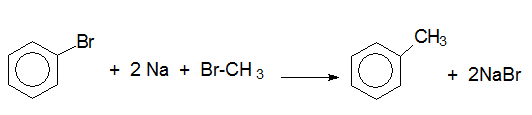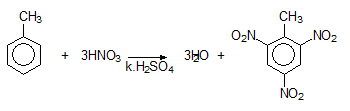АРОМАТНИ ВЪГЛЕВОДОРОДИ (АРЕНИ)
I. ОПРЕДЕЛЕНИЕ , ХОМОЛОЖЕН РЕД , НАИМЕНОВАНИЯ

I.1. ОПРЕДЕЛЕНИЕ
Названието им ароматни въглеводороди е дадено от Кекуле, поради това, че първите открити представители на този клас въглеводороди имат приятен аромат. Това название запазено и до днес, но съвременното значение на понятието е свързано с молекулния строеж - устойчива циклична система със специфичен характер на връзките и специфични химични свойства:
- арените лесно встъпват в заместителни реакции, което не е характерно за ненаситените въглеводороди;
- устойчивост на бензеновото ядро към оксиданти;
- арените трудно встъпват в присъединителни реакции;
- арените не участват в полимеризационни процеси.
Според броя на бензеновите ядра, които се съдържат в молекулите на арените те биват еднопръстенни (моноядрени) и полипръстенни (многоядрени, кондензирани).
I.2. ХОМОЛОЖЕН РЕД
Най-простият представител на ароматните въглеводороди е бензенът (бензол). Към ароматните въглеводороди спадат както многоядрените арени (с повече от едно ароматно ядро) - нафтален антрацен, фенантрен и др. и тези с некондензирани бензенови ядра, които са свързани чрез σ-връзка непосредственно или чрез радикал (бензеновите ядра са независими едно от друго) - дифенил (С12Н10), дифениметан (С6Н5–СН2– С6Н5), трифенилметан: С6Н5–СН– (С6Н5)2.
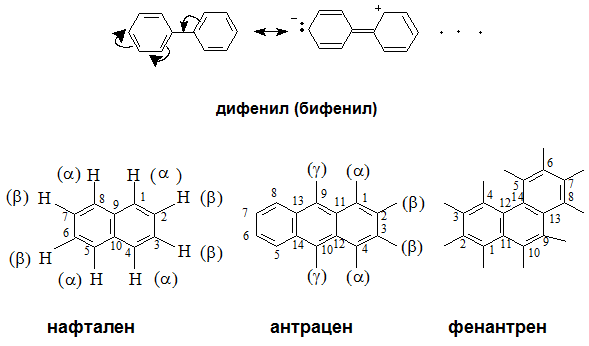
В молекулите на най-разпространените многоядрени арени - нафтален антрацен, фенантрен и др. броят на кондензираните бензенови ядра може да бъде различен.
I.3. НОМЕНКЛАТУРА (НАИМЕНОВАНИЕ)
- Производните на бензена, имащи алкилов заместител в молекулата си се наричат алкилбензени.
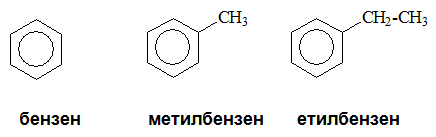
-
Когато бензеновият пръстен е свързан с остатък от алкени (алкенилови радикали) се получават т. нар. алкенилбензени. Най-важният представител на тази група въглеводороди е етенилбензен (стирен, стирол) - С6Н5-СН=СН2.
-
При наличие на сложно построена странична въглеродна верига, ароматното ядро се означава като заместител (фенилов радикал, фенил) на съответния въглеводород.
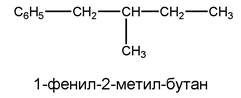
- Когато бензеновият пръстен притежава повече от един сложно построен заместител, този начин на образуване на наименованието е неприложим и в такива случаи въглеводородите се разглеждат като бензенови производни.
II. МОЛЕКУЛЕН СТРОЕЖ

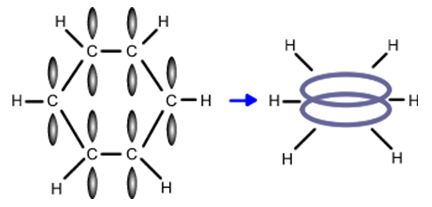
Шестте въглеродни атоми в бензеновия пръстен са в sp2-хибридно състояние (Тема 3: Видове химични връзки в неорганичните и органични съединения, т.VII.2. SP2 Хибридизация). Опитно е установено, че молекулата на бензена е с плоска структура, симетрична, неполярна - С атоми лежат в една равнина, като образуват правилен шестоъгълник с дължина 0,140 nm на шестте С–С σ-връзки, а дължината на С–Н σ-връзки – 0, 108 nm и валентни ъгъли между два С и един Н атом 120°.
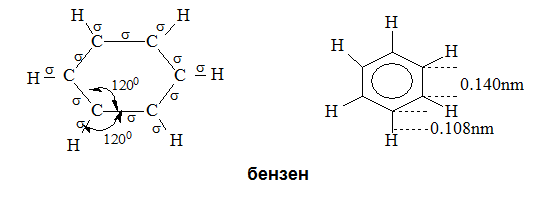
Съгласно класическите представи молекулата на бензена представлява шестатомен пръстен, в който има три спрегнати двойни връзки, което се изразява чрез формулите на Кекуле:
В молекулата на бензена всички атома лежат в една равнина, а С-атоми образуват правилен шестоъгълник. Валентните C−C−H и C−C−С ъгли са равни на 120о. Съгласно съвременните квантово електронни представи равнината структура на бензена се обяснява с това, че С-атоми в молекулата са в sp2-хибридно състояние ( Тема 7: Ненаситени алифатни въглеводороди - Алкени, т.III. Молекулен строеж на алкени). В молекулата на бензена чрез припокриване на две по две sp2-хибридните АО на съседни С-атоми се реализират шест броя С–С σ-връзки (sp2-sp2), а при припокриване на sp2-хибридните АО на С-атоми с s- АО на Н-атоми се образуват шест броя С–Н σ-връзки (sp2-s). Всички σ-връзки лежат в една равнина и образуват т.н. σ-скелет на бензена. При всеки от шестте С-атоми остава по един нехибридизиран 2рz-електронен облък. Шестте 2pz AO на С-атоми са разположени успоредно една спрямо друга и перпендикулярно на равнината на σ-скелета. При странично припокриване на нехибридизираните 6 2рz-АО под и над равнината на σ-връзките се образува делокализиран π-електронен секстет, който е едновременно притежание и на шестте С-атома на бензена т.е. образува се обща многоцентрова колективна връзка (фиг. 63). По този начин между всеки два С-атома има една локализирана σ-връзка (sp2- sp2) и 1/2 рz-рz делокализирана π-връзка - електронната плътност е равномерно разпределена между шестте С атома в бензеновия пръстен.
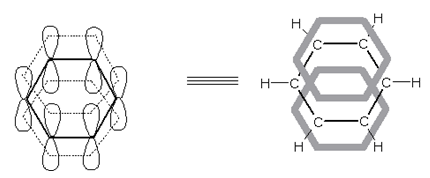
Фиг. 63. Молекулен строеж на бензен
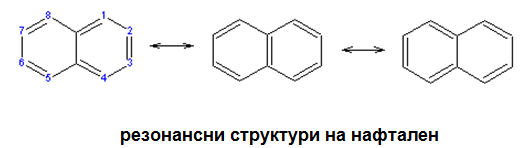
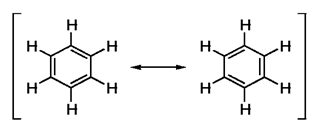
Делокализацията на π-електронен секстет в молекулата на бензена се изразява чрез формулите на Робинсън:

III. ИЗОМЕРИЯ

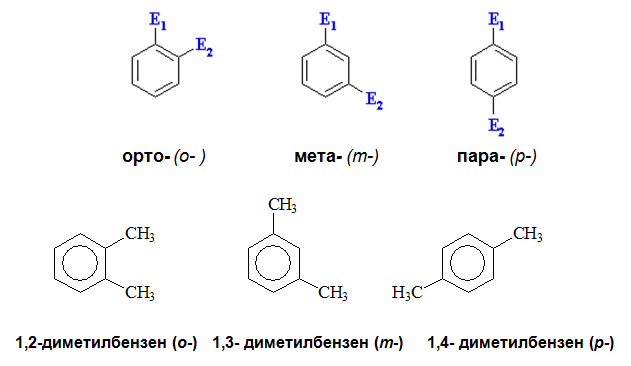
Изомерия при моно-субституиран (заместен) бензен не съществува, тъй като и шестте Н-атоми в бензеновия пръстен са равностойни. Характерна изомерия за арените е позиционната изомерия: ди- и три-заместените производни.
При наличие на два еднакви заместителя в бензеновия пръстен са възможни три позиционни изомера:
- орто (о-) или 1,2-дизаместени – заместителите са при два съседни С атома в бензеновия пръстен;
- мета (m-) или 1,3-дизаместени - заместителите са при съседни въглеродни атома, кото са през един въглероден атом в бензеновия пръстен;
- пара (р-) или 1,4-дизаместени - заместителите са при С атоми, които са през два С атома в бензеновия пръстен (един срещу друг).
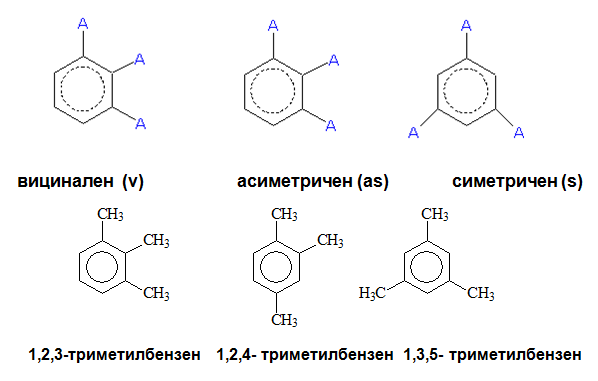
При три-субституираните производни на бензена възможните позиционни изомера са три на брой: (v)-вицинален – 1,2,3-тризаместен; (as)-асиметричен – 1,2,4-тризаместен и (s)-симетричен – 1,3,5-тризаместен.
IV. ФИЗИЧНИ СВОЙСТВА

Бензенът и хомолозите му са безцветни течности или кристални вещества с характерна миризма. Не се разтварят във вода, но са добри органични разтворители - на мазнини, смоли, каучук и др. Бензенът е токсичен и с канцерогенно действие.
V. ХИМИЧНИ СВОЙСТВА

Химичните свойства на арените се определят от вида и характера на връзките, които се съдържат в молекулите им. За ароматните въглеводородипо-характерни са заместителните реакции, при които се разкъсват С-Нσ-връзки, но са възможни и присъединителни реакции, които се извършват по-трудно в присъствие на катализатори, загряване или облъчване със светлина (фиг. 64). Тези отнасяния на ароматните въглеводороди се обясняват с електронния им строеж - наличие на делокализиран π-електронен секстет, който трудно се поляризира и разкъсва, сравнен със здравината на двойната (алкени) и тройната (алкини) връзки.
Фиг. 64. Химични отнасяния на арени
V.1. ЗАМЕСТИТЕЛНИ РЕАКЦИИ

|
Всички заместителни реакции за бензеновия пръстен протичат по механизъм на електрофилно заместване. |
При арените заместителни са реакциите при които един или няколко H атоми от бензеновото ядро се заместват с различни атоми или групи. Заместителни реакции за арените са халогениране, нитриране, сулфориране и алкилиране. Заместителите в бензеновото ядро в зависимост от мястото на ориентация на следващия заместител и скоростта на заместителната реакция биват:
- Заместители от I род - ориентират следващия заместител на о- и р-място, и ускоряват заместването (имат +I или +M), в сравнение с това при бензена (-OH, -OR, -OC6H5, -NH2, -NR2, -R); или забавят заместването (имат -I), каквито са: -CH2Cl, F, Cl, Br и др.
- Заместители от II род - забавят следващото заместване и ориентират заместителя на m-място (атоми или функционални групи с –I и без +М ефект),: -NO2, -SO3H, -CHO, -COOH, -NH3, -NR3 и др.
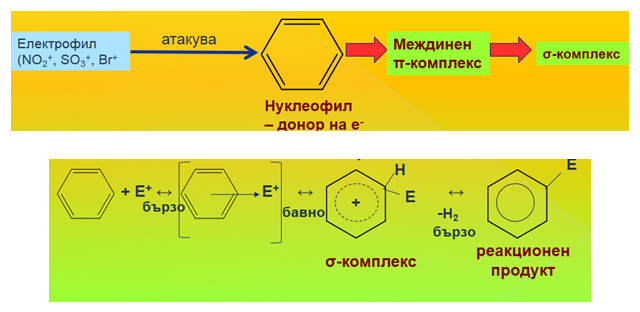
Заместителните реакции протичат по механизъм на електрофилно заместване. Електрофилното заместване протича по един и същ механизъм независимо от използвания електрофилен агент.
V.1.1. Халогениране
Заместителните реакции с халогенен атом в молекулата на безена протичат в присъствие на катализатори – киселини на Люис (FeBr3, AlCl3). Получените халогенопроизводни са изходна суровина за получаване на почти всички класове ароматни съединения, което определя тяхната значимост за органичния синтез. Халогенирането се извършва с хлор и бром тъй като флуорът реагира много бурно и се получава смес от странияни продукти и много малко от основния продукт – флуоробензен (C6H5F), а йодът е с много много малка реакционна активност.
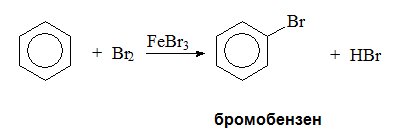
Халогенирането протича по механизъм на електрофилното заместване като атакуващ електрофилен агент е халогенният катион, получен при взаимодействието на катализатора и молекулата на халогена. Халогенният катион се явява електронен акцептор - има свободна атомна орбитала, докато π-електронният секстет на бензена - донор на електрони.
В хода на реакцията се образува връзка между електрофилния агент (Cl+) и един от sp2 С-атоми, който преминава в sp3-хибридно състояние (образуване на σ-комплекс). В този бавен процес участва една от ароматните двойни C=C връзки, което води до нарушаване на π-електронния секстет на бензеновото ядро. Полученият σ-комплекс е енергетично богат и нестабилен и за да се стабилизира молекулата, следва бързо елиминиране на Н+ и получаване на реакционен продукт – хлоробензен. В края на реакцията катализаторът се възстановява.
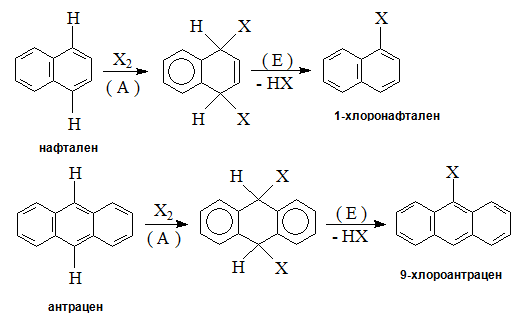
Заместителни реакции с халогенни атоми при многоядрените арени се извършват на два етапа: 1, 4 – присъединяване на Х2, последвано от елиминиране на НХ:
V.1.2. Нитриране
Нитрирането е реакция на заместване на Н атом с нитро група -NO2 и се извършва с нитрирна смес (HNO3 : H2SO4 = 1 : 2) и води до получаване на нитробензен (С6Н5NO2) - течност с миризма на горчиви бадеми. Тъй като за нитрирането на бензеновото ядро е необходима конц. HNO3 като обезводняващо средство се използва конц. Н2SO4, която поглъща отделената в хода на реакцията вода. Полученият реакционен продукт – нитробензен, е изходна суровина за промишлено производство на анилин.
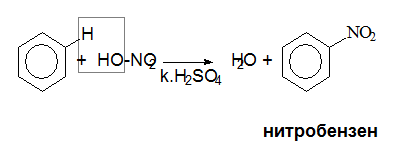
Реакцията на нитриране на бензен протича по механизъм на електрофилно заместване. Според протолитната теорията на Брьонстед и Лоури в хода на реакция HNO3 играе роля на основа (акцептор на протони), а Н2SO4 – на киселина (донор на протони). Атакуващ електрофилен агент при нитрирането на бензен е нитрониевият катион (NO2+).
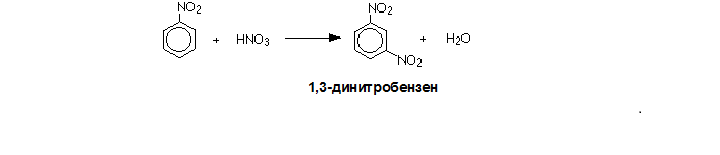
При висока температура реакцията продължава като полученият нитробензен реагира с нова молекула азотната киселина и втората нитрогрупа се ориентира на m-място и получава се 1,3-динитробензен:
При нитриране на хомолози на бензен (толуен) нитро-групата се ориентира на о- (2-нитротолуен) или р-място (4-нитротолуен):
При арени с кондензирани ароматни ядра се заместват Н-атоми на α (1)- и β (2)-позиции:
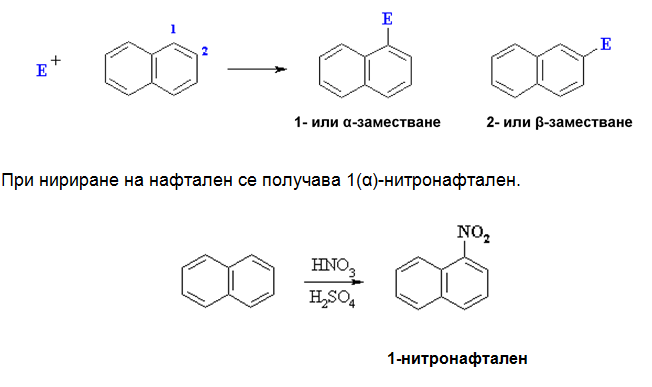
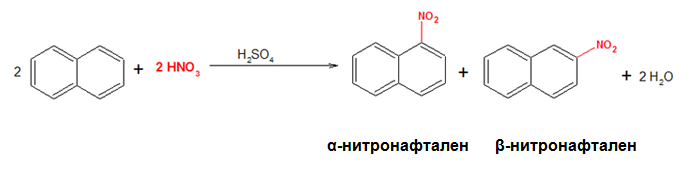
При излишек на азотна киселина реакцията нитриране на нафтален води до получаване на смес от два реакционни продукта: α- и β-нитронафтален.
V.1.3. Сулфониране
Сулфонирането е реакция на заместване на водороден атом със сулфонова група -SO3H, която се извършва с конц. H2SO4 и води до получаване на бензенсулфонова киселина като реакционен продукт.
V.1.4. Синтез на Фридел-Крафтс
Алкилирането на бензен с алкилхалогенид (RX) в присъствие на катализатор безводен AlCl3 (киселина на Люис) се нарича синтез на Фридел-Крафтс и води до получаване на алкилбензени като краен реакционен продукт.
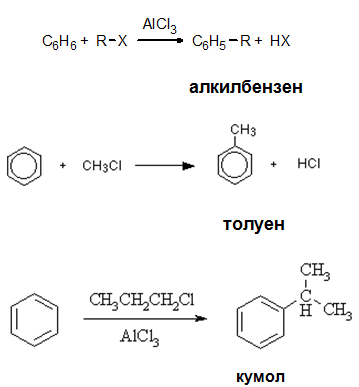
Реакцията протича по механизъм на електрофилно заместване на няколко етапа:
1. Формиране на електрофил
2. Атака на електрофила
Електрофилът (метиловият катион) делокализира електроните в бензеновия прYстен и 2 електрона от тях образуват връзката между СН3 и бензеновия пръстен (образува се σ-комплекс).
3. Атака на AlCl4– върху σ-комплекса - възSтановяване на катализатора (AlCl3) и получаване на краJния реакционен продукт (толуен)
V.1.5. Алкилиране на бензен с алкени или алкохоли
Алкилиране на бензен може да се извърши и при взаимодействието му с алкени и алкохоли в присъствие на катализатори - силни минерални киселини.
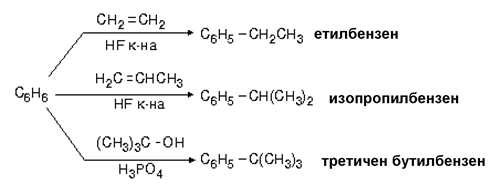
Алкилирането на бензен с пропен или други алкени протича по механизъм на електрофилно заместване, в присъствие на катализатори (HCl, HF и др.) и води по получаване на изопропилбензен (кумол) - краен реакционен продукт:
V.1.6. Заместителните реакции при хомолози на бензена
Халогениране, нитриране и сулфониране протичат много по-лесно с хомолозите на бензена. При алкилбензените под действие на положителния индукционен ефект (+I) – донори на електрони, на алкиловия заместител (R) и положителния мезомерен ефект(М+) на бензеновото ядро, се извършва преразпределение на електронната плътност в бензеновото ядро (σ-π спрягане), като електронната плътност на о- и р-място, спрямо R, е най-висока. Така алкиловите заместители упражняват ориентиращо действие по отношение на следващите заместители в бензеновия пръстен. Следващите (след първия) електрофилни заместители се ориентират на о- и р-място, т.е. електрофилните заместителни реакции при хомолозите на бензена протичат по-лесно в сравнение с бензена.
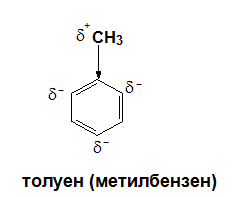
Заместителни реакциите в бензеновото ядро на алкилбензените, протичащи без излишек на заместителния реагент, водят до получаване на смес от о- и р-производни, като е установено, че количеството на р-производните преобладава (>50% добив). При сулфониране на толуен се получава смес от p-толуенсулфонова киселина (53%) и о-толуенсулфонова киселина (43%):
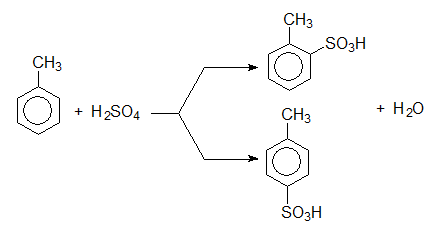
При заместителната реакцията на халогениране на толуен се получава смес от два реакционни продукта. Реакцията протича в присъствие на катализатор (киселина на Люис) по механизъм на електрофилно заместване. Например при хлориране на толуен се получава смес от 2-хлоротолуен и 4-хлоротолуен:
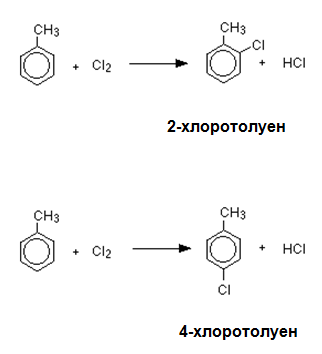
Механизъм на халогениране на толуен:
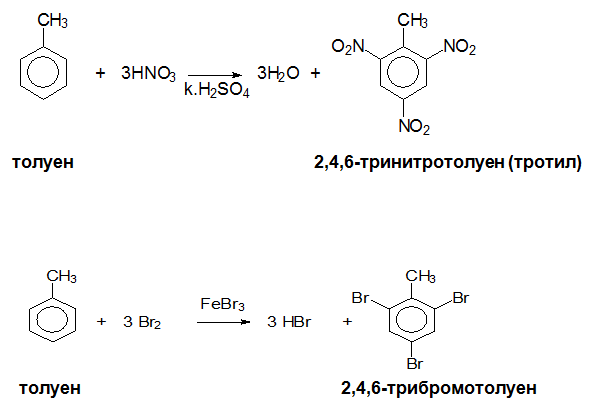
Заместителните реакции в бензеновото ядро на алкилбензени, протичащи в излишък от заместителния реагент, водят до получаване на 2,4,6-тризаместени производни. При нитриране на бензен в излишек от азотна киселина се получава тротил (2,4,6-тринитротолуен), а при бромиране (излишък на бром) - 2,4,6-трибромотолуен.
V.1.7. Заместителни реакции в страничната (R) верига на алкилбензените
При хомолозите на бензена може да протече заместване на водородни атоми в страничната верига (алкиловия радикал, R) при облъчване на реакционната смес със светлина. При тези условия от толуен и хлор се получава бензилхлорид, като реакцията протича по верижно-радикалов механизъм, аналогично на халогенирането на алканите ( Тема 6: Наситени алифатни въглеводороди - Aлкани (парафини), т.V.1. Халогениране):
V.2. ПРИСЪЕДИНИТЕЛНИ РЕАКЦИИ
Ароматните въглеводороди, макар и по-трудно (в присъствие на катализатори -киселини на Люис, и облъчване със светлина) могат да участват и в присъединителни реакции - главно халогениране и хидрогениране (подобно на алкените), но не участват в присъединителни реакции на хидрохалогениране и хидратиране (разлика с алкени). При многоядрените арени ароматният характер е по-слабо изразен, спрямо бензена, поради което те по-лесно участват в присъединителни реакции. Антаценът има по-слабо изразен ароматен характер, спрямо бензенa и нафталена. Той в по-голяма степен се явява като “ненаситено” съединение и за него са по-характерни реакции на присъединяване, отколкото реакции на електрофилно заместване.
V.2.1. Хидрогениране
Арените се хидрогенират каталитично при висока температура до циклоалкани. Хидрогенирането на бензен протича в присъствие на катализатор никел, висока температура и налягане като се получава циклохексан като краен реакционен продукт:
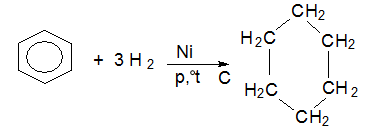
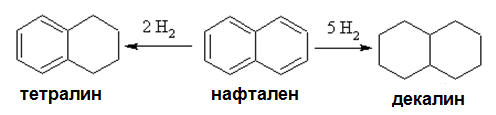
Ароматни въглеводороди с кондензирани ядра (многоядрените арени) се хидрогенират по-лесно, тъй като при тях ароматният характер е по-слабо проявен. При хидрогениране на нафтален реакцията се извършва на два етапа-първо се хидрогенира едното бензеново ядро и се получава тетрахидронафтален (тетралин), а след това и другото и като краен реакционен продукт се получава декахидронафтален (декалин).
V.2.2. Присъединяване на халоген
Подобно на алкените и ароматните въглеводороди могат да присъединяват халогенни елементи (Cl2 и Br2), но присъединяването на халоген към ароматната система протича по-трудно. Бензенът присъединява по верижно радикалов механизъм хлор само под действието на ултравиолетова светлина и крайният реакционен продукт е хексахлорциклохексан:
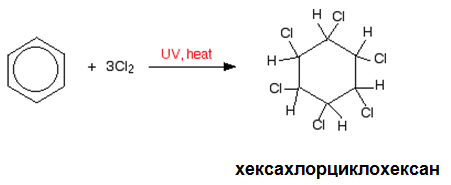
Хексахлорциклохексанът е широко използван в миналото хлороорганичен инсектицид, наречен линдан.
V.3. ОКСИДАЦИЯ (ОКИСЛЕНИЕ)
Горене
В кислородна атмосфера арените изгарят напълно до СО2 и Н2О: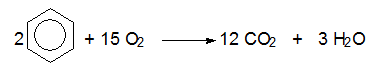
Бензенът се оксидира до малеинов анхидрид при много твърди условия – висока температура и катализатори.
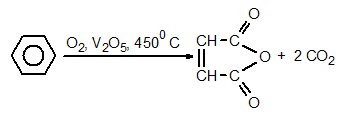
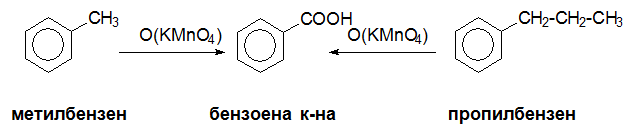
Електронодонорните заместители облекчават оксидацията на ароматното ядро, докато електроноакцепторните оказват противоположното действие. При умерена оксидация на хомолозите на бензена се получава бензоена киселина, независимо от дължината на страничната верига. В резултат на оксидацията разтворът на KMnO4 се обезцветява. Тази качествена реакция служи за разпознаване на бензена от алкилбензените.
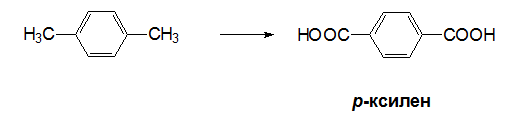
При оксидация на 1,4-диметилбензен (р-ксилен) се получава терефталова киселина – изходна суровина за производството на синтетични влакна, лакове и др. органични съединения.
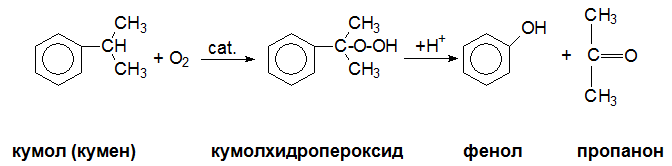
Каталитичната оксидация на изопропилбензен (кумол, кумен) води до получаване на нетрайния кумол-хидропероксид, който се превръща в фенол и пропанон (ацетон) - крайни реакционни продукти. Реакцията е междинен етап при производството на фенол по т.нар. кумолов метод.
Склонността към оксидация на ароматните въглеводороди значително се увеличава от бензен към нафталeн и антрацен. Нафталенът се окислява много по-лесно от бензена. При окисидация на нафтален в зависимост от условията се получава фталов анхидрид или 1,4-нафтохинон.
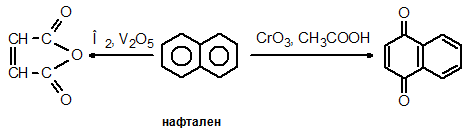
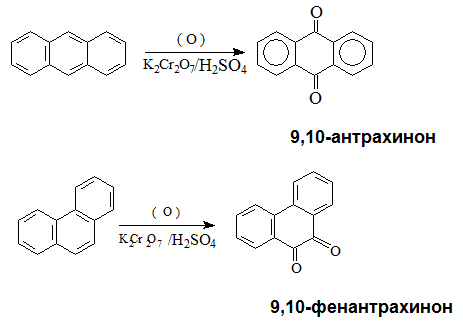
Антраценът и фенантренът се окисляват по-лесно от нафталена и бензена:
VI. ПОЛУЧАВАНЕ

VI.1. MЕТОД НА ВЮРЦ-ФИТИГ – лабораторен метод за получаване на хомолозите на бензена
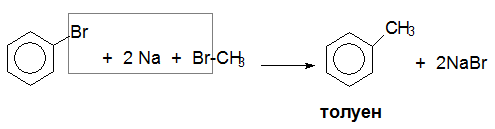
При синтеза на Вюрц-Фитиг освен главния продукт винаги се получава и смес от други въглеводороди, получени в резултат на протичане на странични реакции.
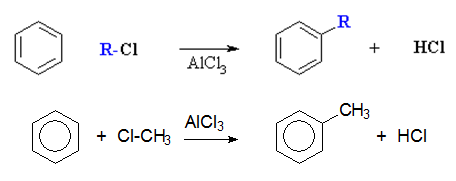
VI.2. СИНТЕЗ НА ФРИДЕЛ-КРАФТС (Friedel-Crafts)
Синтезът на Фридел-Крафтс е метод за получаване на хомолози на бензена чрез алкилиране на бензен с алкилхалогениди и катализатор киселина на Люис.
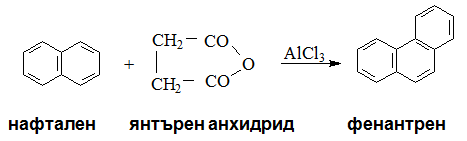
По реакцията на Фридел-Крафтс може да се получи фенантрен отнафтален, янтърен анхидрид и катализатор киселини на Люис.
VI.3. ДЕХИДРОЦИКЛИЗАЦИЯ И КАТАЛИТИЧНО АЛКИЛИРАНЕ НА БЕНЗЕН С АЛКЕНИ
- Каталитична дехидроциклизация на хептан – получава се рeaкционен продукт толуен
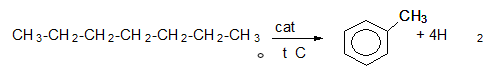
-
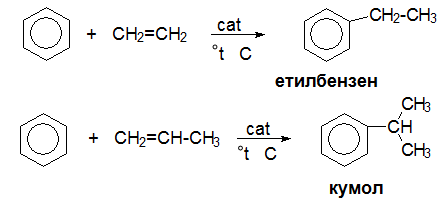
Каталитично алкилиране на бензен с етен – получава се етилбензен, и с пропен до кумол (изопропилбензен).
-
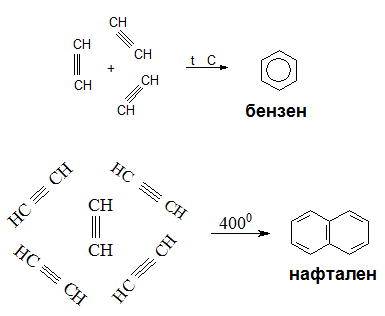
Циклична полимеризация на етин
VII. ПРЕДСТАВИТЕЛИ

VII.1. БЕНЗЕН – С6Н6 (бензол)
Бензен – С6Н6 (бензол) е безцветна, лесно летлива течност със силна характерна миризма. Той е по-лек от водата и не се разтваря в нея, но е добре разтворим в органични разтворители, а и той самия е добър разтворител на мазнини, йод, фосфор, каучук и др. Температурата на кипене на бензена е 80○С. Бензенът е силно токсичен и с доказано канцерогенно действие. В човешкия организъм бензен може да попадне поради замърсяване на околната среда (непълно горене на каменни въглища, на петрол и др.); при работа с нитролакове, в състава на които влиза бензен и др. Бензенът намира широко приложение като изходна суровина в органичния синтез - за получаване на багрила, лекарствени средства, взривни вещества, инсектициди, пластмаси (полистирол), синтетичен каучук и други.
VII.2. ТОЛУЕН (ТОЛУОЛ) – С6Н5СН3
Толуенът е безцветна течност с миризма на бензин. Той е токсичен. Той е добър органичен разтворител, използва се като изходна суровина за получаване на захарин (подсладител), хлорамин Т (антисептик) и взривни вещества.
VII.3. НАФТАЛЕН (НАФТАЛИН) – С10Н8
Нафталенът е бяло, твърдо кристално вещество с характерна миризма с висока летливост. Нафталенът е неразтворим във вода, но добре се разтваря в етанол и бензен. Той и неговите производни се използват при производството на багрила, лекарствени препарати, органични разтворители и др. Нафталенът е изходна суровина за получаването на фталов анхидрид, тетрален, декален и др. Парите му предизвикват дразнене на очите, а при по-продължително въздействие води до увреждане на очите и на дихателните пътища. Възможно е да се поеме чрез вдишване и чрез кожата, което може да доведе до атрофия на зрителния нерв, черния дроб и бъбреците. Съществуват данни за канцерогенен ефект.
VII.4. АНТРАЦЕН – C14H10
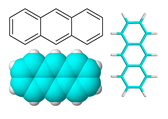
Антраценът е безцветно кристално вещество, разтворим в бензен, толуен, етер, неразтворим във вода, трудноразтворимо в етанол, ацетон, хлороформ и др. Молекулата на антрацена е плоска, образувана от три линейно кондензирани бензенови ядра. Антраценът се използва за получавне на антрахинон, който се използва при производството на много багрила. През 2010 г. астрономи от Испания и САЩ са открили в междузвездното пространство антрацен – регистрирани са катиони от антрацен /С14Н10+/ в плътен молекулярен облък.
VIII. БИОЛОГИЧНО ДЕЙСТВИЕ НА АРЕНИ

Едно- и многоядрените ароматни въглеводороди имат канцерогенно действие. Безенът въздейства главно на централната нервна система, предизвиква левкимия, уврежда сърдечно-съдовата система, половите клетки, а в по-големи количества може да доведе и до безплодие. Доказано е канцарогенното действие на 3,4-бензопирена, който се съдържа в каменовъгления катран и се отделя от бензиновите двигатели, докато от дизеловите – само при неизправност на горивната уредба. Бензопиренът се метаболизира в организма чрез хидроксилиране на епоксиди, които имат мутагенно (увреждат ДНК) и канцерогенно действие. Препаратите против молци съдържат нафтален и р-дихлоробензен, които според Американската агенция за опазване на околната среда (EPA) са канцерогенни. Продължителното вдишване на техните пари може да причини проблеми с централната нервна система, черния дроб, кожата, да доведе до главоболие и много други последици за здравето на човека.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
ароматни въглеводороди - устойчива циклична система със специфичен характер на връзките и специфични химични свойства.
делокализиран π-електронен секстет – шест центрова колективна p-връзка
акцептор – приема
донор - отдава
нитрирна смес – смес от една част азотна и две части сярна киселина (HNO3 : H2SO4 = 1 : 2)
синтез на Фридел-Крафтс - алкилиране на бензен с алкилхалогенид (RX) в присъствие на катализатор безводен AlCl3
въглеводороди с кондензирани ядра - многоядрените арени
синтеза на Вюрц-Фитиг - метод за получаване на хомолози на бензена от алкил- и арилхалогенопроизводни и метален натрий
 ВЪПРОСИ И ЗАДАЧИ
ВЪПРОСИ И ЗАДАЧИ
- Обяснете какво изобразява фигурата:
Отговор
- Колко и кои са позиционните изомери на тринитробензена:
А. 1
B. 2
C. 3
D. 4
Е. няма позиционни изомери.
Отговор
- Възможно ли е да протече химично взаимодействие между:
А. бензен и пропен
B. бензен и етан
С. бензен и 2-метил-2-пропанол
D. бензен и етин.
Напишете възможните химични реакции, условията при които те протичат и наименованията на реакционните продукти.
Отговор
- Катализатор при хлориране на бензен е:
A. HCl
B. NaOH
C. H2SO4
D. FeCl3
Напишете химичната реакция.
Отговор
- Алкиловият остатък ориентира заместителите в бензеновото ядро на:
A. о-място
B. р-място
C. о- и m-място
D. о- и р-място
Отговор
- При бромиране на толуен крайният продукт е (възможен е повече от един верен отговор):
A. 2-бромотолуен
B. 2,4,6-трибромотолуен
C. 3-бромотолуен
D. 4-бромотолуен
Обосновете отговора/ите си като напишете съответната/ите химически реакции.
Отговор
- Чрез синтеза на Фюрц-Фитиг не може да се получи:
А. метилбензен
B. етилбензен
C. бензен
D. бутилбензен.
Напишете поне една химична реакция на този синтезен метод.
Отговор
- Koe от следните твърдения е коректно (възможен е повече от един верен отговор):
A. При присъединяването на Cl2 към бензен се получава хексахлороциклохексан.
B. Склонността към окисление на арените намалява в реда: антрацен > нафтален > бензен.
C. Толуен може да се получи чрез каталитична дехидроциклизация на хексан.
D. Чрез циклична полимеризация на етин при различни условия е възможно да се получат, съответно, бензен и нафтален.
Е. При сулфониране на толуен продуктите са само 2-сулфонтолуенова киселина и вода.
Отговор
- Тротилът е:
A. 1,2,3-тринитробензен
B. 2,4,6-тринитробензен
C. 2-нитротолуен
D. липсва верен отговор - посочете верния отговор.
Напишете химичната реакция за получаване на тротил.
Отговор
- Терефталова киселина може да се получи при окисление на:
А. толуен
B. бензен
C. 1,2 диметилбензен
D. 1,3-диметилбензен
E. 1,4-диметилбензен
Отговор