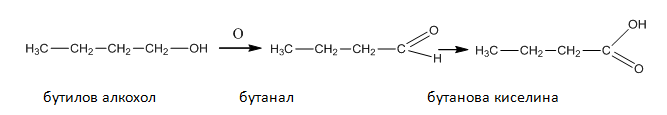ХИДРОКСИЛНИ ПРОИЗВОДНИ НА ВЪГЛЕВОДОРОДИТЕ
АЛКОХОЛИ И ФЕНОЛИ
I. ОПРЕДЕЛЕНИЕ, ХОМОЛОЖЕН РЕД, НОМЕНКЛАТУРА, КЛАСИФИКАЦИЯ

I.1. ОПРЕДЕЛЕНИЕ
или повече Н-атоми са заместени с хидроксилни групи (ОН).
Фенолите са производни на ароматните въглеводороди, в които хидроксилните групи са пряко свързани с бензеновия пръстен.
I.2. ХОМОЛОЖЕН РЕД НА НАСИТЕНИ ЕДНОВАЛЕНТНИ АЛКОХОЛИ
Едновалентните алифатни алкохоли образувт хомоложен ред с обща формула

I.3. НОМЕНКЛАТУРА
- за главна се избира най-дългата въглеводородна верига;
- главната верига се номерира с арабски цифри така, че С-атом свързан с хидроксилната група да получи най-малък пореден номер;
- ако в молекулата на алкохола има повече от една ОН група се прибавят съответните наставки ди-, три- ,тетра- и т. н.;
- Ако молекулата съдържа освен хидроксилна група и сложна връзка (двойна или тройна), използват се и двете окончания, за връзката и за алкохола напр. 2-метилпентен-4-ол-2
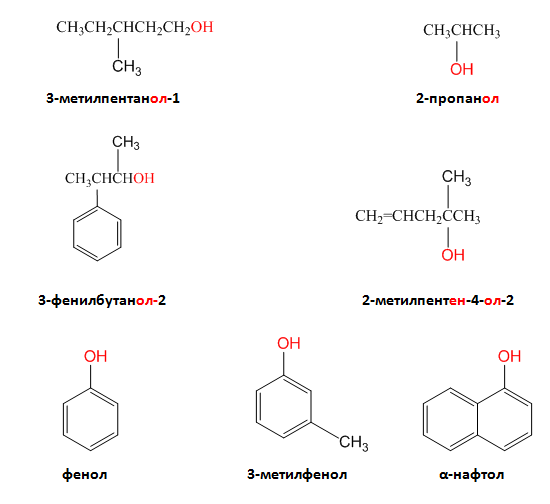
I.4. КЛАСИФИКАЦИЯ НА АЛКОХОЛИ И ФЕНОЛИ
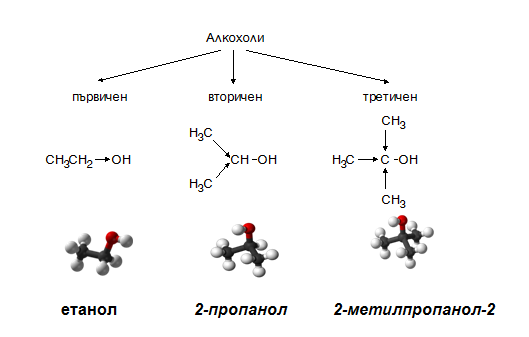
- Според вида на С-атом с който е свързана –ОН група алкохолите биват :
 първични алкохоли - хидроксилната група е свързана с първичен С-атом –метанол, етанол и др.;
първични алкохоли - хидроксилната група е свързана с първичен С-атом –метанол, етанол и др.;
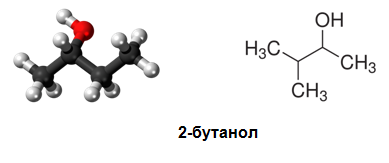
 вторични алкохоли (хидроксилната група е свързана с вторичен С-атом) – пропанол-2; бутанол-2, пентанол-2 и др.
вторични алкохоли (хидроксилната група е свързана с вторичен С-атом) – пропанол-2; бутанол-2, пентанол-2 и др.
 третични алкохоли (когато хидроксилната група е свързана с третичен С-атом) - : 2-метилпропанол-2 (триметилметанол) и др.
третични алкохоли (когато хидроксилната група е свързана с третичен С-атом) - : 2-метилпропанол-2 (триметилметанол) и др.
- Според броя на –ОН групи в молекулата на алкохола или фенола биват:
 едновалентни алкохоли и феноли
едновалентни алкохоли и феноли
Eдновалентните алкохоли и феноли съдържат в молекулата си една –ОН група: алканоли (метанол, етанол и др.), бензилов алкохол, фенол, крезоли, нафтоли и др.;
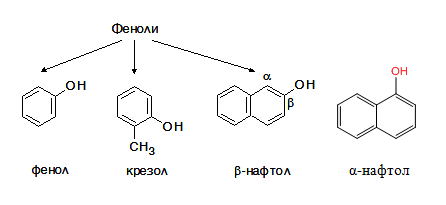
 двувалентни алкохоли и феноли
двувалентни алкохоли и феноли
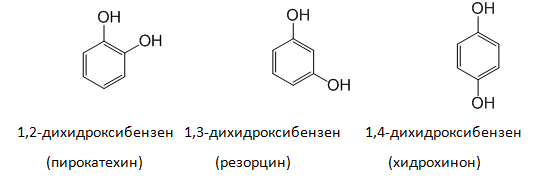
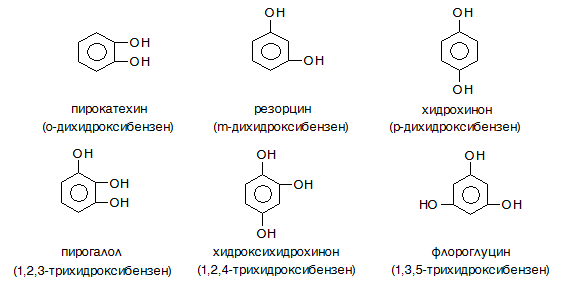
Двувалентните алкохоли и феноли съдържат в молекулата си две ОН групи: етиленгликол, o-, m-, p-дихидроксибензени и др.
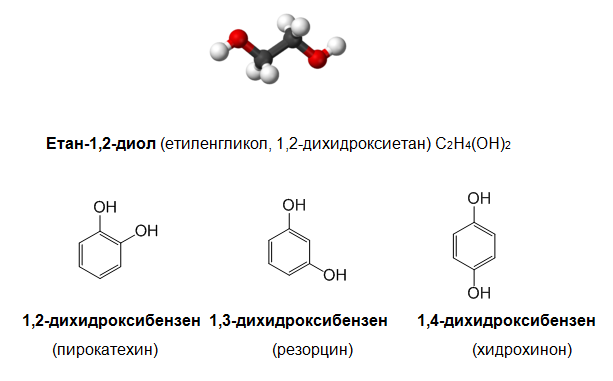
 тривалентни алкохоли и феноли
тривалентни алкохоли и феноли
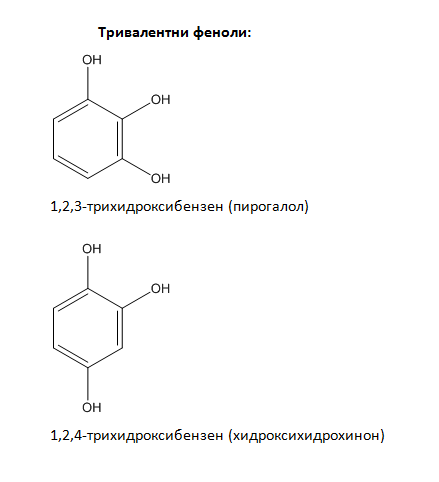
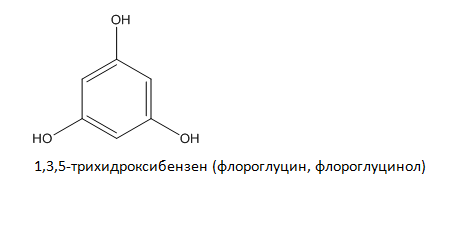
Тривалентните алкохоли и феноли съдържат в молекулата си три –ОН групи: 1,2,3-трихидроксипропан (пропан-1,2,3-триол глицерол), трихидроксибензени: 1,2,3-трихидроксибензен (пирогалол), 1,2,4-трихидроксибензен (хидроксихидрохино), 1,3,5-трихидроксибензен (флороглуцин, флороглуцинол) и др.
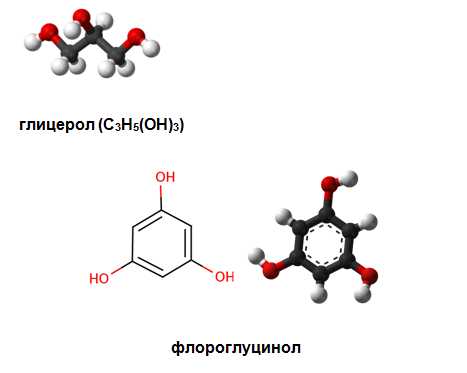
 поливалентни алкохоли
поливалентни алкохоли
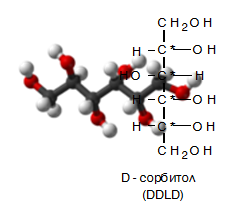
#Поливалентните алкохоли# съдържат в молекулата си повече от три –ОН групи: Хексан-1,2,3,4,5,6-хексол (сорбитол, C6H8(OH)6)), манитол, пентан-1,2,3,4,5-пентанол (ксилитол, C5H7(OH)5), бутан-1,2,3,4-тетраол (еритритол, C4H6(OH)4) и др. Поливалентните алкохоли съдържат в молекулите си асиметрични С-атоми, затова при тях се наблюдава оптична изомерия. Тема: Монозахариди, II. Стереохимия и конфигурация)
- Според вида на С-С-връзка алкохолите биват:
 наситени: етанол, пропанол-1, бутанол-1, бутанол-2 и др.;
наситени: етанол, пропанол-1, бутанол-1, бутанол-2 и др.;
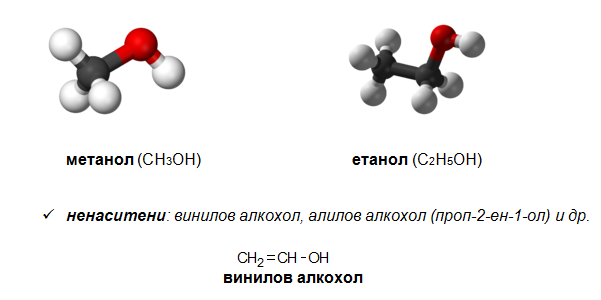
- Според вида на въглеводородния радикал биват:
 алифатни: метанол, етанол, пропанол, бутанол-1, бутанол-2 и др.
алифатни: метанол, етанол, пропанол, бутанол-1, бутанол-2 и др.
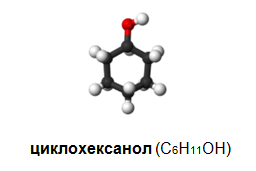
 алициклени: циклохексанол и др.
алициклени: циклохексанол и др.
 ароматни: бензилов алкохол и др. (С6Н5-(СН2)n-OH)
ароматни: бензилов алкохол и др. (С6Н5-(СН2)n-OH)
II. МОЛЕКУЛЕН СТРОЕЖ НА АЛКОХОЛИ И ФЕНОЛИ

Алкохолите и фенолите съдържат в молекулата си силно електроотрицателния О-атом, поради което С–О и Н–О връзки в молекулите им са силно полярни Тема: Видове химични връзки в неорганичните и органични съединения, т. I.2. Ковалентна полярна връзка. Функционалната хидроксилна група на алкохолите е пряко свързана с С-атом в sp3 хибридно състояние. Молекулният строеж на алкохолите е подобен на строежа на водната молекула. Ъгълът R−O−H в молекулата на метанола е равен на 109°, а кислородният атом от хидроксилната група е в sp3 хибридизация.
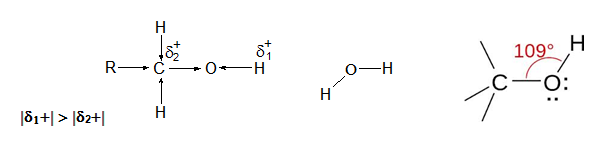
Въпреки голямата електроотрицателност на О-атом, спрямо тази на Н-атом в –ОН група, водородът е с по-малката подвижност от Н-атоми на водата. Поради положителния индукционен ефект (+I) на алкиловите радикали (R) електронната плътност между кислорода и водорода в –ОН група е голяма и връзката е много здрава, затова алкохолите не се дисоциират електролитно т.е. алкохолите са по-слаби киселини от водата и във водните им разтвори не може експериментално да се докаже наличие на водородни катиони (Н+). Увеличаването на броя на –ОН групите в молекулата на алкохолите и взаимното им влияние засилва киселинните свойства на многовалентните алкохоли в сравнение с едновалентните алкохоли.
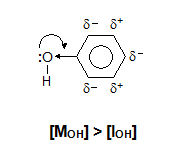
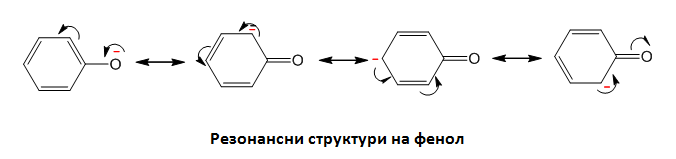
Фенолът съдържа бензеново ядро и –ОН група, която е пряко свързана с ароматно ядро т.е с С-атом в sp2 хибридно състояние. В молекулата на фенола се наслагват два електронни ефекта за хидроксилната група, които са с противоположен знак: положителен мезомерен (+М) и отрицателен индукционен ефект (–I). Под влияние на бензеновото ядро връзката между О и Н в –ОН групата на фенола допълнително се поляризира - полярността на връзката водород-кислород е по-голяма от тази при алкохолите и водата. Бензеновото ядро привлича неподелената електронна двойка на О-атом от –ОН групата на фенола, която се спряга с π-елекроните на бензеновото ядро (+М) и електронната плътност се изтегля към ароматното ядро, което води до намаляване на здравината на връзката между О и Н в –ОН групата. Това е причината фенолът да дисоциира Н+ и фенолатен анион т.е. във воден разтвор фенолите проявяват слабо киселинни свойства. По абсолютна стойност +М ефектът е по-голям от –I ефект, ([MOH] > [IOH]), поради което индуцирания положителен заряд на m-място в бензеновия пръстен ще се запази, а на о- и р-място ще се компенсира и дори ще се получи частичен отрицателен заряд. Затова заместителните реакции в бензеновото ядро на фенола протичат по-лесно от бензена (механизъм на нуклеофилното заместване) и заместителите се ориентират на о- и р-място.
III. ИЗОМЕРИЯ

За алкохолите и фенолите е характерна и позиционна изомерия. Позиционните изомери се различават по мястото на –ОН групите. Позиционни изомери например са 1-пропанол и 2-пропанол.

Накои вторични и поливалентни алкохоли като 2-бутанол и хексит имат в молекулата си *С, което е причина при тях да се наблюдава и оптична измерия:
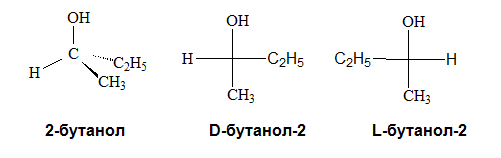
Тези два алкохола (D-бутанол-2 и L-бутанол-2) са оптични изомери. Те имат еднакъв качествен и количествен състав на молекулите си, а се различават само по пространственото разположение на някои атоми или атомни групи (D- и L-конфигурация). Тема 19: Монозахариди, т.II. Стереохимия и конфигурация
Двувалентните и тривалентните феноли имат по три позиционни изомера:
IV. ФИЗИЧНИ СВОЙСТВА

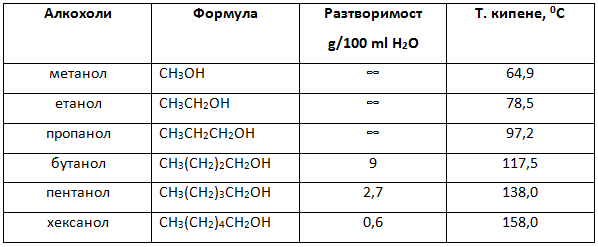
Нисшите едновалентни алифатни алкохоли са безцветни течности, висшите от С12 нататък са твърди вещества. От С1 до С3 имат характерна алкохолна миризма, от С4 до С5 сладникава задушлива миризма, а висшите са без миризма. Най-простите гликолът и глицеролът са визкозни течности. Физичните свойства на алкохолите се определят от алкиловата част от молекулата, която влияе най-вече на температурата на кипене и на разтворимостта им във вода. В хомоложния ред на нормалните алкохоли разтворимостта във вода намалява с увеличаване молекулната маса на алкиловия радикал, а температурата на кипене се увеличава с нарастване на молекулната маса.
Таблица 4. Температури на кипене (т.к.) и разтворимост на някои алкохоли
Както при водата, така и при алкохолите и фенолите се образуват Н-връзки Тема 4: Междумолекулни сили и връзки. Водородна връзка, т.II.1. Междумолекулна водородна връзка между хидроксилните групи. Разтворимостта във вода на низшите първични с нормален строеж членове от хомоложния ред на алкохолите се обяснява с образуване на водородни връзки между алкохолната и водната молекула. Многовалентните алкохоли, ако са течности (етиленгликол, глицерол) имат голям вискозитет и температурите им на кипене са значително по-високи от тези на наситените алкохоли, а температурите на замръзване - съответно по-ниски. Тези свойства на многовалентните алкохоли също се обяснява с образуването на асоциати на базата на водородни връзки, като наличието на по-голям брой хидроксилни групи благоприятства тези процеси.
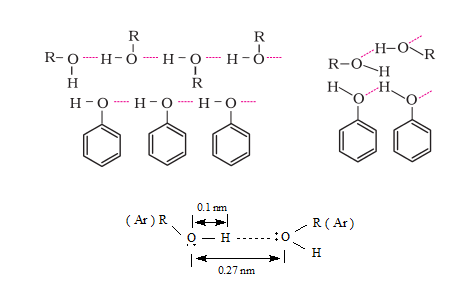
Образуването на водородни връзки (междумолекулни асоциати) обяснява високата температура на кипене на алкохолите, спрямо тази на алканите със същия брой С-атоми т. напр. етанолът е с температурата на кипене 78,5 0С, а пропанът - 42 0С, въпреки че молекулните им маси са почти еднакви. Водородните връзки в етанола са по-слаби отколкото при водната молекула затова и температурата му на кипене е по-ниска в сравнение с тази на водата. Ако в молекулата на алкохола има две или повече хидроксилни групи, то броя на водородните връзки се увеличава и температурата на кипене рязко нараства. Например при OHCH2CH2OH (етиленгликол) температурата на кипене е 197 0С а при HOCH2CH(OH)CH2OH (глицерол) е 290 0С.
Таблица 5. Температури на кипене (т.к.) на някои висши алкани и съответващите им алкохоли

Фенолите са твърди вещества с кристален строеж, които са слабо разтворими във вода. Хомолозите на фенола са неразтворими във вода.
V. ХИМИЧНИ СВОЙСТВА НА АЛКОХОЛИ И ФЕНОЛИ

Химичните реакции при алкохолите се определят от наличието на хидроксилна група, а при фенолите, от хидроксилна група и от бензеновите ядра.
Химичните реакциите, характерни за алкохолите могат да се разделят на три групи:
- реакции при които става разкъсване на връзката О – Н – образуване на соли;
- реакции при които става разкъсване на връзката С – О – образуване на халогениди;
- реакции при които става едновременно разкъсване на връзките О – Н и С – Н.
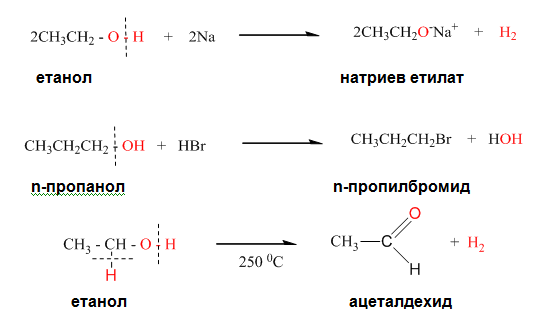
Реакциите от първия тип (разкъсване на връзката О–Н) наподобяват реакциите на водата. Натриевата сол на етанола получена при взаимодействието му с метален натрий се явява органичен аналог на натриевата основа и се използва в органичния синтез, когато е необходим безводен разтвор на основа.
Реакциите с разкъсване на връзката С – О включват междинни продукти срещащи се в химията на алкените. Реакциите при които става откъсване на водороден атом, от въглерода свързан с хидроксилната група се нарича оксидация (окисляване).
V.1. КИСЕЛИННИ СВОЙСТВА НА АЛКОХОЛИ И ФЕНОЛИ
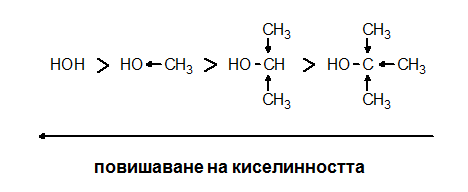
Като киселини първичните алкохоли са слаби, колкото и водата, а вторичните и третичните по-слаби киселини и от водата. Причината за слабите киселинни свойства на алкохолите е положителния индукционен ефект (+I ефект) на алкиловите радикали (R), поради което електронната плътност между кислорода и водорода в хидроксилната група се повишава, здравината на връзката между тях се повишава т.е. в хидроксилната група Н-атом е здраво свързан с О-атом. По тази причина водата е по-силната киселина от алкохолите, като от тях по-силни киселини са първичните следва вторичните и накрая от третичните алкохоли:
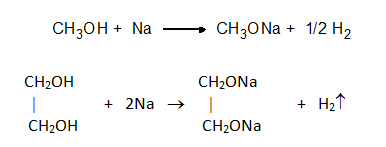
Единствено силно реактивоспособните алкални метали могат да разкъсат връзката между О и Н в –ОН група на алкохолите, като реакцията протича буйно с отделяне на Н2 и получаване на алкохолати. При взаимодействието на метанол с метален натрий се получава натриев метилат, а при етиленгликола – динатриеветилат:
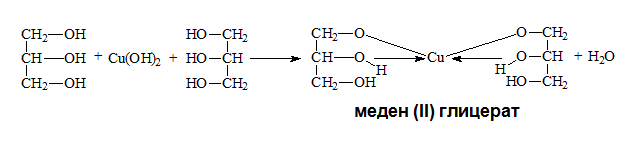
Поливалентните алкохоли взаимодействат с прясно утаен меден(II) хидроксид. При взаимодействие на глицерол с прясно утаен меден(II) хидроксид се получава характерен тъмносин цвят. Синият цвят се дължи на полученото комплексно съединение от меден (II) глицерат. Реакцията се използва за доказване на многовалетни алкохоли със съседни (вицинални) хидроксилни групи.
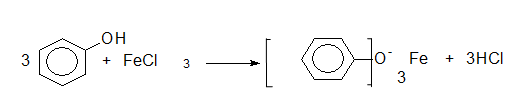
Качествена реакция за доказване на феноли е взаимодействието им с FeCl3, при което се получава сложно съединение с виолетов цвят:
Фенолите са значително по силни киселини в сравнение с водата и алкохолите. Те проявяват киселинни свойства, тъй като р-електронната двойка от кислородния атом се спряга с π-електронния секстет от ароматния пръстен и отрицателният заряд при фенолатният йон се делокализира - равномерно разпределен в бензеновото ядро на о- и р- място.
Влиянието на бензеновия пръстен на свойствата на хидроксилната група се вижда при сравнение на киселинните свойства на фенола и алифатните алкохоли. Фенолът е 106 пъти по-силна киселина отколкото етанола, но примерно и толкова пъти по-слаб отколкото оцетната киселина.
За разлика от алкохолите, които проявяват по-слаби киселинни свойства от водата, фенолите във воден разтвор променят цвета на синия лакмус в червен, т.е. те са слаби киселини:
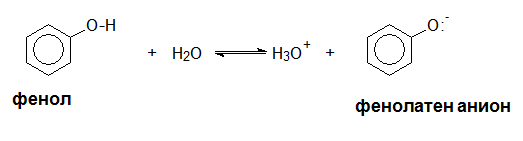
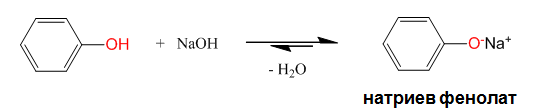
В резултат на изразените киселинни свойства фенолът взаимодейства с NaOH като се превръща в натриев фенолат:
Ако бензеновият пръстен на фенола е свързан с групи способни да стабилизират отрицателния заряд на фенолатния йон, киселинните свойства се повишават. По тази причина p-нитрофенолът е около 500 пъти по-силна киселина от фенола, а 2,4,6-тринитрофенолът (пикринова киселина) е толкова силна киселина колкото и солната киселина (HCl).
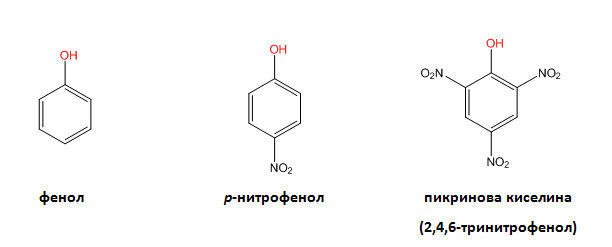
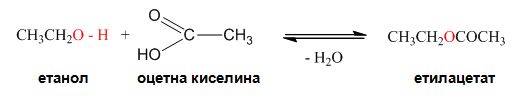
V.2. ЕСТЕРИФИКАЦИЯ
Естерификацията е процес на взаимодействие на алкохол или фенол с органична или неорганична киселина, при който става отделяне на протон от алкохола и хидроксилна група от киселината, следователно при алкохолите се разкъсва само О–Н връзката. С помощта на белязани атоми (18О) е доказано, че при естерификацията хидроксилната група се отделя от карбоксиловата киселина. Естерификацията се катализира от водородните катиони (кисела среда). Реакциите на естерификация са обратими: ако естерите се обработят с вода при съответни условия то те лесно се хидролизират и отново се превръщат в изходните продукти, алкохол и киселина. Естери могат да се получат както с неорганични така и с органични киселини:
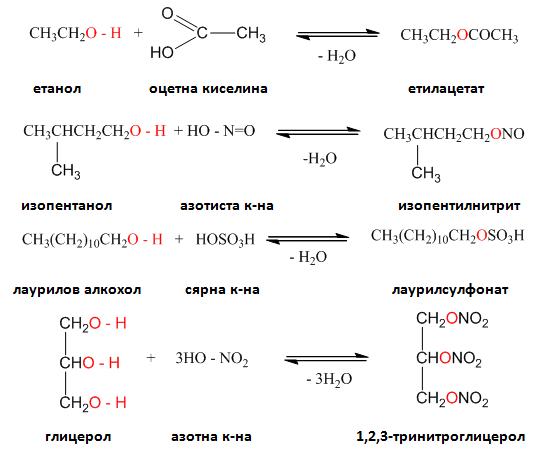
Естерификация протича и при взаимодействие на алкохоли (феноли) с киселинни халогениди. Естерификацията с киселинни халогениди се извършва по-лесно, отколкото с киселина:
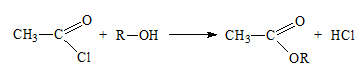
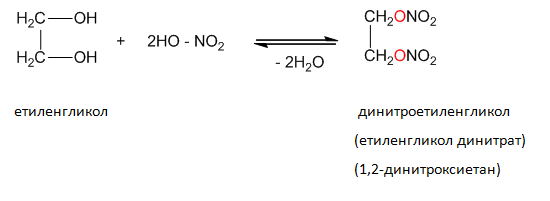
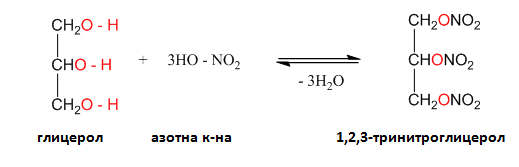
Тринитроглицеролът (естер на глицерола с азотна киселина) и пикринова киселина (2,4,6-тринитрофенол) са взривни вещества.
При естерификация на глицерол с фосфорна киселина се получават глицерофосфати - важни структурни елементи на фосфолипидите, които изграждат клетъчните мембрани.
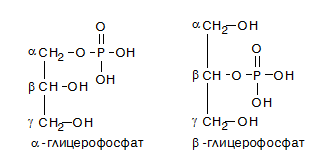
Някои от естерите в посочените примери намират голямо приложение в различни области: изопентилнитрита – използва се за премахване на болката при някои сърдечни заболявания, нитроглицеролът – взривно вещество с промишлено значение от което се произвежда динамит, лаурилсулфоната – изходен продукт за производството на натриев лаурилсулфат, който се използва като детергент в пастите за зъби, трикрезилфосфат – присадка към бензините.
Естерификацията на фенолите не протича директно с киселини, а с киселинни халогениди и анхидриди.
- взаимодействили на фенолати с киселинни халогениди
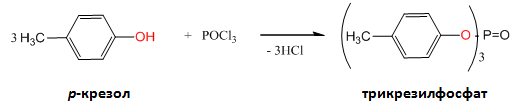
- взаимодействили на фенолати с киселинни анхидриди
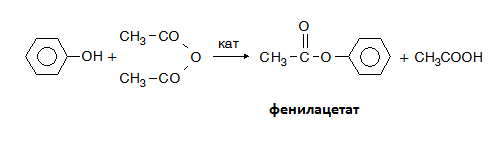
- при взаимодействили на фенолати с ацилхалогениди
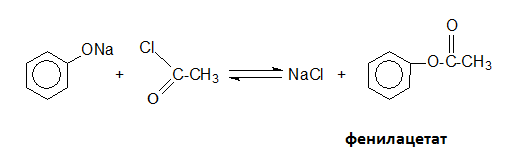
V.3. ОБРАЗУВАНЕ НА ЕТЕРИ
Реакциите за получаване на етери протичат по механизъм на нуклеофилно заместване.
- с алкохоли
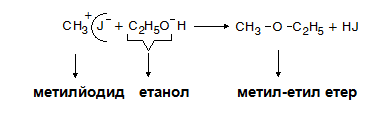
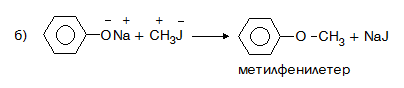
- Получаването на етери от феноли се извършва на два етапа:
а) първи етап - образуване на фенолати
б) втори етап – взаимодействието на фенолата със алкил- или арилхалогенид и получаване на етер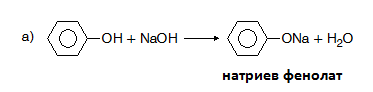
V.4. ДЕХИДРАТАЦИЯ НА АЛКОХОЛИ
Дехидратацията е процес, при който става отцепване на молекула H2O от алкохола при нагряване със H2SO4 и получаване на алкен. Тези реакции се отнасят към втория тип с разкъсване на С–О връзка. В много случаи дехидратацията може да доведе до получаването на няколко изомера. Основният продукт може да се предскаже използвайки правилото на Зайцев: в най-голямо количество се получава алкен съдържащ най-малък брой водородни атоми при двойната връзка. При тази реакция третичните алкохоли реагират най-бързо, вторичните по-бавно а първичните само при силно нагряване като конкуриращ процес е образуването на етери.

Диоли и триоли, в молекулата на които двете /или трите/ ОН-групи са свързани с един и същ С-атом, са нестабилни (правило на Ерленмайер). Чрез обезводняване те се превръщат в други стабилни за обикновени условия съединения :
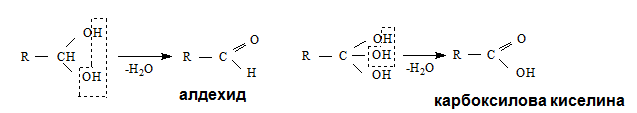

|
При фенолите реакции свързани с разкъсване на С – О връзка не протичат! |
V.5. ОКСИДАЦИЯ (ОКИСЛЯВАНЕ)
Оксидацията на алкохолите протича с разкъсването на два типа връзки: О – Н и С – Н. Нарича се още и дехидрогениране поради отцепването на водород и принадлежат към третия тип реакции.
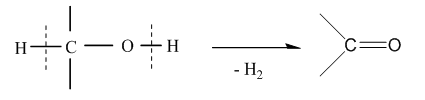
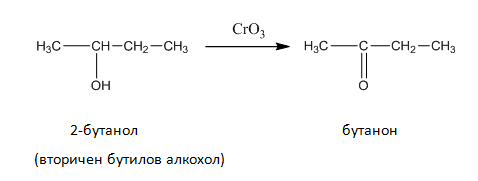
Първичните и вторичните алкохоли лесно се окисляват като първичните се окисляват до алдехиди и киселини, а вторичните до кетони.
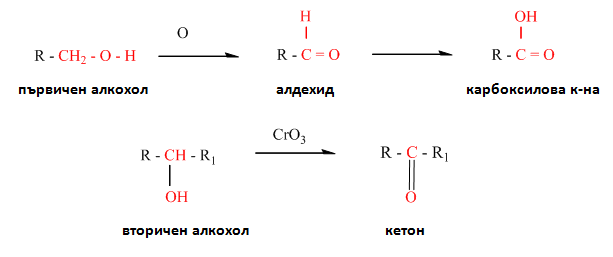
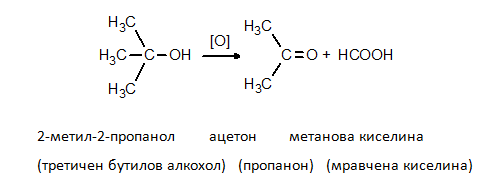
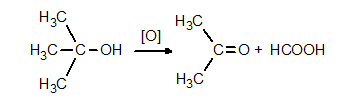
Третичните алкохоли се окисляват трудно, само със силни окислители, съпроводено с разкъсване на С-верига, като се получава смес от карбоксилови киселини с къси въглеводородни вериги и кетони. Тези реакции се използват за препаративно получаване на кетони и киселини. при оксидация на 2-метилпропанол-2 се получава ацетон и мравчена киселина:
Фенолите се окисляват по-лесно от бензена, което се дължи на влиянието на фенолните OH-групи върху бензеновия пръстен, но продуктите на окисление често са сложна смес от органични съединения (винена, лимонена и др. киселини).
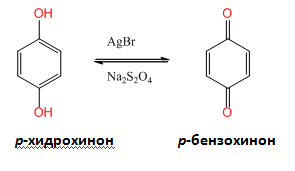
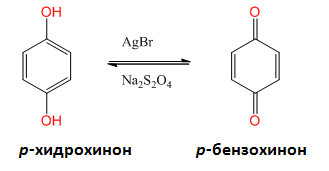
Взаимодействието на фенолите с кислорода от въздуха се използва в промишлеността за получавне на вещества играещи роля на антиоксиданти в бензините, каучука и други продукти. Те реагират с кислорода по-лесно отколкото повечето органични продукти и по такъв начин защитават съединенията от оксидация. р-Хидрохинонът (1,4-дихидроксинебзен), може лесно, селективно и обратимо да се окисли до дикетон (р-бензохинон). Хидрохинонът се използва във фотографията, тъй като е способен да възстанови осветените участъци (кат. AgBr) във фотографската емулсия по-бързо отколкото не осветените.
V.6. РЕАКЦИИ НА ЗАМЕСТВАНЕ В БЕНЗЕНОВОТО ЯДРО
Заместителните реакции в бензеновото ядро на фенола протичат по-лесно отколкото при бензена и протичат по механизъм на нуклеофилното заместване и заместителите се ориентират на о- и р-място в бензеновия пръстен, което е се обуславя от неговия строеж Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т.II. Молекулен строеж на алкохоли и фенолиВодородни атоми от бензеновото ядро могат да се заместват с халогенни атоми, нитро- или сулфо- групи.
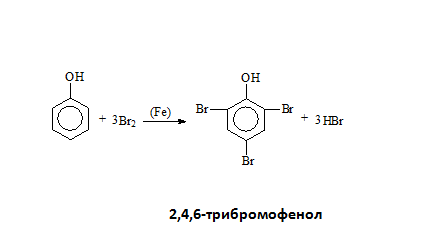
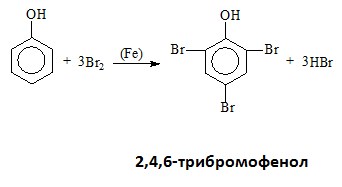
- Халогениране
- Нитриране
При непълно нитриране на фенол се получава смес от два реакционни продукта: 2-нитрофенол и 4-нитрофенол:
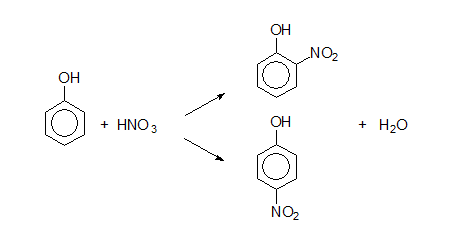
При пълно нитриране на фенол се получава 2,4,6-тринитрофенол (пикринова киселина):
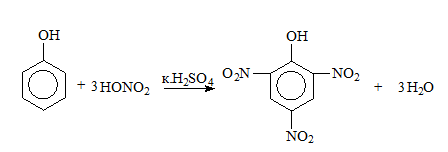
- Сулфониране
Фенолът се сулфонира значително по-лесно от бензена, като се получава 2,4,6-трисулфонова киселина:
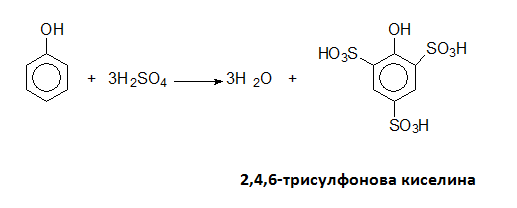
V.7. ПОЛИКОНДЕНЗАЦИЯ НА ФЕНОЛ С МЕТАНАЛ (ФОРМАЛДЕХИД)
При нагряване на смес от фенол и формалдехид, в присъствие на катализатори се получават полифенолформалдехидни смоли (високомолекулни съединения):
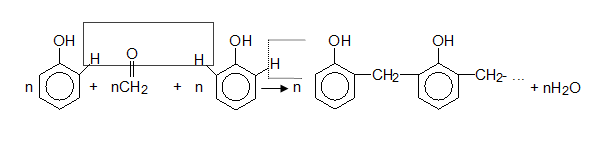
VI. ПРЕДСТАВИТЕЛИ С БИОЛОГИЧНО ЗНАЧЕНИЕ

VI.1. МЕТАНОЛ
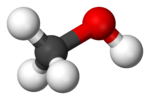
Метанолът – безцветна течност с характерна миризма. Добър полярен разтворител. Силно токсичен както при вътрешно приемане, така и през кожата или чрез вдишване на парите му. В организма се окислява до формалдехид и до мравчена киселина, което води до тежка ацидоза, до увреждане на нервната система и особено на зрителния нерв. Смърт при отравяне с метанол настъпва вследствие на паралич на дихателните пътища. Метанолът се използва в органичния синтез за получаване на формалдехид и много други съединения. Използва се и при двигателите с вътрешно горене като синтетичен заместител на въглеводородите на бензина тъй като изгаря напълно и има високо октаново число. Метанолът промишлено се получава чрез хидрогениране на въглероден оксид.
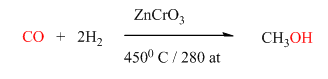
VI.2. ЕТАНОЛ (ЕТИЛОВ АЛКОХОЛ)
Етанолът е безцветна течност, която при дестилация се отделя като азеотропна смес, със съдържание на етанол 95,6 %. Безводният етанол „абсолютен” има т.к. 78,30 С. При смесването на етанол с вода се наблюдава явлението контракция – намаляване на сумарния обем на разтвора. Техническият спирт за горене представлява денатуриран етанол, т. е. етанол към който е прибавена смес от формалин, технически метанол, пиридинови бази и др., поради което е силно отровен и с неприятна миризма. Етанолът е протоплазмена отрова, коагулира белтъчните вещества от цитоплазмата и умъртвява живите клетки. Продължителната му употреба води до хронично отравяне, увреждане на ЦНС, както и на някои вътрешни органи: черен дроб, сърце, бъбреци, панкреас, стомашно-чревен тракт и др. Засягат се и носителите на наследственоста.
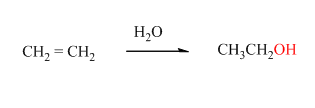
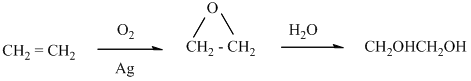
- Промишлено етанолът се получава чрез хидратация на алкени, които са сравнително евтин отпаден продукт при преработката на нефта (при т.н. крекинг процес):
- Етанол в големи количества се получава и чрез алкохолна ферментация на въглехидрати(монозахариди). Характерна е за монозахаридите: D-глюкоза, D-фруктоза, D-маноза и частично за D-галактоза. Причинява се от сборен ензим цимаза, в чийто състав са доказани около 15 отделни ензима. Протича анаеробно, при което около 95 % от монозите се превръщат в етанол и СО2 по общото уравнение.
VI.3. ИЗОПРОПАНОЛ (2-ПРОПАНОЛ)
Изопропанолът е безцветна течност с характерна миризма и т. к. 83,40 С. Добрите му свойства и способността му да поглъща вода определят неговото използване в промишленоста в качеството му на разтворител и като антиобледенител за крилата на самолетите. Използва се и за почистване на СD. Получава се промишлено, чрез хидратация на пропен, а самият пропен се получава при крекинга на нефта.
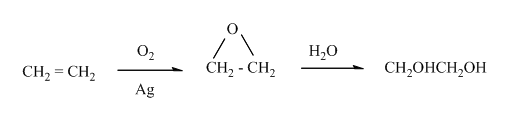
VI.4. ЕТИЛЕНГЛИКОЛ (1,2,-ДИХИДРОКСИ ПРОПАН)
Етиленгликолът намира приложение като основно вещество при производството на антифриз. Използва се и при производството на синтетичното влакно дакрон. Токсичността му за организма се дължи на различните степени на окисление на двете хидроксилни групи, при което се получават различни алдехиди и карбоксилови киселини. Получава се промишлено от етен, през етенооксид и последващо хидрaтиране с вода, като методът е един от най-евтините за получаване на антифриз.
VI.5. ГЛИЦЕРОЛ (ГЛИЦЕРИН)
Глицеролът е безцветна, гъста, силно хигроскопична течност със сладък вкус. Глицеролът се използва в козметиката за получаване на кремове, лосиони, тоалетни съпуни и др. Във фармацевтичната промишленост, в лаково-бояджийската, но най-вече при производството на взривни вещества. Нитроглицеролът, освен като взривно вещество, в малки количества се използва при стенокардия, тъй като действа разширително на коронарните съдове на сърцето.
VI.6. ФЕНОЛ (КАРБОЛОВА КИСЕЛИНА)
Фенолът е безцветно кристално вещество, което на въздуха бързо променя цвета си от розово до кафяв поради оксидация. Той е типична протоплазмена отрова, на което се дължи и приложението му като дезинфекционно средство. Енергоспестяващите крушки излъчват канцерогенен фенол, докато светят, но според производителите количеството е минимално и не представлява заплаха за човешкото здраве. Някои производни на фенола се отличават с по-добри дезинфекционни свойства. Например дезинфекционната течност „лизол” съдържа о-фенилфенол и 2-бензил-4-хлоробензен.

VI.7. КРЕЗОЛИ
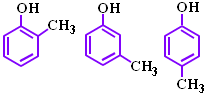
Крезоли са o-, m- и p-хидрокситолуени - три позиционни изомерни форми на хидроксиметилбензена. Те са по-слабо токсични от фенола, но имат и по-силно изразен дезинфекционен ефект от него, поради което се използват като дизенфектанти.
VI.8. ДВУВАЛЕНТНИ ФЕНОЛИ
Пирокатехинът (1,2-дихидроксибензен) е безцветно вещество с миризма на фенол, разтворимо във вода, етанол и етер. Използва се за производство на багрила и лекарства. Производно на пирокатехина е хормона на надбъбречната жлеза – адреналин:
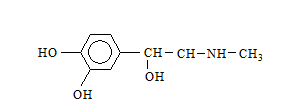
Адреналинът участва в регулацията на сърдечната дейност и при физиологичен стрес се отделя в кръвта.
Резорцинът (1,3-дихидроксибензен) има умерено антисептично действие и се прилага в дерматологията, но неговото основно приложение е в синтеза на азобагрила.
Хидрохинонът (1,4-дихидроксибензен) има антиоксидантно действие и се използва за предпазване от разваляне на хранителни продукти от животински произход. Пирогалолът по физични свойства прилича на пирокатехина, но няма миризмата на фенол. Бързо и количествено поглъща О2 поради което се използва в газовия анализ. Намира приложение и при синтеза на някои багрила.
VI.9. ПОЛИФЕНОЛИ
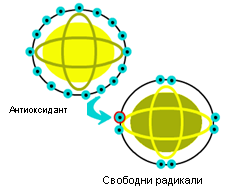
Полифенолите са съединения съдържащи повече от една хидроксилна група, пряко свързани с ароматното ядро. Те образуват комплекси с металните йони и са много добри антиоксиданти – уловители на свободни радикали. Съдържат се във флавониди и танини. Флавонидите са природни полифенолни съединения, съдържащи се във всички висши растения, от които са познати на 10 000 вида. Голяма част от тях са пигменти по растенията: антоциани (червени, сини, виолетови), флавони, флавоноли, аурони, халкони, а безцветните флавони са родоначалници на т.н.
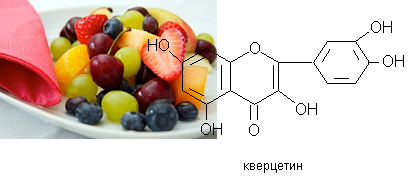
кондензирани танини. Наричат ги натурални антиканцерогенни вещества, които с мощните си антиоксидантни свойства укрепват клетъчните мембрани и имунната система на организма. В растенията флавонидите са под формата на гликозиди, където въглехидратният остатък най-често е под формата на монозахариди (глюкоза, рамноза, галактоза, ксилоза, глюкоронова и галакторонови киселини), ди-, три- и тетразахариди, хидроксибензоени киселини и др. Към тази група се отнася витамин Р, имащ функцията да регулира проницаемостта на капилярите. Типичен представител на биофлавонидите (придаващи син или червен цвят на растенията) е кверцетина, който се отличава с високата антиалергична активност, мощно противовъзпалително действие, който протектира дихателните пътища, очите и др. органи в организма. Способността на кверцетина да укрепва клетъчните стени го превръща в един от най-важните регулатори за хистамина в човешкия организъм, което е от първостепенно значение за дейността на имунната система.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
адреналин - производно на пирокатехина; хормон на надбъбречната жлеза
антиканцерогени - вещества, които с мощнините си антиоксидантни свойства укрепват клетъчните мембрани и имунната система на организма
антиоксиданти - неорганични или органични съединения, които се свързват с или унищожават свободните радикали (токсини, тежки метали, токсични съединения) и спират вредното им влияние върху организма
белязан атом - атом със специфични свойства, използван за проследяване на изменението на даден физикохимичен показател или хода на химична реакция
вторични алкохоли- алкохоли, в молекулите на които хидроксилната група е свързана с вторичен С-атом
двувалентен алкохол/фенол - алкохоли/феноли, които съдържат в молекулата си две –ОН групи
дехидратация - процес, при който става отделяне на молекула H2O от молекулата на химично съединение; обезводняване
дехидрогениране - процес на отделяне на водород от химичните съединения
диоли - хидроксилни производни на въглеводородите, в чиито молекули два Н-атома са заместени с две ОН-групи
едновалентен алкохол/фенол - алкохоли/феноли, които съдържат в молекулата си една –ОН група
естери - органични съединения, в които един органичен радикал заменя един или повече водородни атоми в една кислородсъдържаща киселина
естерификация - процес на взаимодействие на алкохол или фенол с органична или неорганична киселина, при който става отделяне на протон от алкохола и хидроксилна група от киселината
етери - съединения, притежаващи структурно генетична връзка с алкохолите и фенолите; функционалната група на етерите е C-O-C (етерна връзка)
контракция – намаляване на сумарния обем на разтвора
крезоли - o-, m- и p-хидрокситолуени (метилфеноли)
отрицателен индукционен ефект - когато поляризацията на връзките става по посока към атома (заместителя)
положителен индукционен ефект - когато връзките се поляризират от атома (заместителя) към въглеродните атоми
правило на Ерленмайер - всички алкохоли, в молекулите на които OH-групата е свързана с С-атом от -С=С-връзка се превръщат в алдехиди и кетони, тъй като кето-формата е по-стабилна от енолната форма
правило на Зайцев - при реакции на елиминиране на H2O или халогеноводород при вторични или третични алкохоли в най-голямо количество се получава алкен съдържащ най-малък брой водородни атоми при двойната връзка
първични алкохоли - алкохоли, в молекулите на които хидроксилната група е свързана с първичен С-атом
танини - високомолекулни полимерни фенолни съединения с растителен произход
третични алкохоли - алкохоли, в молекулите на които хидроксилната група е свързана с третичен С-атом
тривалентен алкохол/фенол - алкохоли/феноли, които съдържат в молекулата си три –ОН групи
триоли - хидроксилни производни на въглеводородите, в чиито молекули три Н-атома са заместени с три ОН-групи
флавоноиди - клас растителни вторични метаболити с доказани антиоксидантни свойства, базирани около структурата на фенилбензопирена

ВЪПРОСИ И ЗАДАЧИ
1. Относителната киселинност на алкохолите намалява в следния ред:
CH3OH > CH3CH2OH >CH3CH2CH2CH2OH > CH3CH(OH)CH3 > (CH3)3COH.
Дайте обяснение!
Отговор
2. Изразете с химични уравнения оксидацията на бутилов, вторичен бутилов и третичен бутилов алкохол. Как се извършва оксидацията при третичните алкохоли?
Отговор
3. Напишете реакция за получаване на етиленгликол. За какво се използва той?
Отговор
4. Изразете с химични уравнения процесите на естерификация на едно- и двувалентни алкохоли.
Отговор
5. Изразете с химично уравнение нитрирането на глицерола със смес от конц. HNO3 и конц. H2SO4. Как се нарича и какви свойства притежава полученото вещество?
Отговор
6. Какво се получава при бромиране на фенол? Изразете процесът с химично уравнение!
Отговор
7. Напишете химичната реакция за получаване на полифенолформалдехидни смоли.
Отговор
8. За какво се използва хидрохинонът и какъв продукт се получава при неговата оксидация? Напишете химичната реакция на процеса.
Отговор
9. Напишете структурните формули, химичните и тривиални наименования на дву- и тривалентните феноли.
Отговор