Аминопроизводни на въглеводородите(Амини)
В темата за аминопроизводни на въглеводородите (амини) се прави сравнително разглеждане химичните свойства на алифатни и ароматни амини. Отделя се специално внимание на зависимостта между електронния и пространствения строеж на молекулата и основните и нуклеофилни свойства на първични, вторични и третични амини. Разглеждат се представители с биологична значимост от алифатни (диметил- и триметиламин, путресцин и кадаверин, спермидин и спермин), алифатни аминоалкохоли (коламин и холин), ароматни амини (анилин, ацетанилид, фенацитин) и групата на биогенните амини.
В темата са включени и хетероциклични амини, които се съдържат в природни продукти или са получени по пътя на целенасочен органичен синтез, и които имат биохимично, физиологично и фармакологично действие. Химичните им свойства се обясняват чрез сравнение с ароматния характер на бензена, както и чрез обсъждане на влиянието на молекулния строеж върху основните им свойства. От групата на петатомните хетероциклични системи се разглеждат: общият молекулен строеж на съединения от групата, някои техни химични свойства и структурата и биологичното действие на някои по-важни представители. Обсъжда се молекулният строеж и биологичната роля на важни природни пиролови багрила (хромопротеиди): хемоглобин, хлорофил и др. От групата на шестатомните хетероциклични съединения се разглеждат общият молекулен строеж на съединенията от групата, някои техни химични свойства, структурата и биологичното действие (в т.ч. лечебното и предпазното действие) на някои по-важни представители от пиридинова група (пиридинкарбоксилови киселини, никотиламид, корамин, римифон, клопидол, пиридоксол, пиридоксал, пиридоксамин). Специално се изтъква влиянието на целенасочените малки промени в молекулната структура върху терапевтичното действие.
I.Определение, класификация, номенклатура

I.1. Определение

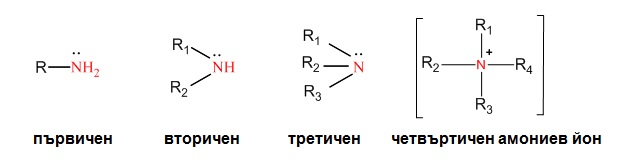
I.2. Класификация на амини
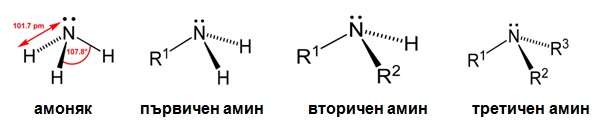
I.2.1. Според вида на въглеводородния радикал свързан с аминогрупата биват:
- алифатни - N атом е свързан с алифатен радикал;
- ароматни - N атом е свързан непосредствено с бензеново ядро;
- арил-алифатни (смесени) амини.
I.2.2. Според броя на въглеводородните радикали, които са свързан с аминогрупата биват:
- първични амини- един алкилов радикал е свързан с N-атом;
- вторични амини - към N-атом са свързани два алкилови радикала;
- третични амини - към N-атом са свързани три алкилови радикала;
- четвъртични (кватернерни) амониеви соли - към азотния атом са свързани четери алкилови радикала.
I.3. Номенклатура
Названията на амините могат да се образуват по два начина:
- като производни на въглеводородите с представка амин
- като производни на амоняка с наставка амин
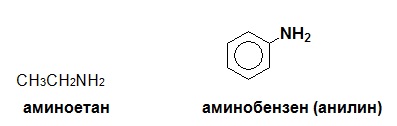
Простите алифатни амини обикновено образуват наименованието си присъединявайки названието на алкиловия остатък, който те съдържат към думата амин. Например: метиламин, етиламин, пропиламин и т.н.
хексиламин (аминохексан)
N-етилпропиламин
Съществува разлика при използването на понятията първичен, вторичен и третичен амин и първичен, вторичен и третичен алкохол. При амините това понятие показва броя заместени водородни атоми в молекулата на амоняка, а при алкохолите с какъв С-атом е свързана хидроксилната група (линк Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т. I.4. Класификация на алкохоли и феноли).
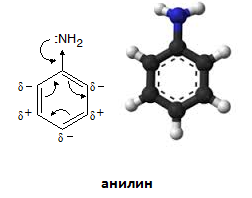
В реда на ароматните амини родоначалник е анилина. Много ароматни амини се разглеждат като производни на анилина. За да не се сгреши мястото на заместителите, дали са при азота или в бензеновия пръстен се използва префикс N- за заместителите при азота.
анилин N-метиланилин N,N-диметиланилин
Според номенклатурата IUPAC наименованията на някои представители се образуват както следва:
дифениламин 2-(N-етиламино)-4-метилпентан
N,N-диметиланилин метилетил-N-пропиламин
II. МОЛЕКУЛЕН СТРОЕЖ - Стериохимия на амини

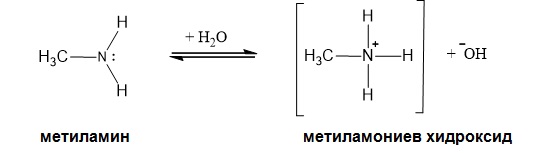
Азотният атом в молекулите на NH3, мастните и ароматните амини притежава неподелена електронна двойка, към която може да се присъедини протон (основни свойства). Те както и амоняка представляват слаби основи и с киселините образуват разтворими соли.
алкиламин амоняк анилин
Алкиловите радикали (R) имат положителен индукционен ефект (+I), поради което в молекулата на алифатните (мастни) амини те отдават електронна плътност към азотния атом (N) и увеличават локализацията на електронната двойка при N-атом на аминогрупата (–NН2). Наличието на неподелена електронна двойка при N-атом в молекулите на амоняка, мастните и ароматните амини определя способността им да приобщават протон (основен характер) и сходството в химичния им характер. Алифатните амини са по-силни основи (бази) от NH3, тъй като според съвременната теория за киселини и основи, всички молекули, които могат да присъединят протон са основи и колкото по-лесно присъединяват протон, толкова е по-силно изразен основния им характер. Ако се съпостави основния характер на NH3 с този на първичните, вторичните и третични мастни амини, би следвало с нарастване на броя на R да се засилва основния характер. Тази закономерност се спазва частично.
Обемистите R затрудняват достъпа на протон до неподелената електронна двойка при N-атом , с което се понижава основния характер към третичните амини.
Азотният атом в молекулите на NH3, първичните, вторични и третични алифатни амини е в sp3-хибридно състояние, като едната sp3-орбитала е заета от неподелената електронна двойка. Молекулите им имат форма на правилен тетраедър с връх N-атом, но валентните ъгли C–N–H и H–N–H са по-малки от 109,5о, което се обяснява с взаимното отблъскване на неподелената електронна двойка и електроните от N—Н- и N—С- връзки т.е. тетраедърът е деформиран (линк Тема 3: Видове химични връзки в неорганичните и органични съединения, т. VII.1. SP3 Хибридизация), поради липса на четвърти заместител при N-атом:
Мезомерният ефект (M, ефект на спрягане, резонансен ефект) е предаване на електронна плътност по спрегната система на π - връзки. Амино групата в молекулата на ароматните амини съдържа неподелена електронна двойка при N-атом, която се спряга с π - електроните на бензеновото ядро и се делокализира като отдава електронна плътност към бензеновия пръстен - проявява положителен +M. Амино групата има отрицателен индукционен ефект (–I), който по абсолютна стойност е по-малък от нейния +M, в резултат на което в молекулата на анилина (аминобензен) на о- и р-място се индуцират частични отрицателни заряди.
резонансни структури на анилин
III. Физични свойства

Амините са по-слабо полярни в сравнение с алкохолите, но по-силно полярни, спрямо въглеводородите. Връзката N – H е по-слабо полярна от връзката O – H затова при амините асоциирането на молекули, вследствие на образуване на водородни връзки, е по-слабо изразено.
Нисшите членове от хомоложния ред на алифатните амини са газове с миризма на амоняк и риба. Те са разтворими във вода – образуват водородни връзки (линк към водородни връзки) с водните молекули.
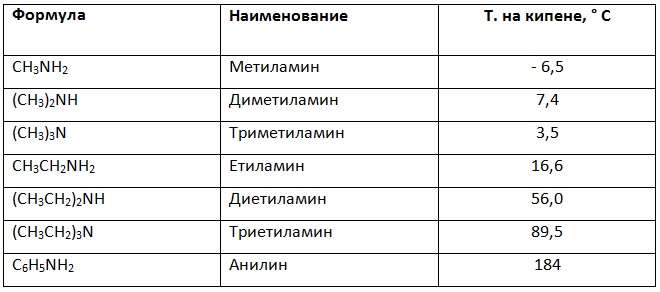
С увеличаване на молекулната маса алифатните амини преминават в течности и твърди тела, а миризмата им отслабва. Метанолът при стайна температура е течност (т.к. 65 ° С), амините съдържащи до три С-атома при същите условия са газообразни. В таблицата 13 са представени температурите на кипене на някои алифатни амини и анилина.
Таблица 13. Температури на кипене на алифатни и ароматни амини
Първичните алкиламини имат по-висока т.к. от съответните алкани, но по-ниска т.к. от съответните алкохоли (фиг. 85). Това се дължи на асоциирането на молекулите на амините, вследствие на образуване на водородни връзки, които обаче са по-слаби от тези при алкохолите (връзката N – H е по-слабо полярна от връзката O – H).
Фиг. 85. Зависимост на т.к. на алкани, алкохоли и амини от молекулната им маса
IV.Химични свойства

IV.1. Основни (базични) свойства
Различията в основността на алифатните и ароматни амини е аналогична на киселинността при алкохолите и фенолите и се обуславя от същата причина ( Тем 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т. V.1. Киселинни свойства на алкохоли и феноли). Алифатните амини, (напр. метиламин) са толкова силни бази като амоняка, докато типичният ароматен амин - анилинът е многократно по-слаба основа. В алифатните амини, както и в амоняка, електронната двойка, която е отговорна за основните свойства, е локализирана при азотния атом. Както вече бе обяснено при строежа на ароматните амини електронната плътност е делокализирана и равномерно разпределена на о- и р- място в бензеновия пръстен. Тази делокализация понижава енергията на несвързаните електрони и ги прави по-малко достъпни за образуване на връзка с протон.
IV.2. Заместителни реакции в бензеновия пръстен на ароматни амини
Анилинът и неговите производни лесно встъпват в реакции на заместване о- и р- места в ароматното ядро. Високата реакционна способност се обяснява с голямата стабилност на положително зареденият междинен комплекс, вследствие на делокализацията на електронната двойка на N-атом.
- Присъединяване на халоген
IV .3. Реакция с азотистата киселина ( HNO2)
Една от най-полезните за практиката реакции на първичните амини е реакцията им с азотистата киселина (HNO2), която води до получаване на диазониеви соли.
Първичните, вторичните и третичните амини реагират по различен начин с HNO2.
- Първични алифатни амини
Първичните алифатни амини реагират бързо с азотистата киселина и количествено се получава алкохол и се отделя свободен азот. Ако се събере и измери обема на отделения азот при стандартни условия (температура и налягане), реакцията може да служи като удобен метод за анализ на амини (метод на Ван Слайк).
- Първични ароматни амини
Първичните ароматни амини реагират с HNO2 при 00С като се получават диазониеви соли.
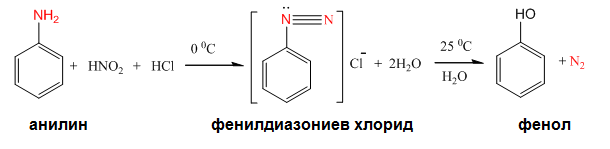
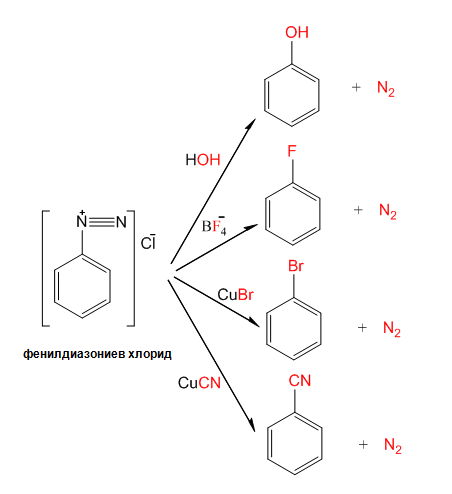
Диазониевите соли са много реактивоспособни съединения, които се взривяват при изсушаване. Тяхната голяма реактивоспособност ги прави идеални междинни съединения за синтез на други органични вещества (виж реакциите). Реакциите на диазониевите соли протичащи със солите на едновалентната мед са известни като реакции на Зандмайер.
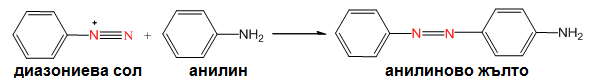
Диазониевите соли встъпват в други важни химични реакции, реакции на азосъчетаване, който водят до получаването на голям клас вещества наречени азобагрила. Незаместеният азот от диазогрупата се явява като слаба киселина на Люис и встъпва в реакции на ароматно заместване с много реактивоспособни съединения производни на анилина и фенола. Получените азосъединения са силно оцветени и намират приложение като багрила. Първото получено азобагрило през 1863 г. е анилиново жълто.
- Вторични амини
- Третични амини
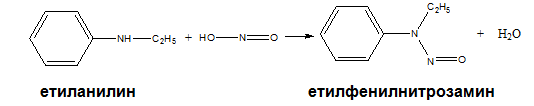
Вторичните амини с HNO2 дават нитрозамини – съединения с доказан канцерогенен ефект.

|
Третичните амини не реагират с азотистата киселина! |
V. ЧЕТВЪРТИЧНИ АМОНИЕВИ СОЛИ

Тези соли могат да се разглеждат като производни на неорганичните амониеви соли, в които азотният атом е ковалентно свързан с четири радикала и няма свободна електронна двойка при азотния атом. По такъв начин четвъртичният амониев йон сам по себе си се явява основа и свойствата на неговите разтвори се определят от природата на асоциираните аниони. Така например четвъртичните халогениди са неутрални, докато четвъртичните хидроксиди по своята основност приличат на натриевата основа. Четвъртичните амониеви соли се използват при производството на някои сапуни и антисептични средства. Те играят важна роля и при физиологичните процеси протичащи в организма на човека и животните. Такива съединения са холинът и ацетилхолинът. Ацетилхолинът присъства във вид на комплекс в клетките на нервните възли и се отделя когато те се възбудят. Ацетилхолинът на свой ред стимулира съседната нервна клетка, която също отделя ацетилхолин и по такъв начин се предава нервният импулс. След като ацетилхолинът изпълни своята роля и е стимулирал съседната нервна клетка, той трябва бързо да се дезактивира. Тази дезактивация се съпровожда с хидролиза на ацетилхолина от ензима ацетилхолинестераза на холин и оцетна киселина. Всяко вещество нарушаващо този цикъл на предаване на нервния импулс, бързо предизвиква паралич или смърт.
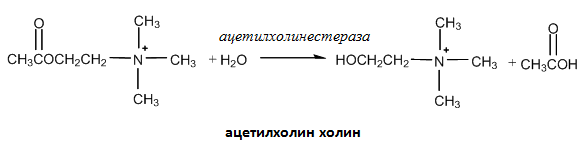

Някои лекарствени средства съдържащи четвъртична амониева група се конкурират с ацетилхолина и блокират предаването на нервния импулс. Едно от най-ефективните вещества от такъв тип е хексаметилдекаметилендиамоний-декаметоний 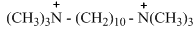 , което се използва като мускулен релаксант
, което се използва като мускулен релаксант
Друг пример е използваният от индианците алкалоид кураре с който са намазвали остриетата на стрелите си. В медицината това вещество се използва за промотиране на мускулна релаксация.
VI. ХЕТЕРОЦИКЛЕНИ АМИНИ

Ако азотният атом на амините се намира в пръстенна структура, такива амини се наричат хетероциклични амини – най-разпространените хетероциклени съединения. Азотосъдържащите хетеропръстенни съединения са веществата с незаменими в биологично отношение свойства. Към тях се причисляват хемоглобин, хлорофил, някои витамини, пиримидинови и пуринови бази, нуклеинови киселини. Много от N-съдържащите хетероциклични съединения проявяват базичен характер, поради наличието на координативно ненаситен N-атом с неподелена електронна двойка. Свойствата на наситените хетероциклени амини са такива както и на нецикличните аналози. Пиролидинът и пиперидинът встъпват в реакции характерни за вторичните алифатни амини. Обаче, ако пръстенът е с ароматна структура, тогава аминът може да проявява необикновени свойства - хетероциклените амини имат ароматни свойства, наподобяващи свойствата на бензена.
Най-типичните представители на хетероцикличните амини са пиридина (шестатомен хетероцикъл) и пирола (петатомен хетероцикъл).
VI.1. Пирол
Пиролът е петатомен хетропръстен със система от две спрегнати двойни връзки, при който p-електронната двойка на N-атом се спряга с π-електроните на двойните връзки.
Фиг. 86. Молекулен строеж на пирол
Пиролът проявява свойства на ароматно съединение, тъй като двата неподелени електрона при N-атом се използват за запълване на π-електронния секстет при съчетаването с четирите електрона от двойните връзки (sp2 хибридизация на четирите C-атома). Поради по-голямата електроотрицателност на азота от въглерода, π-електронният облак е изтеглен към азота, с което се обяснява повишената електронна плътност на α-място и полярността на пироловата молекула (фиг. 86).
Резонансни структури на пирол
При пирола електронната двойка при азотния атом в значителна степен участва в ароматния пръстен, поради което азотът е загубил основните си свойства и не е способен да притъкмява протони т. е. пиролът не проявява типичния основен характер на вторичен амин. Пиролът проявява известни киселинни свойства - водородният атом от имино групата може да се замества с алкален метал.
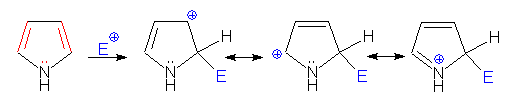
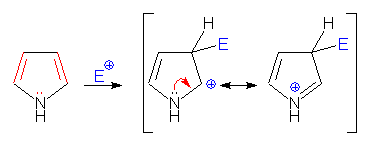
VI.1.1. Електрофилно заместване
Поради ароматните свойства на пирола за него и хомолозите му са характерни електрофилни заместителни реакции: халогениране, сурфориране и нитриране. Резонансните структури на образувания σ-комплекс при електрофилно заместване в пирол са:
- електрофилно заместване при С2:
- електрофилно заместване при С3:
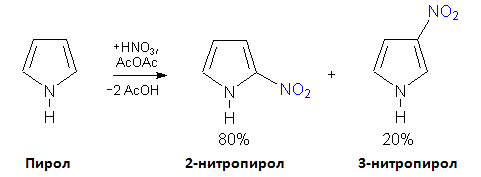
- нитриране на пирол
Нитрирането на пирола се извършва по механизъм на електрофилно заместване и води до получаване на 80% 2-нитропирол и само 20% 3-нитрофенол.
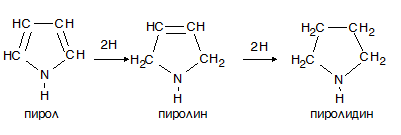
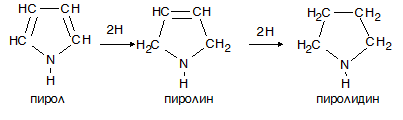
VI.1.2. Редукция на пирол
Хидрогениране редукция на пирол се извършва трудно. При меки условия се извършва хидрогениране само на α-място, като се получава пиролин (дихидропирол), а при енергична редукция се получава пиролидин (тетрахидропирол). Пролинът и пиролидинът проявяват основен характер като типични вторични амини. Причината за това, е че при присъединяване на водород изчезва ароматната структура и неподелената електронна двойка при N-атом може да притъкмява протон.
Производни на пиролидина са аминокиселините пролин и хидроксипролин ( Тема 16: Аминокарбоксилови киселини) Пиролидинът влиза в състава на някои алкалоиди като никотин и др. Пироловите ядра влизат в структурата на порфина – кристално тъмно червено вещество лежащо в основата на хемоглобина и хлорофила. Порфинът е с устойчива ароматна структура и се състои от четири пиролови пръстена свързани с четири метинови групи. Порфинът съдържа 30 делокализирани π-електрона, 11 спрегнати двойни връзки и четири двойки p-електрони при N-атоми. Четирите пиролови ядра са равностойни, което предполага миграция на протоните между N-атоми.
Хемоглобинът пренася кислород от белите дробове до клетките. Една хемоглобинова молекула свързва 4 молекули кислород.
Въглеродният оксид може лесно да измества O2 от оксихемоглобина и да се получи карбоксихемоглобин, на което се дължи токсичното действие на CO.
В молекулата на хлорофила вместо Fe2+ се съдържа Mg 2+ и има някои разлики в заместителите в пироловите структури. Хлорофилът участва в реализацията на фотохимичната синтеза. Фотохимичната синтеза е процес при който от CO2 и H2O се синтезират въглехидрати и кислород. Този процес се явява формално обратен на дишането.
VI.2. Пиридин
Пиридинът представлява хетероциклен аналог на бензена, в който един С-атом и свързаният с него водород са заменени от атом азот. Електронната плътност в молекулата на пиридина е неравномерно разпределена за разлика от бензена, поради наличието на N-хетероатом (фиг. 87, 88).
Фиг. 87. Молекулен строеж на пиридин
Фиг. 88. Резонансни структури на пиридин
VI.2.1. Основни свойства
Пиридинът притежава основни свойства поради наличието на неподелена електрона двойка при азотния атом, но по-слабо изразени от тези на алифатните амини. Доказателство за неговия основен характер е взаимодействието му с вода, при което се образува пиридиниева основа, както и взаимодействието с протонни киселини, при което се образуват соли, които лесно се хидролизират във вода.
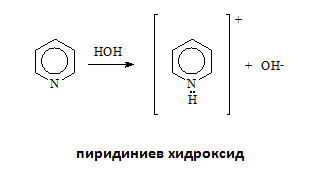
Пиридинът със силни киселините образува стабилни комплексни соли, които във воден разтвор хидролизират.
Като третичен амин пиридинът взаимодейства с алкилхалогениди (алкилирането протича при N-атом) и се получават четвъртични алкилпиридиниеви соли.
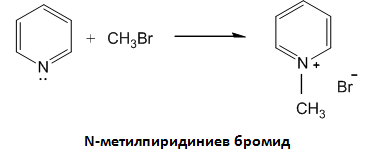
Наред с основните свойства пиридинът проявява и ароматни свойства, затова встъпва в електрофилни и нуклеофилни заместителни реакции, поради нееднаквото разпределение на електронната плътност на π-секстета при пиридина.
VI.2.2. Електрофилно заместване
Нитрирането и халогенирането на пиридина са електрофилни заместителни реакции (предимно на 3(β)-позиция). Неговата активност в електрофилните заместителни реакции е много по-ниска от тази на бензена, ( Тема 10: Хидроксилни производни на въглеводородите - алкохоли и феноли, т. V.6. Реакции на заместване в бензеновото ядро) поради значителната дезактивация на пиридиновия пръстен.
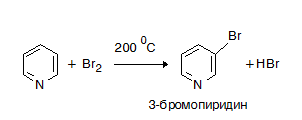
VI.2.3. Нуклеофилно заместване
Нуклеофилните заместителни реакции при пиридина се извършват на α- или χ- позиции, където електронната плътност е най-малка. Реакции с натриев амид аминиране и алкилиране на пиридин протичат по механизъм на нуклеофилно заместване.
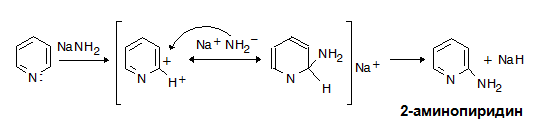
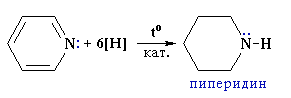
VI.2.4. Редукция
Пиридинът встъпва в реакции на каталитично хидрогениране (подобно на бензена), при което се получава пиперидин, който е силна основа и проявява свойства на вторичен амин.
VI.2.5. Биологично-активни производни на пиридин
- Пиридинкарбоксилови киселини.
Известни са α-, β- и γ- изомери на пиридинкарбоксиловите киселини, които са с тревиални наименования: пиколинова, никотинова и изоникотинова киселини.
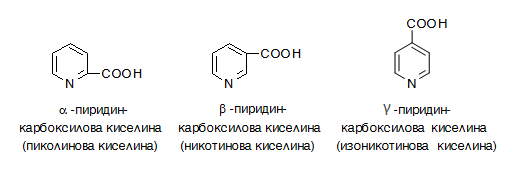
Хидразидът на изоникотиновата киселина (изониазид, римифон, тубазид, INH, ХИНК) е един от най-активните противотуберкулозни препарати, никотинамидът е амид на никотиновата киселина и е известен като витамин РР. Недостигът в организма на витамин РР води до загрубяване на кожата, което е известно като болеста пелагра. Биологично значимо производно на пиридина е и витамин В6.
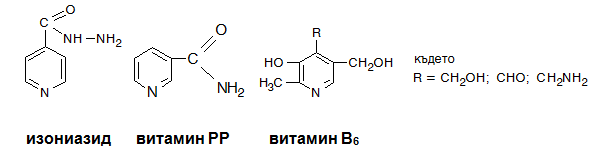
VI.3. Имидазол, индол, пиримидин и пурин
Към хетероцикличните амини се числят имидазол, индол, пиримидин и пурин и техни производни.
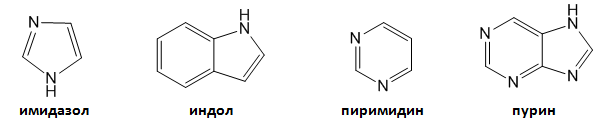
Хетероциклични амини с голямо значение за жизнените процеси са пурините (гуанин и аденин) и пиримидините (цитозан, тимин и урацил).
VI.4. Алкалоиди
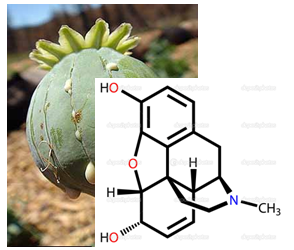
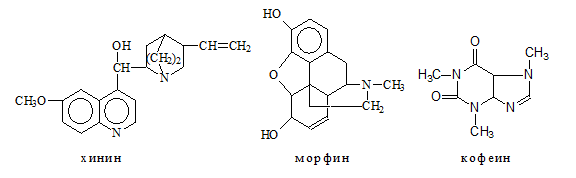
Алкалоидите са азотсъдържащи съединения от растителен произход и представляват най-големия клас хетероциклени амини, които се срещат в природата. Много от тях притежават силно изразено физиологично действие и се използват като лекарствени препарати. Към този клас се отнасят морфина, хинина, кофеина и другите алкалоиди на опиума.
VII. БИОГЕННИ АМИНИ

Биогенните амини са широко разпространени в биологичните видове. Те са нискомолекулни хетерогенна група биологично-активни вещества. Биогенните амни биват:
- ендогенните биогенни амини се образуват в организма чрез декарбоксилация на аминокиселините;
- екзогенните биогенни амини могат да постъпят в организма от външната среда, които обикновено са отпадъчни продукти при процесите на ферментация и гниене.
Някои биогенни амини осъществяват определени функции в организма като хормони и невромедиатори. В зависимост от химичната си структура, биогенните амини се обособяват в няколко групи:
- Катехоламини съдържат катехолов остатък. Биогенни амини от тази група са допамин, норадреналин, адреналин.
Биосинтезата на катехоламиновите биогенни амини протича по следната схема:
- Индоламини - съдържат индолов остатък. В организма се получават при обмяната на аминокиселината триптофан. Биогенни амини от тази група са триптамин и серотонин.
- Имидазоламини - съдържат имидазолов остатък. В организма се получават при обмяната на аминокиселината хистидин. Биогенен амин от тази група е хистамин.
- Други - ацетилхолин, тирамин, фенилетиламин, путресцин, кадаверин, спермин, спермидин.
Към биогенните амини се причисляват и диамините путресцин и кадаверин.
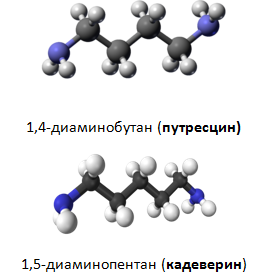
Кадеверинът и путресцинът са продукти на гнилостния разпад на белтъците (трупни отрови). Кадеверинът се образува при ензимна декарбоксилация на аминокиселината L-лизин, а путресцина - на L-орнитин.
КЛЮЧОВИ ПОНЯТИЯ И СЪКРАЩЕНИЯ
алкалоид - азотсъдържащи органични съединения, които имат физиологично въздействие върху нервната система на хората и животните; имат алкален характер; обикновено са производни на аминокиселините
анилиново жълто - жълто азо-багрило, производно на азобензен
асоцииран - присъединен
ацетилхолинестераза - ензим, който разгражда (чрез своята хидролитична активност) невротрансмитера ацетилхолин, до холин и ацетат
база - основа, химично съединение с основни свойства
биогенни амини - органични нискомолекулни съединения с биологичен произход, съдържащи амино-група (NH2)
валентен ъгъл - ъгъл между химични връзки
вторични амини - амини, в молекулите на които амино-групата е свързана с вторичен С-атом
делокализация - преразпределение
диазониеви соли - група органични съединения, съдържащи обща функционална група: R-N≡N+X-, където R-въглеводороден остатък, Х-халоген
екзогенни амини – биогенни амини, които могат да постъпят в организма от външната среда, които обикновено са отпадъчни продукти при процесите на ферментация и гниене
ендогенни амини – биогенни амини, които се образуват в организма чрез декарбоксилиране на аминокиселини
киселина на Люис - химично съединение, което може да приема електронна двойка от Люисова база, която се проявява като донор
неподелена електронна двойка - сдвоени електрони
нитрозамини - органични химични съединения, които се получават при взаимодействието на нитрити с вторични амини
първични амини - амини, в молекулите на които амино-групата е свързана с първичен С-атом
реакции на Зандмайер - реакции между диазониеви соли и солите на едновалентната мед
третични амини - амини, в молекулите на които амино-групата е свързана с третичен С-атом
хетероциклични амини - азотният атом на амините се намира в пръстенна структура
префикс - част от думата, която се намира пред корена; представка

ВЪПРОСИ И ЗАДАЧИ
- Температурата на кипене на мастните амини е по-ниска от тази на съответните алкохоли. Обяснете защо!
Отговор
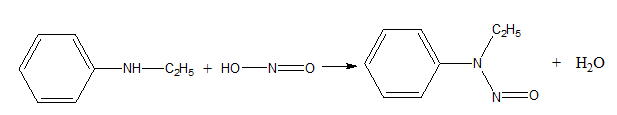
- Изразете с химични уравнения взаимодействието на следните вторични и третични амини: а) етиланилин; б) диетиланилин, с HNO2.
Отговор
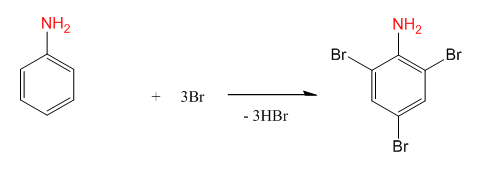
- Изразете с химично уравнение бромирането на анилин. Какъв ориентант е аминогрупата?
Отговор
- Как се обяснява ароматния характер на пирола и пиридина? Азотът (хетероатом) придава ли координативно ненаситен характер на хетероцикличните съединения?.
Отговор
- Може ли пирола и пиридина да участват в присъединителни реакции? Дайте примери!.
Отговор
- Какви продукти се получават при хидрогениране на пирол? Сравнете характера им (основен, неутрален, кисел) с този на пирола.
Отговор
- Избройте в кои важни в биологично отношение вещества участва петатомен азот-съдържащ пръстен!.
Отговор
- Кои пиримидинови бази участват в изграждането на нуклеиновите киселини? Напишете химичните им наименования като производни на пиримидина!.
Отговор
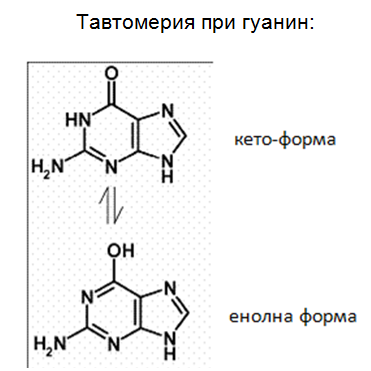
- Покажете със съответни структурни формули тавтомерията при гуанина!.
Отговор
- Към коя група амини се причислява хининът? Напишете структурната му формула!.
Отговор
- Към коя група амини се причисляват морфинът, кофеинът и адреналинът? Напишете структурните им формули!.
Отговор


Проект „Развитие на център за електронни форми на дистанционно обучение в Тракийски университет“ BG051PO001-4.3.04-0026